修回日期: 2007-01-01
接受日期: 2007-01-10
在线出版日期: 2007-06-28
目的: 真核细胞中表达和纯化乙肝病毒L蛋白颗粒, 并初步分析其物理特性与抗原性.
方法: 真核表达质粒pSVsigLM-S-瞬时转染COS-7细胞, 收集48 h后的培养上清采用CsCl等密度平衡离心、蔗糖密度梯度超速离心和酶联免疫吸附试验(ELISA)3者结合的方法纯化L蛋白, 获得的纯化产物行Western blotting鉴定和透射电镜(TEM)观察.
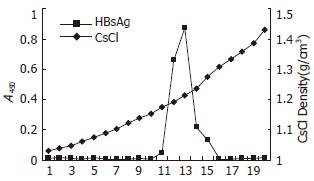
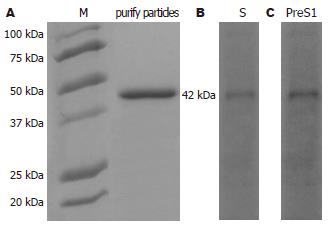
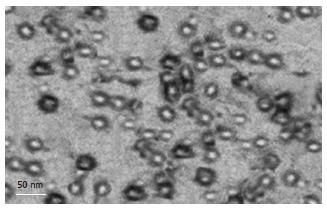
结果: 采用超速离心结合ELISA法可以纯化L蛋白,CsCl等密度平衡离心显示在密度约1.21 g/cm3处富含S抗原性. SDS-PAGE证实产物主要由一种42 kDa的蛋白分子组成, Western blotting证实这种蛋白为同时具有S与PreS1抗原性的L蛋白. 透射电镜显示分泌的L蛋白自行组装成约23 nm的球形颗粒.
结论: 融合外源性信号肽能有效的引导L蛋白的组装和分泌. CsCl和蔗糖超速离心能高效纯化L颗粒并保持其完整的抗原性及颗粒形态.
引文著录: 曾建平, 易继林, 杨志芳. 乙型肝炎病毒L蛋白颗粒的真核表达与纯化. 世界华人消化杂志 2007; 15(18): 1995-1999
Revised: January 1, 2007
Accepted: January 10, 2007
Published online: June 28, 2007
AIM: To explore the expression and purification of hepatitis B virus L particles in eukaryotic cells and to analyze their physical properties and antigenicity.
METHODS: COS-7 cell lines were transiently transfected with recombinant eukaryotic expression vector pSVsigLM-S-. The products were purified from cell culture supernatants after 48 h culture by a combination of CsCl isopycnic ultracentrifugation, density gradient ultracentrifugation in sucrose, and enzyme-linked immunosorbent assay (ELISA). Molecular sizes and antigenicity of the purified protein were determined by SDS-PAGE and Western blotting, respectively. The physical properties of samples were characterized by transmission electron microscopy (TEM).
RESULTS: L particles were successfully purified from transfected COS-7 cell medium by ultracentrifugation combined with ELISA. Cscl isopycnic ultracentrifugation showed that the area where density was 1.21 g/cm3 was rich in S-antigenicity. L particles exclusively consisted of glycosylated 42 kDa proteins that had S and PreS1 antigenicity. TEM showed that HBsAg produced by COS-7 cells had physical properties very similar to the 22 nm particles derived from human plasma and recombinant yeast cells.
CONCLUSION: L protein can translocate into ER lumen and form subviral particles after budding by fusing a secretion signal sequence to the N terminus of the L gene. L particles can be efficiently purified by ultracentrifugation and retain their biochemical activity and physical appearance.
- Citation: Zeng JP, Yi JL, Yang ZF. Expression and purification of large hepatitis B virus surface antigen particles produced in eukaryotic cells. Shijie Huaren Xiaohua Zazhi 2007; 15(18): 1995-1999
- URL: https://www.wjgnet.com/1009-3079/full/v15/i18/1995.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i18.1995
乙肝病毒表面抗原由3种分别命名为L蛋白(large protein)、M蛋白(middle protein)、S蛋白(small protein)的跨膜蛋白组成, 其中S蛋白为表面抗原的主要成分, M蛋白包含整个的S蛋白序列以及由55个氨基酸组成的PreS2多肽, L蛋白则包含整个的M蛋白序列以及由约109或168个氨基酸组成的PreS1区[1]. 来源于血清或酵母细胞的传统乙肝疫苗主要是由S蛋白或M蛋白组成的颗粒抗原, 然而约10%的接种者对这种疫苗出现不反应或者低反应的现象[2-3]. 基于PreS1抗原抗体系统在阻止乙肝病毒感染过程中的重要作用, 越来越多的研究者试图采用各种方法将PreS1多肽融合到传统疫苗中以增强疫苗的免疫原性[4-10]. 理论上将包含整个PreS1和PreS2区的L蛋白作为免疫原能最大程度上激发机体对乙肝病毒的清除能力, 然而与S和M蛋白不同的是, 无论是在哺乳细胞还是酵母细胞, L蛋白虽然能插入到细胞的内质网膜但是不能出芽到内质网腔组装成颗粒[11]. 最新的研究发现通过基因工程方法将外源性信号肽融合到PreS1区的氨基端能清除这种出芽阻滞作用[12]. 本实验的目的在于利用一种融合了β内酰胺酶信号肽(β-lactamase signal)部分编码序列的真核表达质粒pSVsigLM-S-, 通过CsCl和蔗糖密度梯度超速离心技术, 纯化并鉴定L蛋白颗粒.
真核表达载体pSVsigLM-S-由德国Bruss教授惠赠(pSVsigLM-S-包含全部的乙肝表面抗原编码基因序列(adw2), 编码基因中S和M蛋白的起始密码子ATG通过点突变为ACG, 以阻止S和M蛋白的同期表达, PreSk区的氨基端融合β-内酰胺酶信号肽的5'端32个氨基酸编码序列[12]). COS-7细胞系由华中科技大学同济医学院免疫教研室提供; DMEM培养基为Gibco公司产品、胎牛血清为Hyclone公司产品; 鼠抗HBsAg(ad/ay)、鼠抗PreS1(a.a.132-a.a.137)mAb购自ViroStat公司; ELISA试剂盒购自上海科华公司, 其余试剂均为国产或进口分析纯试剂.
1.2.1 细胞培养与蛋白表达: COS-7细胞系常规培养于DMEM培养基, 质粒pSVsigLM-S-采用DEAE-葡聚糖法瞬时转染, 48 h后收集细胞培养上清. DEAE-葡聚糖法参照分子克隆实验指南(第3版).
1.2.2 蛋白颗粒的超离心纯化: 细胞培养上清1200 r/min离心10 min以去除细胞碎片, 澄清后的上清缓慢加入终浓度为100 g/L的PEG6000粉末, 室温下搅拌30 min后4℃过夜. 混合物10 000 g离心30 min, 沉淀重新融解于10 mL离心缓冲液(10 mmol/L Tris-HCl, pH 7.5, 150 mmol/L NaCl, 1 mmol/L EDTA), 20 000 g离心30 min去除未溶解的物质, 样本做进一步的连续超离心纯化. CsCl粉末加入样本溶液至终浓度为250 g/L(w/w), 随后转入Ultra-clear离心管160 000 g、10℃离心16 h(Beckman SW-41). 从上往下以每管500 μL收集样品, 共收集20管. ELISA法确定并收集富含HBsAg的样品, 4℃透析过夜.
超离心管依次加入浓度为600, 500, 400, 300, 200, 100 g/L各1.5 mL的蔗糖溶液(离心缓冲液配制, w/w), 顶端加入初步纯化的样品1 mL, 120 000 g、4℃离心16 h(Beckman SW-41). 从上往下以每管500 μL收集样品, 共收集20管. ELISA法确定并收集富含HBsAg的样品, 4℃透析(PBS)过夜后冻干保存.
1.2.3 纯化产物的SDS-PAGE和蛋白印迹: 纯化蛋白电泳前加等体积2×SDS加样缓冲液, 100℃水浴10 min, 冰浴冷却后20 µL加样行120 g/L SDS-PAGE. 蛋白分离后经考马斯亮蓝染色, 脱色液脱色后JS-300凝胶图像分析仪分析结果. 行Western blotting时蛋白分离后, 电转至硝酸纤维素膜, 一抗(鼠抗PreS1 1:200、鼠抗S 1:200)4℃过夜, 二抗室温反应2 h, 增强化学发光法(ECL)显影, 暗室压片.
1.2.4 纯化产物透射电镜: 取少量纯化的样品滴于铜网, 20 g/L磷钨酸复染, 透射电子显微镜(FEI Tecnai G2 12型)下观察颗粒形态.
S细胞培养上清中的表面抗原颗粒能选择性的被PEG沉淀, 这种沉淀方法被认为能最大程度上回收表面抗原, 最少程度上减少杂质污染[13]. 随后的样品进行CsCl密度梯度离心, 形成典型的梯度片段, ELISA法证实片段12和13富含HBsAg抗原性, 提示此区段存在密度约1.21 g/cm3的颗粒(图1). 将12, 13管片段合并后透析除去CsCl, 样品继续进行蔗糖密度梯度离心, 分管收集的片段如前行ELISA检测HBsAg抗原性, 证实13-16片段存在S抗原性, 合并片段后透析过夜.
纯化产物行SDS-PAGE后以考马斯亮蓝染色, 证实主要由一种分子量约42 kDa的蛋白分子组成(图2A), Western证实这种蛋白为同时具有PreS1和S抗原性的L蛋白(图2B-C). 进一步采用Braford法和RIA法分别检测总蛋白浓度和L蛋白浓度, 表明L蛋白纯度>90%.
PreS1抗原抗体系统在阻止乙肝病毒感染的过程中的作用主要基于以下一些发现: (1)乙肝患者血浆中抗PreS1抗体出现在抗S、抗HBc、抗HBe抗体之前[14-15]; (2)PreS1抗原aa21-47被证实是病毒与肝细胞特异性结合的位点[16-17]; (3)针对PreS1抗原的抗体能有效清除HBV的感染[18-20]. 目前包含有PreS1区段的乙肝病毒疫苗主要有2种, 一种如疫苗HepageneTM, 只融合部分的PreS1片段(aa21-47), 因而可能丧失了部分潜在的PreS1区抗原表位[4,10]. 另一种如来源于中国仓鼠卵巢细胞的重组S颗粒(Bio-Hep-BTM), 虽然包含含量很低(<3%)的完整L蛋白, 但是其免疫潜能高于任何其他主要由S或M颗粒构成的传统疫苗[5,21-23]. 因此, 纯化一种主要由L蛋白组成的颗粒抗原无疑是具有前景的第4代疫苗.
蛋白工程中常常使用外源性的信号肽以引导目的蛋白的胞外分泌, 德国的Bruss教授通过在PreS1的氨基端融合β内酰胺酶信号肽以试图使PreS1区段正确的易位到内质网腔, 结果显示融合了外源性信号肽的质粒能有效的分泌L蛋白到细胞培养上清, 而没有融合外源性信号肽的质粒其合成的L蛋白大量积聚在细胞的分泌组件附近[12]. 虽然Bruss教授并没有检测上清中L蛋白的物理特性, 然而进入宿主细胞分泌组件的L蛋白, 可能与S及M蛋白类似, 具有自行组装成颗粒性分子的功能. 因此使用这种质粒可能纯化出主要由L蛋白组成的颗粒. 为了避免破坏蛋白本身的免疫原性以及颗粒形态, 我们采用连续的密度梯度超速离心技术来纯化细胞培养上清中的表面抗原. 转化后的细胞培养上清经过包括澄清、蛋白沉淀、连续的超速离心等一系列过程纯化.
纯化后的样本采用SDS-PAGE和Western blotting方法鉴定目的蛋白分子量及抗原性, SDS-PAGE显示纯化样本主要由一种分子量约42 kDa的蛋白组成, Western blotting则证实这种蛋白为同时具有PreS1和S抗原性的L蛋白分子, 这种L蛋白与天然的糖基化L蛋白分子量相同[1], 提示经真核细胞表达的L蛋白能被正确的修饰化. 与此同时, 在理论上S和M蛋白的显色区均未见明显的条带, 表明样品中不含有S或M蛋白的表达, 其结果与质粒的S蛋白编码启动子突变相符合. 基于这种发现我们认为通过在L蛋白编码基因的氨基端融合外源性信号肽能有效引导L蛋白的胞外分泌. 电镜观察显示这种L蛋白能自行组装成约23 nm的颗粒, 在CsCl中的浮力密度约1.21 g/cm3. 这种物理特性与天然的HBsAg颗粒以及经酵母来源的S及M颗粒类似[24-25], 因此进入到正常分泌途径的L蛋白与S及M蛋白一样可组装成颗粒型抗原. 进一步通过测定总蛋白浓度与L蛋白浓度, 我们证实纯化的样品中L蛋白的纯度>90%. 表明密度梯度离心能很好的分离纯化分泌的L蛋白, 并能保持其本身的免疫原性和颗粒构型.
这些结果表明通过在PreS1的氨基端融合外源性的信号肽能有效的消除PreS1区段对L蛋白的分泌阻滞作用, 而采用简单的超速离心技术即能获得高纯度的L蛋白颗粒, 这种颗粒包含整个的乙肝病毒包膜多肽表位, 理论上能同时激发抗PreS1和PreS2的抗体, 从而具有更强的免疫原性和病毒清除能力. 然而目前这种系统仍然存在较大的缺陷. 例如无法大量制备L颗粒, 其次培养血清中的异种蛋白可能污染疫苗导致临床应用时激发非特异性免疫反应. 一种可行的办法是构建含无血清培养基的稳定表达系统. 如Deml et al[26]利用来源于果蝇的Drosophila Schneider-2稳定转染细胞系, 采用无血清培养基加CuSO4诱导, 成功提取高纯度的HBsAg颗粒[26]. 此外甲醇营养型酵母(Pichia pastoris)是一种新型的外源蛋白表达系统, 不仅具有原核生物生长快, 操作简便的特点, 而且具备哺乳类细胞翻译后加工和修饰的功能[27-28]. 利用甲醇营养型酵母获得高产量乙肝表面抗原颗粒的实验已经获得成功, 并且证实能被很好的修饰, 能诱发高滴度的抗体形成[29-32]. 因此未来可以构建能在甲醇营养型酵母中表达L颗粒的表达系统以获得高批量、高质量的疫苗.
疫苗是预防HBV感染的重要手段, 然而约10%的接种者对目前的商业化疫苗出现不反应或者低反应的现象. 最近有关PreS1抗原抗体系统在阻止乙肝病毒感染过程中的作用得到广泛的关注, 越来越多的研究者试图采用各种方法将PreS1多肽融合到传统疫苗中以增强疫苗的免疫原性.
提高疫苗的免疫原性是目前乙肝疫苗研制的热点, 虽然一些研究者已经成功表达各类包含多种病毒蛋白多肽的融合疫苗, 然而如何提高新型疫苗的产量和纯度, 使之能安全有效的应用是目前疫苗研究普遍遇到的难题.
基于PreS1多肽的出芽阻滞作用, 无论是在哺乳细胞还是酵母细胞, L蛋白虽然能插入到细胞的内质网膜但是不能出芽到内质网腔组装成颗粒. 本研究使用外源性信号肽引导L蛋白的胞外分泌, 通过CsCl和蔗糖密度梯度超速离心技术, 纯化出一种主要由L蛋白组成的颗粒抗原.
这种主要由L蛋白组成的颗粒疫苗包含高比例、完整的PreS1多肽, 和目前商业化疫苗以及其他融合疫苗相比, 可能具有更强的免疫原性和阻断乙肝病毒感染的能力.
本文论述了乙型肝炎病毒L蛋白颗粒的真核表达与纯化, 对乙型肝炎病毒的研究有一定的指导意义, 方法成熟, 资料可信.
编辑: 张焕兰 电编:郭海丽
| 3. | Wood RC, MacDonald KL, White KE, Hedberg CW, Hanson M, Osterholm MT. Risk factors for lack of detectable antibody following hepatitis B vaccination of Minnesota health care workers. JAMA. 1993;270:2935-2939. [PubMed] |
| 4. | Shouval D, Ilan Y, Adler R, Deepen R, Panet A, Even-Chen Z, Gorecki M, Gerlich WH. Improved immunogenicity in mice of a mammalian cell-derived recombinant hepatitis B vaccine containing pre-S1 and pre-S2 antigens as compared with conventional yeast-derived vaccines. Vaccine. 1994;12:1453-1459. [PubMed] |
| 5. | Pride MW, Bailey CR, Muchmore E, Thanavala Y. Evaluation of B and T-cell responses in chimpanzees immunized with Hepagene, a hepatitis B vaccine containing pre-S1, pre-S2 gene products. Vaccine. 1998;16:543-550. [PubMed] |
| 6. | Yang HJ, Chen M, Cheng T, He SZ, Li SW, Guan BQ, Zhu ZH, Gu Y, Zhang J, Xia NS. Expression and immunoactivity of chimeric particulate antigens of receptor binding site-core antigen of hepatitis B virus. World J Gastroenterol. 2005;11:492-497. [PubMed] |
| 7. | Qin S, Tang H, Zhao LS, He F, Lin Y, Liu L, He XM. Cloning of HBsAg-encoded genes in different vectors and their expression in eukaryotic cells. World J Gastroenterol. 2003;9:1111-1113. [PubMed] |
| 8. | 卫 军, 刘 小金, 李 光地, 汪 垣, 张 祖传, 王 玉琴, 陆 志檬. 重组乙肝表面抗原前S1(21~47aa)片段与GST融合蛋白的表达、纯化及初步临床应用. 生物化学与生物物理学报. 2001;33:379-385. |
| 9. | Zhao Y, Zhan M. The coexpression of the preS1 (1-42) and the core (1-144) antigen of HBV in E. coli. Chin Med Sci J. 2002;17:68-72. [PubMed] |
| 10. | Shapira MY, Zeira E, Adler R, Shouval D. Rapid seroprotection against hepatitis B following the first dose of a Pre-S1/Pre-S2/S vaccine. J Hepatol. 2001;34:123-127. [PubMed] |
| 11. | Imamura T, Araki M, Miyanohara A, Nakao J, Yonemura H, Ohtomo N, Matsubara K. Expression of hepatitis B virus middle and large surface antigen genes in Saccharomyces cerevisiae. J Virol. 1987;61:3543-3549. [PubMed] |
| 12. | Bruss V, Vieluf K. Functions of the internal pre-S domain of the large surface protein in hepatitis B virus particle morphogenesis. J Virol. 1995;69:6652-6657. [PubMed] |
| 13. | Youn BW, Samanta H. Purification and characterization of pre-S-containing hepatitis B surface antigens produced in recombinant mammalian cell culture. Vaccine. 1989;7:60-68. [PubMed] |
| 14. | Neurath AR, Kent SB, Strick N, Taylor P, Stevens CE. Hepatitis B virus contains pre-S gene-encoded domains. Nature. 1985;315:154-156. [PubMed] |
| 15. | Petit MA, Zoulim F, Capel F, Dubanchet S, Dauguet C, Trepo C. Variable expression of preS1 antigen in serum during chronic hepatitis B virus infection: an accurate marker for the level of hepatitis B virus replication. Hepatology. 1990;11:809-814. [PubMed] |
| 16. | Bock CT, Tillmann HL, Manns MP, Trautwein C. The pre-S region determines the intracellular localization and appearance of hepatitis B virus. Hepatology. 1999;30:517-525. [PubMed] |
| 17. | Le Seyec J, Chouteau P, Cannie I, Guguen-Guillouzo C, Gripon P. Infection process of the hepatitis B virus depends on the presence of a defined sequence in the pre-S1 domain. J Virol. 1999;73:2052-2057. [PubMed] |
| 18. | Petit MA, Strick N, Dubanchet S, Capel F, Neurath AR. Inhibitory activity of monoclonal antibody F35.25 on the interaction between hepatocytes (HepG2 cells) and preS1-specific ligands. Mol Immunol. 1991;28:517-521. [PubMed] |
| 19. | Sominskaya I, Pushko P, Dreilina D, Kozlovskaya T, Pumpen P. Determination of the minimal length of preS1 epitope recognized by a monoclonal antibody which inhibits attachment of hepatitis B virus to hepatocytes. Med Microbiol Immunol. 1992;181:215-226. [PubMed] |
| 20. | Hong HJ, Ryu CJ, Hur H, Kim S, Oh HK, Oh MS, Park SY. In vivo neutralization of hepatitis B virus infection by an anti-preS1 humanized antibody in chimpanzees. Virology. 2004;318:134-141. [PubMed] |
| 21. | Jones CD, Page M, Bacon A, Cahill E, Bentley M, Chatfield SN. T-cell and antibody response characterisation of a new recombinant pre-S1, pre-S2 and SHBs antigen-containing hepatitis B vaccine; demonstration of superior anti-SHBs antibody induction in responder mice. Vaccine. 1999;17:2528-2537. [PubMed] |
| 22. | Young MD, Rosenthal MH, Dickson B, Du W, Maddrey WC. A multi-center controlled study of rapid hepatitis B vaccination using a novel triple antigen recombinant vaccine. Vaccine. 2001;19:3437-3443. [PubMed] |
| 23. | Leroux-Roels G, Desombere I, Cobbaut L, Petit MA, Desmons P, Hauser P, Delem A, De Grave D, Safary A. Hepatitis B vaccine containing surface antigen and selected preS1 and preS2 sequences. 2. Immunogenicity in poor responders to hepatitis B vaccines. Vaccine. 1997;15:1732-1736. [PubMed] |
| 24. | Miyanohara A, Toh-e A, Nozaki C, Hamada F, Ohtomo N, Matsubara K. Expression of hepatitis B surface antigen gene in yeast. Proc Natl Acad Sci U S A. 1983;80:1-5. [PubMed] |
| 25. | Kuroda S, Itoh Y, Miyazaki T, Otaka-Imai S, Fujisawa Y. Efficient expression of genetically engineered hepatitis B virus surface antigen P31 proteins in yeast. Gene. 1989;78:297-308. [PubMed] |
| 26. | Deml L, Schirmbeck R, Reimann J, Wolf H, Wagner R. Purification and characterization of hepatitis B virus surface antigen particles produced in Drosophila Schneider-2 cells. J Virol Methods. 1999;79:205-217. [PubMed] |
| 27. | Cregg JM, Vedvick TS, Raschke WC. Recent advances in the expression of foreign genes in Pichia pastoris. Biotechnology (N Y). 1993;11:905-910. [PubMed] |
| 28. | Liu RS, Yang KY, Lin J, Lin YW, Zhang ZH, Zhang J, Xia NS. High-yield expression of recombinant SARS coronavirus nucleocapsid protein in methylotrophic yeast Pichia pastoris. World J Gastroenterol. 2004;10:3602-3607. [PubMed] |
| 29. | Yang JY, Jin J, Kong YY, Wei J, Zhang ZC, Li GD, Wang Y, Yuan HY, Li YY. Purification and Characterization of Recombinant Hepatitis B Virus Surface Antigen SS1 Expressed in Pichia pastoris. Sheng Wu Hua Xue Yu Sheng Wu Wu Li Xue Bao (. Shanghai). 2000;32:503-508. [PubMed] |
| 30. | Bo H, Minjian L, Guoqiang H, Zhaoxia L, Zhenyu Z, Lin L. Expression of hepatitis B virus S gene in Pichia pastoris and application of the product for detection of anti-HBs antibody. J Biochem Mol Biol. 2005;38:683-689. [PubMed] |
| 31. | Hussain Z, Ali SS, Husain SA, Raish M, Sharma DR, Kar P. Evaluation of immunogenicity and reactogenicity of recombinant DNA hepatitis B vaccine produced in India. World J Gastroenterol. 2005;11:7165-7168. [PubMed] |
| 32. | Hardy E, Martinez E, Diago D, Diaz R, Gonzalez D, Herrera L. Large-scale production of recombinant hepatitis B surface antigen from Pichia pastoris. J Biotechnol. 2000;77:157-167. [PubMed] |