修回日期: 2007-03-21
接受日期: 2007-03-31
在线出版日期: 2007-06-28
目的: 探讨不同浓度三氧化二砷(As2O3)对人肝癌细胞株BEL-7402生长及凋亡的影响及机制.
方法: 应用化学缺氧剂二氯化钴(CoCl2)诱导人肝癌细胞BEL-7402缺氧. 不同浓度As2O3对BEL-7402进行干预后, 应用MTT法测定缺氧条件下的生长抑制作用; 应用电镜, 激光共聚焦显微镜及流式细胞术观察其对细胞凋亡的影响; 应用逆转录聚合酶链式反应检测缺氧诱导因子HIF-1α, 耐药基因mdr1的表达水平.
结果: As2O3具有抑制人肝癌细胞株BEL-7402缺氧条件下生长的作用, 并呈剂量-效应依赖性; 4.0 μmol/L As2O3干预48 h后, 缺氧条件下的细胞呈现典型的凋亡形态学特征; 缺氧时, 0.5-4.0 μmol/L As2O3下调HIF-1a, mdr1基因表达水平, 其中4.0 μmol/L As2O3组作用最强, 基因相对表达量分别为HIF-1a 0.60±0.07, mdr1 0.59±0.09, 各剂量组As2O3作用后与缺氧对照组比较差异有显著性(P<0.01).
结论: 不同浓度的As2O3在由CoCl2诱导的化学缺氧条件下能够抑制人肝癌细胞BEL-7402的生长及诱导凋亡, 其机制可能与As2O3下调HIF-1a, mdr1的基因表达水平有关.
引文著录: 刘晓川, 刘铁夫. 缺氧时三氧化二砷对人肝癌细胞株BEL-7402生长及凋亡的影响及机制. 世界华人消化杂志 2007; 15(18): 1983-1988
Revised: March 21, 2007
Accepted: March 31, 2007
Published online: June 28, 2007
AIM: To investigate the effects of arsenic trioxide (As2O3) on apoptosis and migration of the human liver cancer cell BEL-7402 under normal and hypoxic conditions.
METHODS: A hypoxic environment was induced by CoCl2. The effect of As2O3 was determined by MTT assay. Electron microscopy, laser scanning confocal microscopy and flow cytometry (FCM) were used to study apoptosis of the human liver cancer cell BEL-7402. Expression of the multidrug resistance 1 (mdr1) and Hypoxia-inducible-factor-1α (HIF-1α) genes was detected by reverse transcriptase-polymerase chain reaction.
RESULTS: Different concentrations of As2O3 can inhibit growth and induce apoptosis of the human liver cancer cell BEL-7402 during hypoxia. After being induced by 4.0 μmol/L As2O3 for 48 h in hypoxia, the BEL-7402 cell had morphological features of apoptosis as observed by electron and laser scanning confocal microscopies. Concentrations of 0.5-4.0 μmol/L As2O3 down-regulated the mRNA expression of HIF-1a and mdr1 under hypoxic conditions, with the strongest effect being from 4.0 μmol/L. The mRNA contents of HIF-1a and mdr1 treated with 4.0 μmol/L As2O3 for 48 h under hypoxic conditions were 0.60 ± 0.07 and 0.59 ± 0.09, respectively. This was significantly different compared with the hypoxia control group (P < 0.01).
CONCLUSION: As2O3 inhibited growth and induced apoptosis in the human liver cancer cell line BEL-7402 during hypoxia. The mechanism probably was related to the inhibition of the expressions of HIF-1a and mdr1.
- Citation: Liu XC, Liu TF. Effects and mechanism of arsenic trioxide on growth and apoptosis of the human liver cancer cell line BEL-7402 during hypoxia. Shijie Huaren Xiaohua Zazhi 2007; 15(18): 1983-1988
- URL: https://www.wjgnet.com/1009-3079/full/v15/i18/1983.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i18.1983
三氧化二砷(As2O3)近年来在抗肿瘤治疗方面取得了肯定的疗效, 其主要机制为诱导肿瘤细胞凋亡. 许多研究证实其对多种消化系肿瘤细胞的生长有抑制作用. 而实体肿瘤大多存在内部缺氧的报道也被很多研究所证实. 究竟As2O3在缺氧微环境下对实体肿瘤的生长有无抑制作用还鲜有报道. 本实验将就As2O3在缺氧时对人肝癌细胞的生长抑制、诱导凋亡及作用机制方面作进一步研究.
人肝癌细胞株BEL-7402由哈尔滨医科大学附属一院刘连新教授惠赠. RPMI1640培养基购自Gibco公司, As2O3, CoCl2, MTT购自美国Sigma公司. Annexin V-FITC试剂盒购自深圳晶美生物. TRIzol及ThermoScript RT-PCR试剂盒购自美国Invitrogen公司.
1.2.1 细胞培养: 肝癌细胞BEL-7402于含100 mL/L胎牛血清及100 kU/L双抗的RPMI1640培养液中培养. 化学缺氧剂CoCl2加入培养液的终浓度为150 μmol/L[1], 用于模拟肿瘤内缺氧微环境.
1.2.2 MTT法测定常氧及缺氧条件下As2O3对细胞增殖活性的影响: 实验分常氧组及缺氧组; 将处于对数生长期的细胞以5×107个/L浓度接种于96孔板中, 每孔200 μL, 在0.5-32 μmol/L的As2O3作用下培养48 h, 每个药物浓度设3个复孔, 培养终点前4 h每孔加入MTT(5 g/L) 20 μL, 继续培养4 h, 吸出培养液, 每孔加入150 μL二甲基亚枫, 震荡10 min酶标仪波长570 nm处测吸光值(A值). 实验重复3次, 计算细胞增殖抑制率, 以As2O3浓度对数为横轴, 细胞存活率为纵轴做图, 并用作图法求出As2O3半数抑制浓度(IC50).
1.2.3 透射电镜观察细胞凋亡形态学变化: 取对数生长期细胞接种于培养瓶中, 细胞贴壁后更换为缺氧培养基并加入4.0 μmol/L As2O3培养48 h后消化、离心, PBS洗涤, 2000 r/min离心10 min, 弃上清, 0.3 g/L戊二醛固定, 送电镜室.
1.2.4 激光共聚焦显微镜观察细胞凋亡改变: 取对数生长期细胞接种于6孔板行细胞爬片, 细胞贴壁后更换为缺氧培养基并加入4.0 μmol/L As2O3培养48 h. PBS洗涤, 按试剂盒说明, 行Annexin-V染色, 激光共聚焦显微镜下观察结果.
1.2.5 流式细胞术检测细胞凋亡率: 实验分为常氧对照组、常氧As2O3(4.0 μmol/L)组、缺氧对照组、缺氧As2O3作用组. 各组细胞分别处理48 h后, 2.5 g/L胰酶消化, 离心收集1×106个细胞, 4℃ PBS洗2次后重悬, 按试剂盒说明, 进行Annexin-V染色, 上流式细胞仪收集10 000个活细胞检测细胞凋亡率, 凋亡率(%) = (Annexin-V+ PI+细胞数+Annexin-V+ PI-细胞数)/10 000×100%. 其中Annexin-V+ PI+细胞为晚期凋亡细胞, Annexin-V+ PI-细胞数为早期凋亡细胞, 实验重复3次.
1.2.6 RT-PCR半定量法检测HIF-1α及mdr1 mRNA含量: 实验分为常氧对照组、缺氧48 h对照组、不同浓度As2O3缺氧条件下处理组. (1)TRIzol法提取细胞内总RNA: 按试剂操作说明书进行, 电泳检测RNA质量, 测A值; (2)cDNA合成: 在0.2 mL的PCR反应管中加入10 pg-5 μg RNA, dNTPs并加入DEPC处理水和1.0 μL oligo (dT)引物, 总体积为12 μL, 65℃变性5 min; 置于冰上; 加入5×Reaction Buffer 4.0 μL, DTT (0.1 mol) 1.0 μL, RNaseOUTTM 1.0 μL, ThermoScriptTM 1.0 μL, DEPC处理水1.0 μL, 50℃反应60 min; 85℃加热5 min, 停止cDNA合成反应; 加入1 μL RNase H, 37℃反应20 min, cDNA合成完成后, -20℃保存或立即用于PCR实验; (3)PCR法检测HIF-1a和mdr1的mRNA含量: 以逆转录所得cDNA为模板进行PCR扩增, 总体积为25 μL. 反应体系为: 10×PCR Buffer Minus Mg 2.5 μL, 50 mmol/L MgCl2 1.0 μL, 10 μmol/L dNTP Mixture 0.5 μL, 10 μmol/L sense primer 1.0 μL, 10 μmol/L antisense primer 1.0 μL, Taq DNA polymerase 0.2 μL, RT Products 2.0 μL, DEPC处理水16.8 μL; 目的基因HIF-1a的扩增: 95℃ 2 min, 94℃ 1 min, 58℃ 45 s, 72℃ 45 s, 25个循环后74℃延伸10 min; 目的基因mdr1的扩增: 95℃ 2 min, 94℃ 1 min, 55℃ 1 min, 72℃ 45 s, 25个循环后72℃延伸10 min; 内参b-actin的扩增: 95℃ 2 min, 94℃ 1 min, 58℃ 1 min, 74℃ 1 min, 25个循环后74℃延伸10 min; 15 g/L琼脂糖电泳鉴定扩增产物, 凝胶图像扫描分析系统观察条带位置, 灰度, 扫描凝胶得到内参对照b-actin与目的基因的电泳条带光密度, 通过目的基因/b-actin的光密度比值做相对定量分析. 引物序列见表1.
| 扩增基因 | 预期产物 | 引物 | T |
| HIF-1α | 459 | 上游引物 5'-TCAAAGTCGGACAGCCTC-3' | 58℃ |
| 下游引物 5'-CCCTGCAGTAGGGTTTCTGCT-3' | |||
| mdr1 | 501 | 上游引物 5'-AGAGGCTCTATGACCCCACA-3' | 55℃ |
| 下游引物 5'-CCACAATGACTCCATCATCG-3' | |||
| b-actin | 500 | 上游引物 5'-GTGGGGCGCCCCAGGCACCA-3' | 58℃ |
| 下游引物 5'-CTCCTTAATGTCACGCACGATTTC-3' |
统计学处理 数据均用统计软件包SAS11.5分析, 配对组间比较采用t检验, 多组间比较采用方差分析.
不同浓度的As2O3在常氧及缺氧条件下对BEL-7402的生长均有抑制作用, 并呈剂量-效应关系, 常氧组和缺氧组不同浓度As2O3对BEL-7402的生长抑制作用相似(表2), 无统计学差异(P>0.05). 常氧和缺氧组48 h As2O3 IC50值分别为17.56 μmol/L和17.24 μmol/L, 差异无显著性(P>0.05).
| 浓度 (μmol/L) | 常氧组 | 缺氧组 | ||
| A | 抑制率(%) | A | 抑制率(%) | |
| 对照组 | 2.109±0.042 | - | 2.126±0.023 | - |
| 0.5 | 1.949±0.044 | 7.59±0.32b | 1.953±0.092 | 8.14±1.03b |
| 1.0 | 1.814±0.063 | 13.99±0.93b | 1.816±0.049 | 14.47±1.66b |
| 2.0 | 1.628±0.067 | 22.81±1.42b | 1.657±0.065 | 21.85±2.33b |
| 4.0 | 1.443±0.058 | 31.58±2.06b | 1.499±0.046 | 29.49±1.45b |
| 8.0 | 1.290±0.087 | 38.83±1.38b | 1.320±0.048 | 37.91±2.32b |
| 16.0 | 1.132±0.034 | 46.33±1.98b | 1.105±0.042 | 47.93±2.88b |
| 32.0 | 0.548±0.027 | 74.02±2.02b | 0.516±0.081 | 75.70±1.64b |
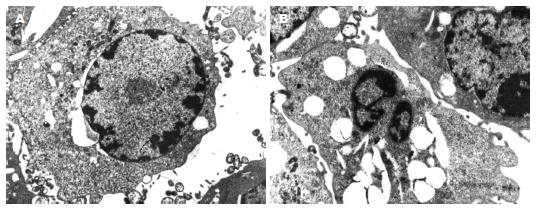
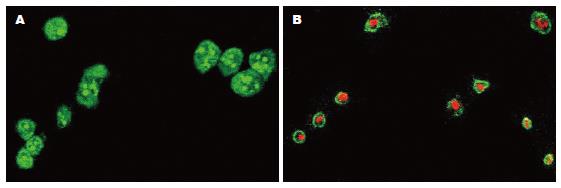
(1)透射电镜观察细胞凋亡形态学改变, 未加药组细胞48 h电镜像显示胞膜完整, 表面微绒毛丰富, 细胞器结构正常, 核仁较大, 染色质均匀, 常染色质丰富. 经As2O3作用48 h后呈现典型凋亡改变, 可见染色质边聚于核膜下, 细胞表面伸出空泡样的质膜突起, 游离核糖体解聚, 凋亡小体形成; 细胞核固缩, 细胞表面微绒毛减少, 甚至消失(图1); (2)激光共聚焦显微镜Annexin-V染色结果: 凋亡早期细胞仅细胞膜被染成绿色, 中期以后胞膜胞质均为绿色, 凋亡小体形成, 绿红双染为凋亡晚期细胞, 红色单染为死亡细胞(图2); (3)流式细胞术AnnexinV标记染色结果: 150 μmol/L CoCl2诱导的缺氧48 h细胞与正常细胞对照相比, 无明显凋亡出现, 差异无显著性. 常氧和缺氧条件下相同浓度As2O3 (4.0 μmol/L)作用48 h后, 常氧组早期凋亡率为18.46%±4.69%, 晚期凋亡率为4.86%±2.24%, 总凋亡率为23.33%±3.10%; 缺氧组早期凋亡率为14.56%±2.82%, 晚期凋亡率为8.52%±4.29%, 总凋亡率为22.74%±3.01%, 两组间总凋亡率比较, P>0.05, 差异无统计学意义.
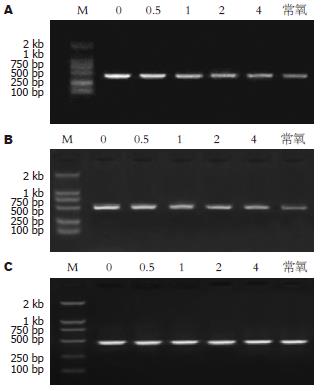
常氧组HIF-1α, mdr1 mRNA基因表达均为较低水平, 缺氧诱导48 h后, 两种基因表达水平与常氧组比较都有显著升高, 两组之间比较有统计学意义(HIF-1α: t = 17.457, P<0.01) (mdr1: t = 12.742, P<0.01); 缺氧条件下应用不同浓度As2O3作用48 h后HIF-1α及mdr1基因表达水平与缺氧48 h对照组相比有明显下降, 有统计学意义(P<0.01, 图3, 表3).
近年的研究表明, 实质性肿瘤发生过程中, 血管生长的相对滞后和肿瘤细胞的快速增殖导致肿瘤细胞缺氧[2]. 缺氧介导肿瘤细胞的恶性筛选, 导致缺氧肿瘤细胞对放、化疗耐受性的增加[3]. 缺氧还可以使肿瘤细胞内参与解毒和药物代谢的酶类表达增加, 从而使进入细胞内的化疗药物迅速被代谢而丧失效应[4-5]. Tan et al[6]研究发现, CoCl2诱导的体外缺氧可以减缓SW480细胞的生长速度, 并降低SW480细胞对氟尿嘧啶的敏感性, 其机制可能与HIF-1α及HO-1的表达上调有关. 而本实验研究结果显示, As2O3对由CoCl2诱导的化学缺氧条件下的人肝癌细胞株BEL-7402仍具有良好的生长抑制这用, 同常氧组比较差异无显著性. 缺氧组应用小剂量As2O3处理后, 电镜下观察人肝癌细胞株BEL-7402出现典型凋亡形态学改变; 流式细胞术AnnexinV-FIFC染色提示, As2O3在缺氧时仍能发挥较好的诱导肿瘤细胞凋亡的作用, 与常氧组比较作用相近. 因此, 同传统的化疗药物相比, As2O3缺氧时可能发挥更好的抗肿瘤作用.
那么, As2O3在缺氧时是通过何种机制发挥其抑制肿瘤细胞生长及诱导凋亡作用的? 宗建春 et al[7]报道在缺氧时, As2O3明显抑制乳腺癌细胞株MDA-MB-435S VEGF mRNA及VEGF蛋白的表达, 且随As2O3浓度的增加其抑制作用更明显. VEGF mRNA的表达下降提示As2O3的作用靶点发生在VEGF的上游调控因子. Hideo et al[8]认为VEGF增强子区域存在数个转录因子结合位点, 如AP-1, AP-2, SP-1和缺氧诱导因子-1 (HIF-1). 常氧条件下VEGF的表达主要由SP-1蛋白调节, 在缺氧条件下, 肿瘤细胞内AP-1, AP-2, SP-1蛋白水平相对常氧增高并不明显, 而HIF-1 获得大量表达, 说明缺氧时肿瘤细胞内VEGF大量表达主要是由HIF-1调控[9]. 因此, 我们推测, As2O3在缺氧时可能通过抑制HIF-1表达发挥其抗肿瘤作用.
缺氧诱导因子HIF-1最先由Semenza et al[11]在研究缺氧诱导的基因表达时发现. 他是缺氧反应中的中心调控因子, 缺氧时与缺氧反应基因的缺氧反应元件(HRE)上的HIF-1结合位点[12]结合, 促进缺氧反应基因的转录, 引起细胞对缺氧的一系列适应性反应. 目前已发现有60多个基因受其调[13]. HIF-1由α和b两个亚基组成, 其中α亚基是主要的功能亚基, 对HIF-1的转录活性起关键作用. 大量研究资料表明, HIF-1α在缺氧条件下对肿瘤细胞凋亡具有明显的影响. 应用RNA干扰技术高效特异性地抑制人血管内皮细胞上HIF-1的表达后, 在缺氧/复氧条件下培养发现, 使用RNA干扰的人血管内皮细胞凋亡明显比未用RNA干扰的多, 说明HIF-1有抗细胞凋亡的作用[10]. Piret et al[14]也发现缺氧或CoCl2可以诱导HIF-1α的表达, 进而抑制肝癌细胞凋亡. Zaman et al[15]的实验结果则为HIF-1抗细胞凋亡的作用提供了直接证据, 他们证明铁离子螯合剂能阻止氧化压力诱导的凋亡. Erler et al[17]发现在结肠癌细胞, 肝癌细胞中, 缺氧条件下促凋亡分子Bid呈HIF-1依赖性下调, 从而成为细胞存活的原因.
HIF-1可诱导MDR1/P-gp的表达增加[18].mdr1基因表达产物P-gp除从细胞内逆浓度梯度排出一系列的疏水性抗癌药物, 降低细胞内药物浓度, 无法构成对肿瘤细胞的有效杀伤而引起耐药外, 还通过抑制Caspase-3和Caspase-8的激活而抑制依赖Caspases激活途径的细胞凋亡[16,19]. Wei et al[20]采用0.5-5 μmol/L As2O3对阿霉素耐药的慢性粒细胞白血病K562/ADM细胞分别作用48和96 h, 证实As2O3逆转其耐药性与抑制P-gp功能有关. 张亚莉 et al[21]研究发现, As2O3降低mdr1和Survivin基因表达, 进而解除P-gp和Survivin对Caspases的抑制效应而促进细胞凋亡.
本实验结果提示, 化学缺氧48 h对照组与常氧对照组相比, HIF-1α和mdr1基因表达水平有明显增加, 具有统计学意义. 说明缺氧可以诱导HIF-1α和mdr1基因水平表达. 应用小剂量As2O3后(0.5-4.0 mmol/L), HIF-1α和mdr1的基因表达水平明显下调, 且在一定范围内随As2O3剂量的增加下调更加明显, 与缺氧对照组相比具有统计学意义, 这可能是As2O3在缺氧时仍能发挥其对人肝癌细胞株BEL-7402的生长抑制和诱导细胞凋亡的机制之一. HIF-1也是导致肿瘤细胞对化疗药物耐受的重要因素, 降低化疗药物对肿瘤细胞的杀伤作用; 缺氧时HIF-1可启动mdr1基因的转录; 本实验结果中, As2O3对由缺氧诱导的HIF-1α和mdr1基因表达水平的下调, 提示我们小剂量As2O3具有不易产生肿瘤治疗中常出现的多药耐药性的优点. 因此在临床治疗过程中, 可考虑将小剂量As2O3与常规化疗药物联合应用, 提高实质肿瘤细胞在缺氧微环境下对化疗药物的敏感性, 发挥化疗药物的最佳作用.
我国是世界上原发性肝癌发病率最高的国家之一. 原发性肝癌的大多数病例在确诊时已失去手术根治机会, 诊断时不能切除的病例占80%以上. 缺氧作为恶性实体瘤的特征之一, 不仅改变了肿瘤细胞的生物学特性, 导致肿瘤细胞的遗传不稳定性及恶性选择, 而且也是肿瘤对放、化疗产生抗性的主要原因.
实体肿瘤的缺氧, 已经成为影响肿瘤化疗敏感性的关键问题, HIF-1则是肿瘤缺氧过程中的关键影响因子, 并成为目前攻克肿瘤治疗的重要分子靶点. 国内外研究目前主要集中于研究HIF-1的调控、小分子siRNA的基因治疗和HIF-1抑制剂的研发. 但HIF-1的抑制剂多具有较大毒性作用, 使其临床应用受到限制.
为了进一步探讨As2O3抗实体瘤的作用机制, 本实验设计应用化学诱导缺氧的条件下应用As2O3对肝癌细胞株进行干预, 观察其对肝癌细胞生长及凋亡的影响, 检测与缺氧及肿瘤化疗敏感性相关的分子指标, 发掘其于传统抗肿瘤药物相比的优势, 完善As2O3抗肝癌治疗的作用机制, 为临床联合应用药物提供科学的理论基础. 此方面问题国内外尚未见报道.
本实验结果中,As2O3对由缺氧诱导的HIF-1α和mdr1基因表达水平的下调, 提示我们小剂量As2O3具有不易产生肿瘤治疗中常出现的多药耐药性的优点. 因此在临床治疗过程中, 可考虑将小剂量As2O3与常规化疗药物联合应用, 提高实质肿瘤细胞在缺氧微环境下对化疗药物的敏感性, 发挥化疗药物的最佳作用.
本文研究了缺氧时三氧化二砷对肝癌细胞株BEL-7402生长及凋亡的影响, 对癌细胞在缺氧情况下, 药物的耐药性及内科治疗的敏感性都有临床指导意义. 同时, 对其中的机制也做了初步研究, 具有先进性, 值得参考
编辑: 王晓瑜 电编:张敏
| 1. | Wu Q, Yang SH, Ye SN, Wang RY. Therapeutic effects of RNA interference targeting HIF-1 alpha gene on human osteosarcoma. Zhonghua Yi Xue Za Zhi. 2005;85:409-413. [PubMed] |
| 2. | Dachs GU, Tozer GM. Hypoxia modulated gene expression: angiogenesis, metastasis and therapeutic exploitation. Eur J Cancer. 2000;36:1649-1660. [PubMed] |
| 3. | Iida T, Mine S, Fujimoto H, Suzuki K, Minami Y, Tanaka Y. Hypoxia-inducible factor-1alpha induces cell cycle arrest of endothelial cells. Genes Cells. 2002;7:143-149. [PubMed] |
| 4. | Frederiksen LJ, Siemens DR, Heaton JP, Maxwell LR, Adams MA, Graham CH. Hypoxia induced resistance to doxorubicin in prostate cancer cells is inhibited by low concentrations of glyceryl trinitrate. J Urol. 2003;170:1003-1007. [PubMed] |
| 5. | Shannon AM, Bouchier-Hayes DJ, Condron CM, Toomey D. Tumour hypoxia, chemotherapeutic resistance and hypoxia-related therapies. Cancer Treat Rev. 2003;29:297-307. [PubMed] |
| 6. | Tan ZM, Wu Y, Zhang HL, Xiao XZ. CoCl2-induced chemotherapy resistance in SW480 cells and its mechanism. Zhong Nan Da Xue Xue Bao Yi Xue Ban. 2006;31:345-349. [PubMed] |
| 8. | Hideo Kimura, Alessandro Weisz, Yukiko Kurashima, Kouichi Hashimoto, Tsutomu Ogura, Fulvio D'Acquisto, Raffaelo Addeo, Masatoshi Makuuchi, and Hiroyasu Esumi. Hypoxia response element of the human vascular endothelial growth factor gene mediates transcriptional regulation by nitric 1oxide : control of hypoxia-inducible factor-1 activity by nitric oxide. Blood. 2000;95:189-197. |
| 9. | Berra E, Pages G, Pouyssegur J. MAP kinases and hypoxia in the control of VEGF expression. Cancer Metastasis Rev. 2000;19:139-145. [PubMed] |
| 10. | Yu EZ, Li YY, Liu XH, Kagan E, McCarron RM. Antiapoptotic action of hypoxia-inducible factor-1 alpha in human endothelial cells. Lab Invest. 2004;84:553-561. [PubMed] |
| 11. | Semenza GL, Wang GL. A nuclear factor induced by hypoxia via de novo protein synthesis binds to the human erythropoietin gene enhancer at a site required for transcriptional activation. Mol Cell Biol. 1992;12:5447-5454. [PubMed] |
| 12. | Aebersold DM, Burri P, Beer KT, Laissue J, Djonov V, Greiner RH, Semenza GL. Expression of hypoxia-inducible factor-1alpha: a novel predictive and prognostic parameter in the radiotherapy of oropharyngeal cancer. Cancer Res. 2001;61:2911-2916. [PubMed] |
| 13. | Ravi R, Mookerjee B, Bhujwalla ZM, Sutter CH, Artemov D, Zeng Q, Dillehay LE, Madan A, Semenza GL, Bedi A. Regulation of tumor angiogenesis by p53-induced degradation of hypoxia-inducible factor 1alpha. Genes Dev. 2000;14:34-44. [PubMed] |
| 14. | Piret JP, Mottet D, Raes M, Michiels C. CoCl2, a chemical inducer of hypoxia-inducible factor-1, and hypoxia reduce apoptotic cell death in hepatoma cell line HepG2. Ann N Y Acad Sci. 2002;973:443-447. [PubMed] |
| 15. | Zaman K, Ryu H, Hall D, O'Donovan K, Lin KI, Miller MP, Marquis JC, Baraban JM, Semenza GL, Ratan RR. Protection from oxidative stress-induced apoptosis in cortical neuronal cultures by iron chelators is associated with enhanced DNA binding of hypoxia-inducible factor-1 and ATF-1/CREB and increased expression of glycolytic enzymes, p21(waf1/cip1), and erythropoietin. J Neurosci. 1999;19:9821-9830. [PubMed] |
| 16. | Ruefli AA, Smyth MJ, Johnstone RW. HMBA induces activation of a caspase-independent cell death pathway to overcome P-glycoprotein-mediated multidrug resistance. Blood. 2000;95:2378-2385. [PubMed] |
| 17. | Erler JT, Cawthorne CJ, Williams KJ, Koritzinsky M, Wouters BG, Wilson C, Miller C, Demonacos C, Stratford IJ, Dive C. Hypoxia-mediated down-regulation of Bid and Bax in tumors occurs via hypoxia-inducible factor 1-dependent and -independent mechanisms and contributes to drug resistance. Mol Cell Biol. 2004;24:2875-2889. [PubMed] |
| 18. | Comerford KM, Wallace TJ, Karhausen J, Louis NA, Montalto MC, Colgan SP. Hypoxia-inducible factor-1-dependent regulation of the multidrug resistance (MDR1) gene. Cancer Res. 2002;62:3387-3394. [PubMed] |
| 19. | Johnstone RW, Cretney E, Smyth MJ. P-glycoprotein protects leukemia cells against caspase-dependent, but not caspase-independent, cell death. Blood. 1999;93:1075-1085. [PubMed] |
| 20. | Wei HL, Yao XJ, Li YN, Wang P, Zhao HS, Bai DC, Peng X, Ma LF. Arsenic trioxide inhibits P-glycoprotein expression in multidrug-resistant human leukemia K562/ADM cell line that overexpresses mdr-1 gene and enhances their chemotherapeutic sensitivity. Zhonghua Xue Ye Xue Za Zhi. 2003;24:28-31. [PubMed] |