修回日期: 2007-03-01
接受日期: 2007-03-17
在线出版日期: 2007-06-18
目的: 探讨树突状细胞(dendritic cells, DCs)浸润对胃癌生物学行为的影响, 并探讨DCs浸润程度与肿瘤血管生成的相关性.
方法: 采用免疫组织化学染色SP法检测胃原发癌35例及其中淋巴转移癌23例组织中S-100+DCs的密度, 同法检测35例胃原发癌血管内皮生长因子(VEGF)的表达及CD34标记的微血管密度(MVD).
结果: 随着胃癌浸润程度的增加, 间质S-100+DCs密度的下降, 浆膜浸润的胃癌S-100+DCs密度显著下降, S-100+DCs与肿瘤浸润深度呈显著负相关(P = 0.023); 有淋巴转移胃癌S-100+DCs密度明显低于无淋巴转移者, 但无统计学意义; 在胃癌转移的淋巴结, 随着胃癌转移程度的增加, S-100+DCs密度显著下降, 两者呈显著负相关(r = -0.923, P<0.01); VEGF阳性表达的胃癌S-100+DCs密度明显低于VEGF阴性表达的胃癌(P = 0.157), 两者呈负相关(r = -0.128, P = 0.464), 但均无统计学意义; S-100+DCs低密度胃癌的MVD显著高于S-100+DCs高密度胃癌(P = 0.013); 高MVD胃癌S-100+DCs密度明显低于低MVD胃癌, 胃癌MVD与S-100+DCs密度呈显著负相关(r = -0.322, P = 0.059).
结论: 胃癌组织的S-100+DCs浸润程度与胃癌侵袭和淋巴转移密切相关; 胃癌DCs浸润程度与肿瘤血管生成的活力密切相关, 胃癌细胞释放的VEGF等促血管生成因子可能是肿瘤源性免疫逃逸的重要分子机制之一.
引文著录: 周业江, 梁建群, 綦晓龙, 熊玉霞, 易国平, 李显蓉, 魏仁智. 胃癌树突状细胞浸润的临床意义及与肿瘤血管生成的相关性. 世界华人消化杂志 2007; 15(17): 1914-1920
Revised: March 1, 2007
Accepted: March 17, 2007
Published online: June 18, 2007
AIM: To investigate the potential role of infiltrating dendritic cells (DCs) in the biological behavior of gastric cancer and any association with tumor angiogenesis.
METHODS: Immunohistological identification of DCs in gastric cancer using monoclonal antibody recognizing S-100 protein was undertaken in 35 primary gastric cancers (PGC) and 23 lymphoid metastatic gastric cancers (LMGC). Antibodies recognizing vascular endothelial growth factor (VEGF) and CD34 were employed to detect VEGF expression and microvascular density (MVD), respectively.
RESULTS: The density of S-100+DCs was obviously decreased along with progressive cancer invasion of the gastric wall; a statistically significant decrease was seen in gastric cancer with serosal invasion (P = 0.04). Further, a statistically negative correlation between the density of S-100+DCs and the degree of invasion was shown in gastric cancer (P = 0.023). The density of S-100+DCs in PGC with lymphatic metastasis was clearly lower than that in PGC with no lymphatic metastasis, though this difference was not statistically significant. However, the density of S-100+DCs in lymph nodes with carcinomatosis showed a marked decrease corresponding to the increase in the percentage of metastasis; a significantly negative correlation was shown between them (r = -0.923, P < 0.01). The density of S-100+DCs in VEGF-positive PGC was lower than that in VEGF-negative PGC (P = 0.157). There was a negative association of the density of S-100+DCs with VEGF expression in PGC, but it was not statistically significant (r = -0.128, P = 0.464). MVD in PGC with lower infiltration of S-100+DCs was significantly higher than that in PGC with higher infiltration (P = 0.013). Similarly, the density of S-100+DCs in PGC with higher MVD was also lower than that in PGC with lower MVD, thus showing a significantly negative association of the density of S-100+DCs with MVD (r = -0.322, P = 0.059).
CONCLUSION: Biological behaviors of gastric cancer cells such as invasive growth and lymphatic metastasis were closely associated with the level of infiltrating S-100+DCs. The infiltration of DCs might be affected by the ability of cancer cell-induced angiogenesis. Thus, pro-angiogenic factors such as VEGF released from tumor cells might be one of the molecular mechanisms of tumor orientated immune escape in gastric cancer.
- Citation: Zhou YJ, Liang JQ, Qi XL, Xiong YX, Yi GP, Li XR, Wei RZ. Infiltrating dendritic cells in the development of gastric cancer and an association with tumor angiogenesis. Shijie Huaren Xiaohua Zazhi 2007; 15(17): 1914-1920
- URL: https://www.wjgnet.com/1009-3079/full/v15/i17/1914.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i17.1914
树突状细胞(dendritic cells, DCs)是目前发现的功能最强、广泛分布于皮肤、消化道、呼吸道黏膜等机体防御第一线的专职抗原呈递细胞(antigen presenting cell, APC). DCs是肿瘤组织中主要的、也是最有效的抗原提呈细胞, 近年来已逐渐认识到DCs在机体抗肿瘤免疫中处于中心地位, 主要通过提呈肿瘤抗原介导特异性T细胞免疫应答而对肿瘤细胞产生抑制作用, 具有免疫监视的功能[1-2]. 目前, 有关DCs浸润与胃癌生物学行为, 以及与胃癌血管生成的相互关系仍不清楚. 我们旨在探讨组织DCs浸润与胃癌侵袭及淋巴转移程度的相互关系, 以及与VEGF表达和MVD的关系, 初步探讨胃癌DCs局部浸润的生物学意义及其影响因素.
35例胃癌和其中23例淋巴转移组织标本均来自1996-2000年在我院普外科手术治疗的患者. 35例胃癌中, 男28例、女7例; 年龄31-66(平均45)岁; 早期胃癌4例(均为原位癌)、进展期胃癌31例; 肿瘤浸及浆膜者16例, 伴有淋巴转移者23例, 参照国际抗癌联盟(UICC)的TNM分期标准, Ⅰ期10例、Ⅱ期18例、Ⅲ期15例、Ⅳ期2例. 所有胃癌患者均接受了根治性或姑息手术切除, 但术前均未接受化疗、放疗及生物治疗. 鼠抗CD34、S-100蛋白mAb、兔抗VEGF多克隆抗体, Ultrasensitive S-P Kit及DAB Kit均购自福州迈新生物技术开发公司的即用型产品.
1.2.1 免疫组化染色: 经40 g/L甲醛固定、石腊包埋的胃炎、胃癌及淋巴转移癌组织标本, 5 μm连续切片; 应用免疫组化染色SP法, 操作按试剂说明进行, 高温高压修复抗原, 用PBS替代一抗作阴性对照, 阳性对照为迈新公司提供的阳性切片.
1.2.2 结果判断: (1)S-100+DCs密度: S-100+DCs细胞在胃原发癌的计数局限于肿瘤及邻近的黏膜和癌周组织, 计数方法: 先在100倍光镜下确定10个密度最高的区域, 然后分别在400倍光镜下计数, 其平均值分别作为S-100+DCs密度; 在淋巴转移癌组织的计数同原发肿瘤, 也以平均值分别作为S-100+DCs密度; (2)VEGF的表达水平: VEGF在胃癌组织的表达水平均采用染色强度评分+阳性细胞面积评分的积分表示. 染色强度分0-3级: 0 = 完全阴性, 与背景一致; 1 = 弱阳性染色信号(±), 淡黄色略高于背景; 2 = 阳性染色(+)黄色, 明显高于背景; 3 = 强阳性染色信号(++)呈棕褐色. 阳性细胞面积也分4级: 0 = 阳性细胞面积<10%, 1 = 阳性细胞面积为10%-25%, 2 = 阳性细胞面积为25%-50%, 3 = 阳性细胞面积≥50%. 两者表达定性以积分0-2为阴性, 积分≥3为阳性表达; (3) MVD计数标准与方法: 微血管记数标准参照Weidner et al[3]介绍的方法, 即: 对任何相互独立的、直径8个红细胞直径的微血管、单个内皮细胞或细胞簇均视为一个微血管计数. MVD的确定参照我们先前报道的方法[4], 即: 先在低倍镜(×100)下扫视整个切片, 寻找出4个高血管密度区(热区), 再在高倍镜(×200)下计数, 其平均值作为MVD; (4)淋巴结内胃癌转移程度的确定: 以转移癌组织占据淋巴结的面积为依据分为4级: Ⅰ = 转移癌面积<10%; Ⅱ = 转移癌面积10%-25%; Ⅲ = 转移癌面积25%-50%; Ⅳ = 转移癌面积≥50%.
统计学处理 计量资料以mean±SD表示, 根据适用条件, 组间差异比较采用One-way ANOVA或非参数检验及Pearson相关性分析; 应用统计软件SPSS13.0处理, 以P<0.05为有显著性意义.
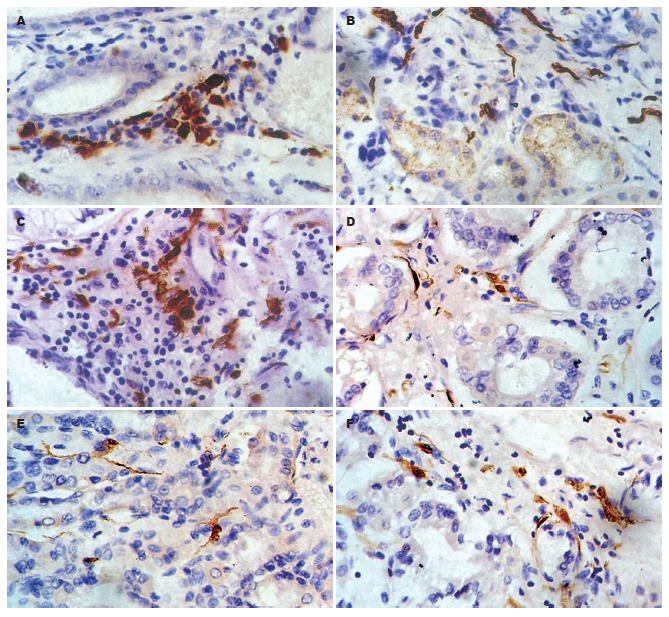
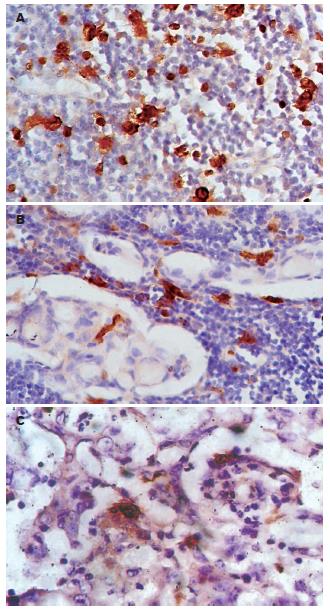
S-100+DCs在癌组织邻近的黏膜腺体间浸润较少, 偶可见密集浸润, 在黏膜下则呈带状浸润, 形成"防御带"; 在癌周围淋巴组织可见高密度的S-100+DCs聚集; 在胃原发癌组织, S-100+DCs散在分布于肿瘤细胞间, 在某些区域集聚成团(图1). 在淋巴转移癌组织, S-100+DCs主要聚集在转移癌细胞周围的淋巴组织, 癌细胞间浸润的S-100+DCs稀少(图2).
S-100+DC密度随胃癌浸润深度增加而下降, 浆膜浸润者S-100+DC浸润密度显著下降(P = 0.04), S-100+DC密度在≤35岁组、男性组、分化较好组、淋巴结转移组、临床晚期组的胃癌较低, 但均无统计学差异; 相关分析发现S-100+DC密度与胃癌浸润深度(r = -0.34, P = 0.023)及TNM分期(r = -0.306, P = 0.037)均呈明显负相关(表1). 本组中S-100+DCs密度值为0-28.5/HP400, 中位值为6.2/HP400, 以此为标准分为高S-100+DCs胃癌组(17例)及低S-100+DCs胃癌组(18例), 两组胃癌的淋巴转移率分别为55.56%(10/17)和76.47%(13/18), 两者的差异明显, 接近统计学意义(76.47% vs 55.56%, P = 0.096). 在23例胃癌转移的淋巴结中, S-100+DC浸润密度与淋巴结内胃癌转移程度亦有明显关系: 随淋巴结内S-100+DC浸润密度下降, 淋巴结内胃癌转移程度明显增强, 各组间有显著性差异. 相关分析发现淋巴结内胃癌转移程度与结内S-100+DC浸润密度呈显著负相关(r = -0.923, P<0.01, 表2).
| 临床病理指标 | n | S-100+DCs密度(个/HP400) | P | |
| 年龄 | ||||
| ≤35 | 11 | 6.90±7.80 | 0.76 | |
| >35 | 24 | 7.60±5.20 | ||
| 性别 | ||||
| 男 | 28 | 6.78±4.82 | 0.13 | |
| 女 | 7 | 10.70±9.12 | ||
| 癌分化 | ||||
| Ⅰ+Ⅱ | 9 | 5.12±2.69 | 0.20 | |
| Ⅲ | 26 | 8.14±6.71 | ||
| 浸润深度 | ||||
| T1 | 4 | 11.84±1.19 | 0.12 | |
| >T1 | 31 | 6.79±5.10 | ||
| <T3 | 19 | 9.27±7.24 | 0.04 | |
| ≥T3 | 16 | 5.10±3.17 | ||
| 淋巴结 | ||||
| N0 | 12 | 8.51±7.93 | 0.43 | |
| N1+N2 | 23 | 6.76±4.91 | ||
| TNM分期 | ||||
| Ⅰ+Ⅱ | 19 | 8.90±7.55 | 0.10 | |
| Ⅲ+Ⅳ | 16 | 5.54±2.85 |
| 淋巴结内胃癌转移程度分级 | n | S-100+DCs密度(个/HP400) |
| Ⅰ | 6 | 64.17±11.51 |
| Ⅱ | 7 | 34.43±7.39 |
| Ⅲ | 6 | 24.67±7.23 |
| Ⅳ | 4 | 8.75±2.50 |
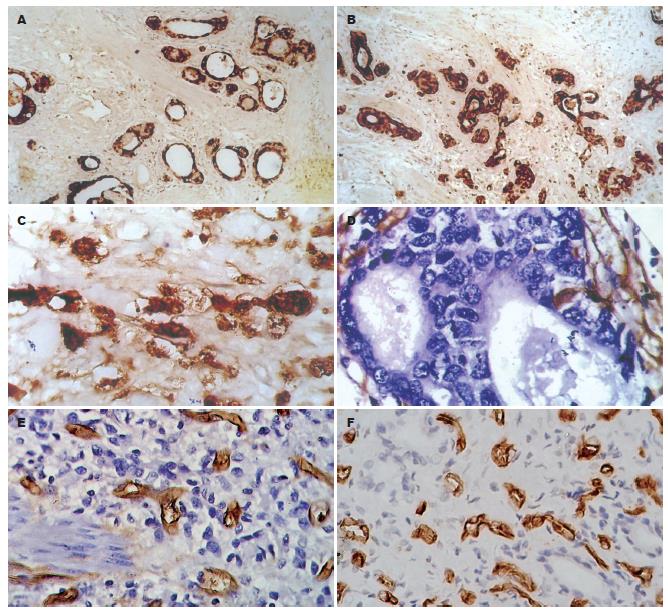
VEGF表达主要位于胃癌细胞, CD34位于肿瘤血管内皮细胞, 显示肿瘤新生血管(图3). 本组胃癌VEGF阳性表达者19例, VEGF阴性16例, VEGF阳性胃癌S-100+DCs密度明显低于VEGF阴性胃癌的S-100+DCs密度, 差异无统计学意义(5.89±2.20 vs 9.11±8.41, P = 0.157), Spearman等级相关性分析显示, S-100+DCs密度与VEGF表达呈负相关(r = -0.128, P = 0.464), 但无统计学意义. 本组胃癌组织MVD为17.5-98条/HP200, 中位值为45条/HP200, 以此为标准, 分为高MVD胃癌组(18例)和低MVD胃癌组(17例), 前者的S-100+DCs密度明显低于后者, 但差异无统计学意义(6.21±6.06 vs 8.59±5.98, P = 0.251); S-100+DCs低密度胃癌(18例)的MVD显著高于S-100+DCs高密度胃癌(17例)的MVD, 两者的差异具有统计学意义(39.82±14.97 vs 56.26±21.12, P = 0.013); Spearman相关分析显示, S-100+DCs密度与胃癌MVD呈显著负相关(r = -0.322, P = 0.059).
本研究显示, 胃癌侵袭深度和TNM分期与S-100+DCs浸润程度有较密切的关系, 在早期胃癌-进展期胃癌的进展过程中, S-100+DCs密度均呈下降趋势, 特别是当浆膜浸润时下降最为明显; 相关分析揭示S-100+DCs密度与浸润深度和TNM分期均呈显著负相关, 提示S-100+DCs浸润程度对胃原发癌的侵袭性生长的能力有一定影响.
黄海力 et al[5]的研究表明, 胃癌淋巴转移与S-100+DCs浸润程度下降显著相关, 本研究亦显示, 有淋巴转移的胃癌S-100+DCs浸润水平下降, 但无统计学意义, 这可能与我们的样本量较少有关. 为进一步探讨S-100+DCs在胃癌淋巴转移中的作用, 我们观察了转移淋巴结中S-100+DCs浸润密度与淋巴结内胃癌转移程度的关系, 结果显示, 淋巴结内胃癌转移程度与S-100+DCs浸润水平密切相关, 两者呈显著负相关. 上述结果从临床和组织学表明, S-100+DCs在抑制原发和淋巴转移性胃癌的侵袭和扩散方面有着重要作用, 其作用机制可能与其直接或间接诱导胃癌细胞凋亡和抑制胃癌细胞的增殖活性有关[5-6], 其作用途径有以下几方面: (1)发挥抗原递呈功能, 激活细胞毒性T淋巴细胞(CTL)及自然杀伤细胞(NK), 通过穿孔素/颗粒酶及Fas/Fas-L途径诱导胃癌细胞凋亡; (2)释放一氧化氮(NO)和/或直接表达肿瘤坏死因子(TNF)家族细胞因子, 如: TNF、Fas-L、TNF凋亡相关配体(TRAIL), 直接引起肿瘤细胞坏死或凋亡[7]. 我们研究发现, 不管是原发癌还是淋巴转移癌, S-100+DCs在癌组织间的分布稀少, 而在癌周组织分布较多, 集簇成团, 呈"防御带"样分布的现象, 提示DCs对肿瘤抗原递呈的水平低下, 有利于肿瘤的免疫逃逸. 据此, 我们有理由推测, S-100+DCs在抑制胃癌侵袭和转移的作用中, 通过抗原递呈、激发免疫杀伤的途径可能并不是主要的, 而更主要的或许是通过其直接的抗瘤机制发挥作用.
影响DCs在肿瘤组织中浸润密度的因素仍不明确, 成为肿瘤局部免疫研究的热点. 近年来的一些基础研究发现, VEGF是肿瘤细胞分泌的一种多功能的细胞因子, 他不但具有强大的诱导肿瘤新生血管的作用, 还可通过与CD34+的DCs前体细胞表达的VEGF受体的相互作用, 影响DCs的成熟[8], 以及抑制人体已成熟DCs的功能[9], 成为肿瘤源性免疫抑制/免疫逃逸的重要机制之一. 目前, 有关人体肿瘤组织中VEGF表达对DCs浸润影响的研究仍较少, Saito et al[10]在日本人胃癌的研究中发现, 胃癌组织中S-100+DCs的浸润密度与VEGF表达水平呈显著负相关. 近年来, 国内的研究者在原发性肝癌[11], 食管癌[12], 非小细胞性肺癌[13]等肿瘤组织的研究中也有类似报道. 本研究结果表明, 胃癌S-100+DCs浸润密度与肿瘤细胞VEGF的表达状态亦有一定关系: VEGF阴性者S-100+DCs密度明显高于VEGF阳性者, 且两者呈负相关, 但无统计学意义, 其原因可能与观察的样本含量偏小有关, 但其趋势与Saito et al的研究结果有一致性, 进一步证实VEGF高表达可影响S-100+DCs在胃癌组织中的浸润, 使局部免疫力下降. 近年研究发现, 除VEGF外, 还有其他促/抑血管因子对肿瘤组织中DCs的分化和功能产生影响[14], 如最近有文献报告胃癌S-100+DCs浸润水平与COX-2表达水平亦有密切关系[15]; 因此, 肿瘤组织局部免疫状态是肿瘤细胞产生的多种细胞因子作用的结果, 对其深入探讨有助于揭示肿瘤免疫逃逸的分子机制.
肿瘤血管生成是肿瘤微环境产生的多种促/抑血管因子共同作用的结果, 在肿瘤生长、侵袭和转移等临床生物学行为中起着不可或缺的作用, 抑制肿瘤血管生成已成为有效的抗肿瘤策略之一. 肿瘤血管形成与DCs浸润之间关系的研究目前尚不多见, 本研究结果显示, 胃癌S-100+DCs低浸润组的MVD显著高于S-100+DCs高浸润组; 与之相似, 高MVD胃癌组的S-100+DCs浸润明显低于低MVD胃癌组; 相关性分析显示胃癌S-100+DCs浸润水平与MVD呈显著负相关, 提示胃癌新生血管生成活性与S-100+DCs浸润程度的关系较之与VEGF表达更为密切, S-100+DCs浸润对胃癌新生血管生成活性可能具有一定的抑制作用. Yoneyama et al[16]最近的研究发现, 应用同种或异基因的内皮细胞裂解物脉冲DCs, 能显著抑制结肠癌小鼠移植瘤的生长和肺部转移的发生, 免疫组化发现移植瘤微血管密度明显下降; 体外研究进一步发现内皮细胞裂解物刺激的DCs能有效地活化细胞毒T淋巴细胞和NK细胞, 这些免疫效应细胞对肿瘤细胞无细胞毒作用, 而对激活的血管内皮细胞具有细胞毒作用, 同时在血清中可检测到抗血管内皮细胞的抗体, 而检测不到抗肿瘤细胞的抗体. 这些结果可较好地解释我们在人体胃癌组织中观察到的现象, 提示树突状细胞尚可通过递呈内皮细胞抗原诱导抗肿瘤血管生成的途径发挥抗肿瘤作用.
胃癌是具有较强侵袭和转移能力的恶性肿瘤, 其临床生物学行为及肿瘤血管生成活性与局部免疫状态是否具有关联性有待研究. 淋巴转移和肿瘤血管生成能力是影响胃癌预后的重要因素, 但其与肿瘤局部树突状细胞浸润的关系尚不清楚.
本研究发现树突状细胞在胃癌的浸润水平与肿瘤侵袭和转移能力呈明显负相关; 且对认识其抗肿瘤作用的途径开辟了新视野: (1)树突状细胞除诱导抗肿瘤免疫应答外, 其直接诱导肿瘤细胞凋亡还可能是抑制胃癌侵袭转移的重要方式; (2)树突状细胞可能通过抗肿瘤血管生成的作用间接抑制胃癌的侵袭和转移潜力.
树突状细胞抗肿瘤的机制尚需进一步认识, 本研究为此进行了初步探索, 对进一步研究和临床应用奠定了基础.
本文探讨了树突状细胞浸润对胃癌生物学行为的影响以及与肿瘤血管生成的相关性, 对于揭示肿瘤免疫逃逸的分子机制有很重要的意义.
编辑: 王晓瑜 电编:张敏
| 1. | Banchereau J, Steinman RM. Dendritic cells and the control of immunity. Nature. 1998;392:245-252. [PubMed] |
| 2. | Gunzer M, Janich S, Varga G, Grabbe S. Dendritic cells and tumor immunity. Semin Immunol. 2001;13:291-302. [PubMed] |
| 3. | Weidner N, Folkman J, Pozza F, Bevilacqua P, Allred EN, Moore DH, Meli S, Gasparini G. Tumor angiogenesis: a new significant and independent prognostic indicator in early-stage breast carcinoma. J Natl Cancer Inst. 1992;84:1875-1887. [PubMed] |
| 4. | 周 业江, 熊 玉霞, 范 伟, 伍 晓汀, 时 德, 周 彤, 黄 雄, 李 月春. 抑癌基因PTEN/MMAC1/TEP1编码蛋白和血管内皮生长因子在胃癌组织表达的相关性及其意义. 中华实验外科杂志. 2004;21:954-956. |
| 6. | Chapoval AI, Tamada K, Chen L. In vitro growth inhibition of a broad spectrum of tumor cell lines by activated human dendritic cells. Blood. 2000;95:2346-2351. [PubMed] |
| 7. | Lu G, Janjic BM, Janjic J, Whiteside TL, Storkus WJ, Vujanovic NL. Innate direct anticancer effector function of human immature dendritic cells. II. Role of TNF, lymphotoxin-alpha(1)beta(2), Fas ligand, and TNF-related apoptosis-inducing ligand. J Immunol. 2002;168:1831-1839. [PubMed] |
| 8. | Takahashi A, Kono K, Ichihara F, Sugai H, Fujii H, Matsumoto Y. Vascular endothelial growth factor inhibits maturation of dendritic cells induced by lipopolysaccharide, but not by proinflammatory cytokines. Cancer Immunol Immunother. 2004;53:543-550. [PubMed] |
| 9. | Mimura K, Kono K, Takahashi A, Kawaguchi Y, Fujii H. Vascular endothelial growth factor inhibits the function of human mature dendritic cells mediated by VEGF receptor-2. Cancer Immunol Immunother. 2007;56:761-770. [PubMed] |
| 10. | Saito H, Tsujitani S, Ikeguchi M, Maeta M, Kaibara N. Relationship between the expression of vascular endothelial growth factor and the density of dendritic cells in gastric adenocarcinoma tissue. Br J Cancer. 1998;78:1573-1577. [PubMed] |
| 12. | Yang WF, Li DT, Li J, Chen XX, Wagn SZ. The effects of vascular endothelial growth factor on dendritic cells in esophageal tumor tissue. Xi Bao Yu Fen Zi Mian Yi Xue Za Zhi. 2007;23:46-47, 55. [PubMed] |
| 13. | Inoshima N, Nakanishi Y, Minami T, Izumi M, Takayama K, Yoshino I, Hara N. The influence of dendritic cell infiltration and vascular endothelial growth factor expression on the prognosis of non-small cell lung cancer. Clin Cancer Res. 2002;8:3480-3486. [PubMed] |
| 14. | Pinzon-Charry A, Maxwell T, Lopez JA. Dendritic cell dysfunction in cancer: a mechanism for immunosuppression. Immunol Cell Biol. 2005;83:451-461. [PubMed] |
| 16. | Yoneyama S, Okaji Y, Tsuno NH, Kawai K, Yamashita H, Tsuchiya T, Yamada J, Sunami E, Osada T, Kitayama J. A study of dendritic and endothelial cell interactions in colon cancer in a cell line and small mammal model. Eur J Surg Oncol. 2007;10:1191-1198. [PubMed] |