修回日期: 2007-03-01
接受日期: 2007-03-17
在线出版日期: 2007-06-18
目的: 探讨重症急性胰腺炎(SAP)时急性肾损伤的发病机制及L-精氨酸(L-arg)对其的保护机制.
方法: SD大鼠60只制成SAP模型并收集腹水(PAAF); 60只制成穿孔性腹膜炎(PP)模型并收集其腹水(PPAF); 另将90只随机分为5组: 空白组(NS组)、对照组(PPAF组)、模型组(PAAF组)及2个处理组(PAAF+L-arg组和PPAF+L-arg组). 观察各组术后12 h的血淀粉酶(Amyl)、尿素氮(BUN)、肌酐(Cr)、血清一氧化氮(NO)及病理学变化, 同时检测其肾细胞的凋亡及诱生型一氧化氮合酶(iNOS)的表达情况.
结果: PAAF+L-arg组和PPAF+L-arg组的Amyl、BUN、Cr均显著低于PAAF组和PPAF组(Amyl: 1925.8±1024.2 vs 3328.3±833.3, 2128.0±795.9 vs 3599.1±1156.9; BUN: 9.1±0.9 vs 12.4±1.0, 8.5±0.8 vs 13.0±1.1; Cr: 62.1±7.5 vs 114.5±8.6, 60.0±6.1 vs 115.8±6.9; P<0.01). 而NO及iNOS表达, 使用L-arg组最强, 依次高于模型组(SAP组及PP组), 实验组(PAAF组及PPAF组), 而NS组表达最弱. 肾细胞的凋亡率SAP组依次高于PAAF组PAAF+L-arg组及NS组; PP组依次高于PPAF组、PPAF+L-arg组及NS组(P<0.01); 与肾脏的病理学改变一致.
结论: PAAF可以诱导健康大鼠的肾细胞凋亡引起肾损伤以建立稳定的PAAF诱导的健康大鼠肾损伤模型, 但该作用可以被小剂量的L-arg阻断.
引文著录: 程若川, 刘其雨, 苏艳军, 张建明, 刁畅, 罗华友. L-精氨酸对胰腺炎相关性腹水诱导的肾细胞凋亡的疗效. 世界华人消化杂志 2007; 15(17): 1893-1898
Revised: March 1, 2007
Accepted: March 17, 2007
Published online: June 18, 2007
AIM: To explore the mechanism of acute renal injury in severe acute pancreatitis (SAP) and the effect of the conservative mechanism of L-arginine.
METHODS: Sixty SAP model rats were established by retrograde injection of 5% sodium taurocholate into the pancreatic duct and then the PAAF collected for reservation. Another 60 rats were established as perforative peritonitis (PP) models, and their perforative peritonitis associated ascitic fluid (PPAF) was collected. Another ninety SD rats were randomly divided into five groups: NS, PAAF, PPAF, PAAF + L-arg and PPAF + L-arg. Serum concentrations of amylase (Amyl), urea nitrogen (BUN), creatinine and nitric oxide were determined at 12 h post-operation. The renal cell apoptosis rate and inducible nitric oxide synthase activity were examined. Histological observation was performed.
RESULTS: The amylase, blood urea nitrogen, and creatinine levels of serum in the PAAF + L-arg and PPAF + L-arg groups were lower than those in the PAAF and PPAF groups (Amyl: 1925.8 ± 1024.2 vs 3328.3 ± 833.3, 2128.0 ± 795.9 vs 3599.1 ± 1156.9; BUN: 9.1 ± 0.9 vs 12.4 ± 1.0, 8.5 ± 0.8 vs 13.0 ± 1.1; Cr: 62.1 ± 7.5 vs 114.5 ± 8.6, 60.0 ± 6.1 vs 115.8 ± 6.9; respectively, P < 0.01). The content of nitric oxide and the inducible nitric oxide synthase activity in the SAP group were higher than that in the PAAF group, while they were lower than those in the PAAF + L-arg group, while the NS group was the lowest. Similarly, the PP group was higher than the PPAF group, but lower than the PPAF + L-arg group, while the NS group was, again, the lowest.
CONCLUSION: Renal cell apoptosis and injury are induced by pancreatitis associated ascitic fluid and blocked by low doses of L-arginine. A stable renal injury model can be established by PAAF.
- Citation: Cheng RC, Liu QY, Su YJ, Zhang JM, Diao C, Luo HY. Curative effects of L-arginine on apoptosis of renal cells induced by pancreatitis associated ascitic fluid. Shijie Huaren Xiaohua Zazhi 2007; 15(17): 1893-1898
- URL: https://www.wjgnet.com/1009-3079/full/v15/i17/1893.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i17.1893
重症急性胰腺炎(SAP)是临床常见急腹症, 常并发多器官功能障碍综合征(MODS)[1]; 其胰外器官损伤中肾功能障碍发生率仅次于肺功能障碍, 大约在14%-43%[2], 且大多同时伴有其他器官系统的损害; 发展至急性肾功能衰竭(ARF)后病死率高达80%, 出现ARF后其他脏器衰竭发生率也明显上升; SAP引起ARF的机制尚未完全阐明. 一般认为有效循环血容量不足、肾血流动力学异常是SAP并发肾损伤的主要原因, 尽管如此, 最近越来越多的资料都表明SAP败血症时的肾衰是由于免疫或毒素的应急引起的急性肾小管凋亡导致的, 而不是简单的血液动力学紊乱引起的[3]. 本实验通过观察L-精氨酸(L-arg)对PAAF诱导的大鼠肾细胞凋亡的影响, 探讨SAP时肾损伤的发病机制及L-arg对其的保护机制.
健康SD大鼠210只, 雌雄不限, 体重(250±25)g(购自昆明医学院动物实验研究中心). 牛磺胆酸钠(购自美国Sigma公司), NO的生成量(试剂盒购自南京建成生物工程研究所), 兔抗大鼠iNOS多克隆抗体、SABC试剂盒和DAB显色试剂盒(购自博士德生物有限公司), PI染色法(试剂购自美国BD公司).
1.2.1 动物分组: 健康SD大鼠210只, 雌雄不限, 体重(250±25) g. 60只制成SAP模型并收集PAAF备用, 随机选取18只作为SAP组; 60只制成PP模型7 h后收集其腹水(PPAF)备用, 随即选取18只作为PP组; 最后90只SD大鼠随机分5组. 空白组(NS组): ip生理盐水(NS)8 mL/只; 穿孔性腹膜炎组(PPAF组): 参照2(2)建立消化道穿孔模型, 7 h后无菌状态下开腹收集腹腔渗出液, 4℃, 2500 r/min离心15 min后取上清液, -80℃保存备用; 实验时ip 8 mL/只. 模型组(PAAF组): 参照2(1)建立SAP模型, 7 h后无菌状态下开腹收集腹腔渗出液(即PAAF), 4℃, 2500 r/min离心15 min后取上清液, -80℃保存备用; 实验时ip 8 mL/只. 精氨酸组(L-arg组): 在模型组(PAAF组及PPAF组)基础上, 注射腹水前10 min经股静脉给予L-arg(100 mg/kg). 即(PAAF+L-arg组及PPAF+L-arg组).
1.2.2 动物模型的制作: (1)大鼠SAP模型的制作: 大鼠术前12 h禁食, 自由饮水; 30 g/L的戊巴比妥钠(30 mg/kg)ip麻醉后, 正中切口入腹, 以无损伤小动脉夹暂时阻断肝门侧胆总管, 以套管针针头(尖端剪断并磨钝)由十二指肠前壁进针, 经乳头部插入胆总管内, 以50 g/L牛磺胆酸钠1 mL/kg匀速注入, 拔针后局部指压穿刺部位防止逆流. 5 min后开放胆总管阻断, 胰腺在短时间内可见出血水肿, 局部坏死, 大鼠SAP诱导成功. (2)大鼠消化道穿孔模型的制作: 大鼠术前12 h禁食, 自由饮水; 30 g/L的戊巴比妥钠(30 mg/kg)ip麻醉后, 作长约1.5 cm上腹正中切口开腹, 横断十二指肠球部无血管区1/2周径, 并将胃窦部下拉悬吊于中腹部腹壁. 以0号丝线结扎各出血点, 无活动性出血后分层关腹. 术后自由饮水, 于术后7 h留取腹水, PP模型建立成功.
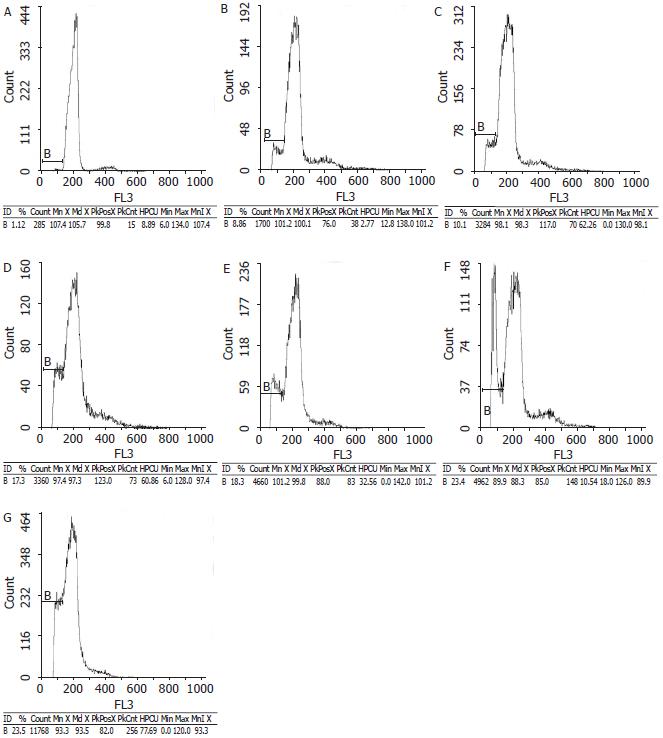
1.2.3 指标的检测: (1)血清学指标: SAP组及PP组于模型成功建立后7 h、其余各组分别于实验设计12 h后, 经腹主动脉采血5 mL, 注入抗凝试管, 离心(4℃, 3000 r/min, 10 min), 取上清置于-20℃冰箱保存待测. NO含量(μmol/L), 采用硝酸还原酶法测定血清NO2-/NO3-含量, 间接反应NO的生成量; 血清BUN、Cr和Amyl水平应用酶偶联测定法在全自动生化分析仪上测定. 采血完毕后, 立即取胰腺左叶及左肾上极组织分别用于以下指标的检测. (2)病理学指标检测: 按照标准步骤将胰腺及肾组织制成石蜡切片并行HE染色, 光镜下观察组织病理学改变. (3)组织中iNOS表达的检测: iNOS抗体的工作浓度为1:200. 按说明书步骤操作; 光镜下观察并照相, 无着色为阴性, 浅黄色为弱阳性, 棕黄色为阳性, 棕褐色为强阳性. (4)细胞凋亡的检测: 采用PI染色法, 按照说明操作, 于流式细胞仪上检测肾细胞的凋亡率.
统计学处理 实验数据以mean±SD表示, 采用t检验; P<0.05为差异显著. 指标间联系的密切程度采用Pearson's相关分析. 所有处理均采用SPSS12.0统计软件包.
SAP组与PP组、PAAF组与PPAF组及PAAF+L-arg组与PPAF+L-arg组比较均无统计学差异. 血清Amyl及血BUN、Cr, SAP组及PP组最高, 其余依次为PPAF组及PAAF组、PPAF+L-arg组及PAAF+L-arg组、NS组; 血清NO, 使用L-arg的两组最高, 依次高于PPAF组及PAAF组、SAP组及PP组, 而NS组反而最低(表1).
| 分组 | Amyl(U/L) | BUN(mmol/L) | Cr(μmol/L) | NO(μmol/L) |
| SAP组 | 6977.6±2687.8ad | 15.1±2.0ad | 137.6±15.2ad | 63.05±8.31ad |
| PP组 | 6969±1502.5af | 15.1±1.8af | 138.2±19.6af | 57.48±6.93af |
| NS组 | 734.3±305.9 | 4.6±0.7 | 33.8±2.7 | 31.76±3.63 |
| PAAF组 | 3328.3±833.3a | 12.4±1.0a | 114.5±8.6a | 71.84±6.56a |
| PPAF组 | 3599.1±1156.9a | 13.0±1.1a | 115.8±6.9a | 67.98±8.00a |
| PAAF+L-arg组 | 1925.8±1024.2ad | 9.1±0.9ad | 62.1±7.5ad | 121.70±12.89ad |
| PPAF+L-arg组 | 2128.0±795.9af | 8.5±0.8af | 60.0±6.1af | 118.56±12.64af |
SAP组及PP组胰腺大片出血坏死, 呈暗红色, 表面及周围腹膜、系膜见皂化斑; 光镜下胰腺大部分坏死, 腺体结构消失, 大量炎性细胞浸润伴出血; PAAF组及PPAF组仅有部分腺体组织水肿, 组织间隙增宽, 少量炎性细胞浸润; PAAF+L-arg组与PPAF+L-arg组胰腺轻度水肿, 偶见炎性细胞浸润.
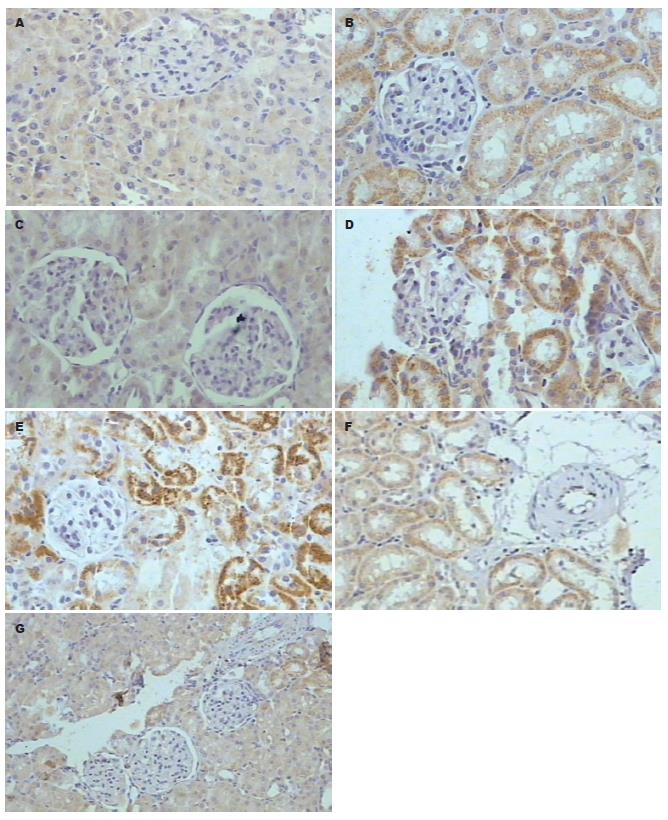
SAP组及PP组病变最严重, 大鼠肾小球体积增大, 肾小管上皮细胞重度水肿, 管腔纹状缘消失, 少数肾小囊内可见红细胞渗出; 髓质内间质血管扩张、出血, 中等量炎细胞浸润; 组织中iNOS均呈阳性染色. PAAF组及PPAF组病变次之, 主要表现为肾小管上皮细胞中度水肿, 髓质内间质血管扩张、淤血, 少量炎细胞浸润; 组织中iNOS亦均为阳性染色. PAAF+L-arg组与PPAF+L-arg组病变较前4组明显变轻, 仅表现为肾小管上皮细胞轻度水肿, 未见炎细胞浸润; 但组织中iNOS为强阳性染色. iNOS染色主要集中在肾小管的上皮细胞胞浆内, 而肾小球并不表达. 正常肾组织iNOS呈弱阳性染色(图1).
正常肾组织存在较低水平的凋亡现象1.32%±0.12%; 而SAP组凋亡最严重, 高达23.8%±4.5%, PP组为22.7%±3.41%; 其次为PAAF组18.3%±2.11%、PPAF组17.3%±2.25%, 但PAAF+L-arg组与PPAF+L-arg组均明显减轻, 分别为8.3%±0.77%、8.1%±0.71%. SAP组、PAAF组、PAAF+L-arg组及NS组, PP组、PPAF组、PPAF+L-arg组及NS组组内两两比较均有统计学意义(P<0.05, 图2).
SAP时可产生大量胰腺炎相关性腹水(PAAF), 含有多种毒性有害物质和炎性细胞因子介质, 他们被腹膜吸收后亦可能是引起多脏器损害的重要原因之一. 但毫无疑问感染是影响SAP死亡率的关键性因素[4], 下调炎症性过程可以明显降低SAP的死亡率. 故临床上常通过腹腔灌洗、手术引流等方法来减少腹水中毒性物质吸收, 从而减轻SAP造成的全身性损害, 但这缺乏充足的实验依据. 本实验通过将PAAF注射到正常大鼠腹腔内, 12 h后肾小管上皮细胞中度水肿, 髓质内间质血管扩张、淤血, 并少量炎细胞浸润, 与PPAF组肾损伤相当; 但均明显轻于SAP组. 说明了PAAF可以屏蔽SAP时坏死胰腺对肾脏的影响, 单独诱导健康肾脏的损伤. 从而为研究PAAF诱发的肾损伤以及L-arg对该损伤的疗效提供了较为单纯的研究背景. 此外, 本实验SAP组与PP组、PAAF组和PPAF组中的淀粉酶、尿素氮及肌酐并无统计学差异, 且胰腺、肾脏的病变程度相当, 充分说明了PAAF腹腔内注射引起的腹膜炎为非特异性的炎症, 该模型更接近临床上的PAAF.
急性肾功能衰竭时肾小管上皮细胞出现凋亡早于肾功能的变化, 凋亡作为细胞丢失的途径之一, 同样可造成肾小管基底膜裸露、转运功能丧失及小管液回漏等功能障碍, 成为少尿或无尿的病理生理基础, 说明凋亡在肾功能损害中发挥重要的作用[5]. Nishikawa et al[6]利用鼠的PAAF对Madin-Darby狗的远端肾小管细胞进行培养发现, PAAF可以导致培养细胞凋亡且具有剂量和时间依赖性. 同时细胞DNA片段的酶联免疫吸附试验发现培养4 h后DNA片段开始增加到12 h达高峰, 提示有细胞的凋亡. 国内朱明德 et al[7]发现SAP大鼠肾脏的细胞凋亡数明显增多, 凋亡指数增高, 肾小管凋亡现象较肾小球严重, 肾脏细胞凋亡指数与肾功能的损害程度呈正相关. 本实验发现, SAP大鼠肾脏的细胞凋亡数明显增多, 凋亡指数增高, 肾小管凋亡现象较肾小球严重, 肾脏细胞凋亡指数与肾功能的损害程度呈正相关, 与肾脏的病理改变一致; 本实验又直接将PAAF注射到正常大鼠腹腔后, 肾脏呈急性肾损伤的Ⅱ级病理改变, 肾细胞的凋亡率明显增加, 均明显轻于SAP组. 说明SAP肾脏损伤至少部分是通过细胞凋亡机制引起的, 而且细胞凋亡是造成肾功能进一步恶化的重要因素之一.
近年来大量实验研究表明, 以L-arg为底物在体内一氧化氮合成酶(NOS)催化生成的NO, 是一种很强生物活性物质, 具有广泛且重要的生物学功能, 其主要是传递信息、舒张血管和细胞毒作用, 参与了多种炎症性疾病的发生、发展过程. 当某些疾病造成血管内皮细胞损伤时, 将导致NO生成减少, 因而补充外源性NO就成为一种必要的治疗措施[8-12]. L-arg及其体内代谢产物一氧化氮(NO)能有效改善胰腺微循环, 抑制白细胞内皮细胞相互作用, 抑制血小板黏附和聚集, 抗血栓形成, 而对急性胰腺炎(AP)具有一定的保护作用[13]. 但也有相反报道[14-20], 焦点主要集中在L-arg给药的量及给药的时机. 一般认为, 大剂量、高浓度的L-arg(20%, 2 g/kg)加重急性胰腺炎的损害, 而小剂量、低浓度的L-arg(1%, 100 mg/kg)起保护作用[21]. 本实验发现: SAP时大鼠存在显著血浆及胰组织NO增加, 胰腺血流量显著下降, 胰淀粉酶显著增加; 表明SAP大鼠早期存在NO合成相对不足, 随SAP大鼠病程发展, 胰酶、内毒素及炎症介质作用下, 内皮细胞合成NO过多, 反之过量NO生成通过直接抑制靶细胞的氧化呼吸链, 致胰腺细胞及胰血管内皮细胞损害; 与铜蛋白及其他氧自由基结合, 产生过量ONOO-, 从而对胰组织有毒性作用.
本实验尚发现: SAP大鼠12 h时存在内毒素血症, 血BUN、Cr显著升高, 肾组织NO显著升高; 即时给予小剂量L-arg后明显降低血内毒素及肾组织NO, 肾功能明显改善, 显著延长死亡时间; 此外, 本实验通过免疫组化发现iNOS只在肾小管细胞中表达, 而肾小球无表达; 与肾小管的病变一致; 且SAP的表达最强, 应用小剂量的L-arg反而较弱. 据此认为小剂量的L-arg通过增加组织中NO可以抑制肾细胞的凋亡以减轻肾损伤. 其具体机制可能主要包括以下几个方面: (1)抑制中性粒细胞活化及其表面CD11/CD18表达; (2)拮抗细胞因子生成, 从而减少引发"白细胞-内皮细胞相互作用"的始动因素; (3)灭活氧自由基, 已证实氧自由基可促进"白细胞-内皮细胞相互作用", 外源性L-arg可灭活氧自由基, 减少氧自由基的生成而使此反应逆转; (4)内皮细胞生成的NO在血管内皮表面形成保护层, 能降低血管阻力, 阻止中性粒细胞在血管内皮细胞表面的黏附. 这为临床治疗SAP肾损伤又提供了新视角.
尽管近年来的重症监护水平得到很大提高, 但是重症急性胰腺炎的病死率仍比较. 早期的多器官功能衰竭(包括心衰、肺衰、肾衰、肝衰)和后期的脓毒血症(由坏死胰腺及胰周组织感染引起)均导致了SAP很的病死率. 因此, 阐述这些系统并发症的机制对提高SAP患者的临床预后尤为重要.
本实验通过观察胰腺炎相关性腹水(PAAF)对正常肾细胞凋亡的影响、L-精氨酸(L-arg)对该损伤的影响, 探讨重症急性胰腺炎时急性肾损伤的发病机制及L-精氨酸对其的保护机制. 并进一步完善PAAF诱导胰外脏器损伤的模型建立.
新近研究表明, SAP时异常激活的胰酶在造成胰腺损伤的同时, 使粒细胞等炎症细胞过度激活, 大量释放多种炎性介质及细胞因子, 并通过扳机样作用, 形成瀑布样炎性损害, 不但使胰腺组织发生大量坏死, 而且还可导致SIRS和多器官衰竭;SAP时除了大量的胰酶释放入血, 还有大量有毒性细胞因子的腹水产生.
以胰腺炎相关性腹水(PAAF)腹腔注射建立大鼠的肾损伤模型, 并且成功建立了该模型, 该模型可以"屏蔽"SAP时坏死胰腺对肾脏的影响, 从而可以在模拟临床的条件下为研究肾损伤的机制提供了比较单纯的研究背景. 术前小剂量的L-arg可以通过抑制肾细胞的凋亡来减轻PAAF诱导的肾损伤.
本实验为临床上通过腹腔灌洗、引流等治疗SAP时的腹水以减轻病变程度提供了一定的实验理论依据, 模拟临床的条件下为研究肾损伤的机制提供了比较单纯的研究背景;更为SAP及其胰外脏器损伤的治疗提供了新的视点.
PAAF(pancreatitisassociatedasciticfluid), 即胰腺炎相关性腹水, 多见于重症急性胰腺炎时产生的腹部并发症, 内含复杂的炎症介质和毒性物质.
本文研究思路清楚, 内容新颖, 可读性强, 有较强的临床指导意义.
编辑: 王晓瑜 电编:郭海丽
| 1. | Kong L, Santiago N, Han TQ, Zhang SD. Clinical characteristics and prognostic factors of severe acute pancreatitis. World J Gastroenterol. 2004;10:3336-3338. [PubMed] |
| 2. | Uchikov A, Shopov A, Markova D. Renal complications in severe acute pancreatitis. Khirurgiia (Sofiia). 2003;59:9-10. [PubMed] |
| 3. | Takeyama Y. Significance of apoptotic cell death in systemic complications with severe acute pancreatitis. J Gastroenterol. 2005;40:1-10. [PubMed] |
| 4. | Sugimoto M, Takada T, Yasuda H, Nagashima I, Amano H, Yoshida M, Miura F, Uchida T, Isaka T, Toyota N. The lethal toxicity of pancreatic ascites fluid in severe acute necrotizing pancreatitis. Hepatogastroenterology. 2006;53:442-446. [PubMed] |
| 5. | Ortiz A, Justo P, Sanz A, Melero R, Caramelo C, Guerrero MF, Strutz F, Muller G, Barat A, Egido J. Tubular cell apoptosis and cidofovir-induced acute renal failure. Antivir Ther. 2005;10:185-190. [PubMed] |
| 6. | Nishikawa J, Takeyama Y, Ueda T, Hori Y, Ueno N, Yamamoto M, Saitoh Y. Induction of apoptotic cell death by pancreatitis-associated ascitic fluid in Madin-Darby canine kidney cells. FEBS Lett. 1995;373:19-22. [PubMed] |
| 8. | Burra P, Chirizzi L, Cardin R, Cadrobbi R, Baldan N, Calabrese F, Pettenazzo E, Calo L, Plebani M, Rigotti P. Warm hepatic ischemia in pigs: effects of L-arginine and oligotide treatment. J Invest Surg. 2001;14:303-312. [PubMed] |
| 9. | Chang WL, Chung CH, Wu YC, Su MJ. The vascular and cardioprotective effects of liriodenine in ischemia-reperfusion injury via NO-dependent pathway. Nitric Oxide. 2004;11:307-315. [PubMed] |
| 10. | Sukhotnik I, Helou H, Mogilner J, Lurie M, Bernsteyn A, Coran AG, Shiloni E. Oral arginine improves intestinal recovery following ischemia-reperfusion injury in rat. Pediatr Surg Int. 2005;21:191-196. [PubMed] |
| 11. | Yeh CH, Lin YM, Wu YC, Wang YC, Lin PJ. Nitric oxide attenuates cardiomyocytic apoptosis via diminished mitochondrial complex I up-regulation from cardiac ischemia-reperfusion injury under cardiopulmonary bypass. J Thorac Cardiovasc Surg. 2004;128:180-188. [PubMed] |
| 12. | Tsuchihashi S, Kaldas F, Chida N, Sudo Y, Tamura K, Zhai Y, Qiao B, Busuttil RW, Kupiec-Weglinski JW. FK330, a novel inducible nitric oxide synthase inhibitor, prevents ischemia and reperfusion injury in rat liver transplantation. Am J Transplant. 2006;6:2013-2022. [PubMed] |
| 13. | Sanchez-Bernal C, Garcia-Morales OH, Dominguez C, Martin-Gallan P, Calvo JJ, Ferreira L, Perez-Gonzalez N. Nitric oxide protects against pancreatic subcellular damage in acute pancreatitis. Pancreas. 2004;28:e9-15. [PubMed] |
| 14. | Sugiyama Y, Kato S, Mitsufuji S, Okanoue T, Takeuchi K. Pathogenic role of endothelial nitric oxide synthase (eNOS/NOS-III) in cerulein-induced rat acute pancreatitis. Dig Dis Sci. 2006;51:1396-1403. [PubMed] |
| 15. | Shields CJ, Delaney CP, Winter DC, Young L, Gorey TF, Fitzpatrick JM. Induction of nitric oxide synthase is a key determinant of progression to pulmonary injury in experimental pancreatitis. Surg Infect (Larchmt). 2006;7:501-511. [PubMed] |
| 16. | Sandstrom P, Brooke-Smith ME, Thomas AC, Grivell MB, Saccone GT, Toouli J, Svanvik J. Highly selective inhibition of inducible nitric oxide synthase ameliorates experimental acute pancreatitis. Pancreas. 2005;30:e10-15. [PubMed] |
| 17. | Andican G, Gelisgen R, Unal E, Tortum OB, Dervisoglu S, Karahasanoglu T, Burcak G. Oxidative stress and nitric oxide in rats with alcohol-induced acute pancreatitis. World J Gastroenterol. 2005;11:2340-2345. [PubMed] |
| 18. | Sugiyama Y, Kato S, Abe M, Mitsufuji S, Takeuchi K. Different effects of dexamethasone and the nitric oxide synthase inhibitor L-NAME on caerulein-induced rat acute pancreatitis, depending on the severity. Inflammopharmacology. 2005;13:291-301. [PubMed] |
| 19. | Leindler L, Morschl E, Laszlo F, Mandi Y, Takacs T, Jarmai K, Farkas G. Importance of cytokines, nitric oxide, and apoptosis in the pathological process of necrotizing pancreatitis in rats. Pancreas. 2004;29:157-161. [PubMed] |
| 20. | Saito M, Miyagawa I. N(G)-nitro-L-arginine methylester, a nitric oxide synthase inhibitor, diminishes apoptosis induced by ischemia-reperfusion in the rat bladder. Neurourol Urodyn. 2002;21:566-571. [PubMed] |