修回日期: 2007-04-01
接受日期: 2007-04-21
在线出版日期: 2007-06-18
目的: 研究内毒素对小鼠肝脏细胞β-葡萄糖苷酸酶(GUSB)mRNA表达及其血清活性的影响.
方法: 选择23只BALB/c小鼠分为2组, 对照组5只, 腹腔注射不含内毒素的生理盐水; 其余小鼠为实验组, 腹腔注射LPS, 并于注射后的1/2、2、4、24 h采用酶促动力学方法检测内源性β-葡萄糖苷酸酶(β-GD)活性; 取肝脏, 采用半定量RT-PCR方法检测GUSB mRNA的表达.
结果: 小鼠腹腔注射内毒素1/2、2和4 h后, 血清β-GD活性(3.96±0.88, 4.40±0.55, 5.65±0.58)显著高于对照组(2.14±1.46, P<0.05), 而LPS 24 h组与对照组无显著性差异; 内毒素刺激BALB/c小鼠2 h和LPS 4 h, 其肝脏细胞GUSB mRNA表达(1.10±0.23, 1.81±0.04)显著高于对照组(0.57±0.36, P<0.05), LPS 1/2 h和LPS 24 h的GUSB mRNA表达与对照组相比无显著性差异.
结论: BALB/c小鼠经过腹腔注射LPS后, 其血清中β-GD的酶活性具有显著性增加. LPS还可以增加小鼠肝脏细胞GUSB mRNA的表达. LPS可能通过增加组织β-GD活性的途径, 参与了胆色素结石的发病.
引文著录: 孙韶龙, 吴硕东, 戴显伟, 隋东明, 崔东旭. 内毒素调节肝脏β-葡萄糖苷酸酶mRNA的表达. 世界华人消化杂志 2007; 15(17): 1887-1892
Revised: April 1, 2007
Accepted: April 21, 2007
Published online: June 18, 2007
AIM: To investigate the effect of endotoxin on the expression of hepatocyte GUSB mRNA and serum β-glucuronidase (β-GD) activity in mice.
METHODS: Twenty-three BALB/c mice were divided into two groups: control (injection of Saline without endotoxin) (n = 5) and LPS (n = 18). In the Lipopolysa cc haride (LPS) group, after injection of endotoxin, mice were put to death at 1/2, 2, 4, and 24 h by breaking cervical vertebra. Serum β-glucuronidase activity was detected by an enzyme kinetics method; and the expression of GUSB mRNA in hepatocytes was detected by semi-quantity reverse transcription-polymerase chain reaction (RT-PCR).
RESULTS: In the LPS 1/2, 2 and 4 h groups, the activity of β-GD levels (3.96 ± 0.88, 4.40 ± 0.55, 5.65 ± 0.58 Fishman Unit, respectively) was significantly higher than that of the controls (2.14 ± 1.46, P < 0.05). However, there was no significant difference between the LPS 24 h and the control group. By contrast, the expression of GUSB mRNA in the LPS group was significantly higher after being stimulated for 2 and 4 h (1.10 ± 0.23 and 1.81 ± 0.04, respectively) than that in the control group (0.57 ± 0.36, P < 0.05). There were no significant differences between the LPS 1/2 h and LPS 24 h groups and the control group.
CONCLUSION: LPS not only increases the activity of serum β-glucuronidase in BALB/c mice, but also up-regulates the expression of GUSB mRNA in hepatocytes. This may be another mechanism by which endotoxin takes part in the pathogenesis of cholelithiasis.
- Citation: Sun SL, Wu SD, Dai XW, Sui DM, Cui DX. Endotoxin regulates the expression of hepatocyte β-glucuronidase mRNA. Shijie Huaren Xiaohua Zazhi 2007; 15(17): 1887-1892
- URL: https://www.wjgnet.com/1009-3079/full/v15/i17/1887.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i17.1887
胆石症是临床上比较常见的疾病, 目前对其病因和发病机制尚不是很清楚, 可能与胆道感染[1]、胆汁淤积、黏蛋白聚集、成核作用(nucleation)[2]、胆道动力异常、胆固醇、胆汁酸、胆红素代谢异常等因素有关. 其中, 胆汁中的钙离子与非结合胆红素形成沉淀是胆色素结石形成的主要原因[3]. 内源性或细菌源性β-葡萄糖苷酸酶(β-Glucuronidase, 简称β-GD, 其编码基因简写GUSB)都可以分解胆红素双葡糖醛酸酯[4], 产物之一非结合胆红素与钙质及高分子物质结合, 生成非结合胆红素钙, 他不仅是胆色素结石的主要成分, 也是某些胆固醇结石的核心. 由于正常肠道黏膜的屏障作用[5]和Oddi括约肌的单向阀门作用[6], 肠道细菌不是很容易进入胆道, 因而并非所有胆石症患者胆汁或结石中存在细菌, 但是细菌的内毒素(LPS)却可以很容易进入肝胆系统[7]. LPS可以激活人体白细胞[8], 释放多种细胞因子, 如肿瘤坏死因子(TNF)、白细胞介素(IL-8、IL-10)等. 我们推测: 通过各种途径进入肝胆系统的LPS, 刺激肝脏细胞、胆囊及胆管上皮细胞、胆汁中白细胞, 释放内源性β-GD, 参与胆石症的发病. 我们为验证上述假设, 以LPS刺激BALB/c小鼠, 于不同时间点检测肝脏GUSB mRNA表达, 以及血清中内源性β-GD的活性, 探讨内毒素与胆石成因之间的关系.
1.1.1 实验动物: 选择6-8周龄对内毒素比较敏感的BALB/c小鼠, 雌雄不拘, 体质量20-25 g左右, 为中国医科大学动物中心提供.
1.1.2 药物及试剂: 酚酞葡萄糖苷酸及内毒素(来自E.coli O111: B4), 购自Sigma公司; 总RNA提取系统(Ⅱ)Total RNA Extraction System(Ⅱ)为华美生物工程公司产品; 反转录PCR试剂盒BcaBESTTM RNA PCR Kit Ver.1.1及DNA Marker DL2000为宝生物工程(大连)有限公司产品. 引物由上海博亚生物技术有限公司合成, 其中: β-葡萄糖苷酸酶F: 5' TGTGGAGCAAGACATCGG3', R: 5' AACGGAGCAGGTTGAAAT3', 肌动蛋白(β-actin)F:5' CACCCTGTGCTGCTCACCGAGGCC 3'.
1.2.1 动物模型制备与分组: 5只小鼠ip不含内毒素的生理盐水作为对照组; 其余小鼠为实验组, 按5 mg/kg LPS腹腔注射, 并于注射后的0.5, 2, 4, 24 h断颈椎处死小鼠, 取血液抗凝离心, 上清冻存待测; 取肝脏置于DEPC水处理过的Eppendorf管中, -70℃保存备用.
1.2.2 酶促动力学方法检测血清内源性β-GD活性: 采用李宁 et al[9]报道的方法, 于pH4.5条件下测定内源性β-GD活性. 具体方法为: 上清液100 μL, 加0.01 mol/L酚酞葡萄糖苷酸水溶液0.1 mL, 加醋酸缓冲液100 μL, 调节pH值至4.5, 置于38℃保温, 反应24 h, 然后流水冷却, 加甘氨酸-十二烷基硫酸钠溶液(pH11.7)1.0 mL, 加去离子水1.5 mL混匀, 10 min后于波长540 nm比色, 测定A值. 以酚酞为标准品, 0-100 mg/L浓度系列绘制酚酞标准曲线, 1-5代表试管(表1).
| 空白管 | 1 | 2 | 3 | 4 | 5 | |
| 醋酸缓冲液 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 |
| 酚酞标准液 | 0 | 0.02 | 0.04 | 0.06 | 0.08 | 0.10 |
| 甘氨酸SDS | 2.8 | 2.8 | 2.8 | 2.8 | 2.8 | 2.8 |
| 蒸馏水 | 2.0 | 1.98 | 1.96 | 1.94 | 1.92 | 1.90 |
1.2.3 半定量RT-PCR检测肝脏GUSB mRNA的表达
1.2.3.1 引物设计: 查询小鼠GUSB mRNA序列, 利用Primer premier 5软件设计引物. 引物由上海博亚生物技术有限公司合成: (1)GUSB. F: 5' AACGGAGCAGGTTGAAAT 3', R: 5' TGTGGAGCAAGACATCGG 3'; (2)β-actin. F: 5' CACCCTGTGCTGCTCACCGAGGCC 3', R: 5' CCACACAGATGACTTGCGCTCAGG 3'.
1.2.3.2 肝脏细胞中总RNA的提取[10] 选取小鼠肝脏组织0.1 g, 置于1.5 mL微量离心管(Eppendorf tube)中, 剪碎研磨制成匀浆, 向管内添加1 mL RNA裂解酶, 用5 mL注射器在管内反复吹打均匀; 添加200 μL氯仿, 混匀, 于4℃ 13 000 r/min离心15 min, 吸上层水相至一0.5 mL微量离心管中, 加入50 μL异丙醇, 4℃放置30 min至1 h, 于4℃ 13 000 r/min离心15 min, 弃上清液, 得RNA沉淀, 加入750 mL/L乙醇300 μL充分洗涤沉淀, 于4℃ 13 000 r/min离心15 min, 弃上清液, 室温下干燥RNA沉淀10 min, RNA产量及纯度用岛津UV2201型紫外分光光度计260/280 nm波长测定, 并用双蒸水溶解RNA过夜, -70℃保存.
1.2.3.3 反转录合成cDNA第一链 (1)按下列组成配制反转录反应液: 25 mmol/L MgSO4 4 μL, 2×Bca 1st Buffer 10 μL, RNase Free dH2O 1.5 μL, dNTP Mixture (各10 mmol/L)1 μL, RNase Inhibitor(4×107 U/L) 0.5 μL, BcaBEST Polymerase(2.2×107 U/L), Oligo dT Primer 1 μL. (2)按以下条件进行反转录反应: 65℃ 1 min, 30℃ 5 min, 65℃ 15-30 min(15-30 min内匀速升温), 98℃ 5 min, 5℃ 5 min. 反转录产物cDNA于-70℃冻存备用.
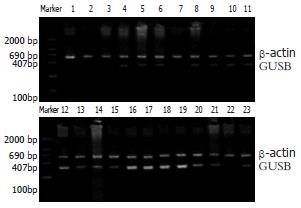
1.2.3.4 PCR反应 按下列组成配制PCR反应液: 25 mmol/L MgSO4 6 μL, 5×Bca 2st Buffer 16 μL, 灭菌蒸馏水, 55.5 μL, Bca-Optimized Taq, 0.5 μL, 上游特异性PCR引物1 μL, 下游特异性PCR引物1 μL. 把反应液加入到反转录反应结束后的PCR反应管中, 轻轻混匀. 94℃ 30 s, 25-30循环, 37-65℃ 30 s, 72℃ 1-10 min, 72℃ 5 min. PCR反应产物以肌动蛋白(β-actin)作对照, 取反应液(5-10 μL)用20 g/L琼脂糖凝胶电泳(60 V, 1.5 h), 溴化乙锭染色显示, 凝胶成像仪观察, 使用10Kodak型号紫外、白透射仪成像分析系统分析成像, 以GUSB mRNA/β-actin mRNA电泳带的荧光强度比值作为GUSB mRNA的表达量标.
统计学处理 所有数据采用均数±标准差(mean±SD)表示, 应用SPSS11.5统计软件进行方差分析, P<0.05认为有显著性差异.
共计对23只BALB/c小鼠ip内毒素(5 mg/kg), 作用时间最长24 h, 无死亡, 亦未发现有小鼠发生腹腔感染.
各组BALB/c小鼠ip内毒素后, 血清β-葡萄糖苷酸酶活性的情况, 经过统计分析, 注射LPS 0.5, 2和4 h后, 血清β-葡萄糖苷酸酶活性显著高于对照组, 而24 h组与对照组无显著性差异(表2).
我们采用的检测组织β-葡萄糖苷酸酶的方法原理为: 组织β-葡萄糖苷酸酶在其最适pH4.5条件下, 可以水解酚酞葡萄糖苷酸, 生成酚酞和β-葡萄糖苷酸钠盐, 随着反应进行, 反应混合物中酚酞量增加, 在碱性环境下显红色. 其颜色的深浅与β-GD的活性成正比[11], 以100 mL血清每小时水解酚酞葡萄糖苷酸所释放酚酞的微克数表示β-GD的活性单位(Fishman Unit). 人β-葡萄糖苷酸酶(EC 3.2.1.31)是一种溶酶体酸性水解酶, 其系统名是β-D-葡萄糖苷酸葡萄糖醛酸水解酶, (β-D-glucuronide glucuronosohydrolase), 能特异的催化葡萄糖酸C1位上的β-糖苷键水解, 释放出葡糖醛酸. β-GD广泛分布于人体各组织[12](如肝、肾、脾、肾上腺、甲状腺、胃肠黏膜、子宫和包皮腺), 细胞(如红细胞、白细胞、血小板、巨噬细胞、成纤维细胞)及体液(如血清、尿液、脑脊液、胆汁、阴道液、胃液和十二指肠液等)中, 其胞内定位主要在溶酶体、线粒体及微粒体内, 他是一类四聚体糖蛋白, 分子量275 000. β-GD的活性于个体间差异较大, 在体内的真正生理功能迄今尚未完全阐明, 可能与胆红素代谢、类固醇激素的生物转化及各种葡萄糖苷酸的水解有关; 他还可能与其他溶酶体酶共同参与细胞器的溶解及细胞的更新; 从多型核白细胞(PMN)释放的β-GD可以在炎症引起组织损伤及杀灭细菌方面具有重要作用. 此酶的另一个作用是在溶酶体内通过去除硫酸软骨素和硫酸乙酰肝素末端β-葡糖醛酰基残基降解糖胺聚糖. 此酶缺乏[13-14]可以造成非降解糖胺聚糖的贮积, 导致黏多糖贮积症Ⅶ型(mucopolysaccharidosis type seven, MPS Ⅶ).
棕色素结石含有约60%胆红素钙, 黑色素结石含有约40%胆红素钙, 而某些胆固醇结石亦含有胆红素钙的核心, 这说明胆石症的病因与胆红素的代谢密切相关[15]. Maki[16]认为, 细菌β-GD水解胆汁中的结合胆红素, 成为非结合胆红素(UCB)和葡萄糖醛酸, UCB再与钙结合, 在硫酸糖蛋白的参与下, 经聚合导致结石产生, 此细菌酶解致石学说已得到公认, 但是并非所有的胆石症患者的胆汁或结石中存在细菌, 提示了一定有非细菌因素参与胆石症的成因. 由于内源性β-GD同样可以水解胆红素双葡糖醛酸酯, 即水解结合胆红素, 因而与胆色素结石的形成有关. Ostrow et al[17]认为胆道及肝组织的内源性β-GD水解结合胆红素导致色素沉淀进而形成结石; Ho et al[18]通过研究发现, 棕色素结石组胆汁中内源性β-GD活性显著高于对照组, 而且该酶活性与胆红素的分解率及分解程度有很强的正相关性, 推测内源性β-GD可能在胆色素结石的发病中起主要作用. 杨波 et al[19]通过免疫电镜胶体探针技术, 对胆红素结石患者肝细胞溶酶体内源性β-GD进行定量研究, 发现内源性β-GD与胆红素结石的形成密切相关. 内源性β-GD有多种形式, 其作用的最适pH值为3.8, 4.5和5.2, 与正常胆汁pH值相差大, 且受胆汁中葡萄糖醛酸-1, 4-内酯及胆盐的抑制, 故其在胆汁中活性甚弱[20]. 但是, 如果发生胆道感染, 肝、胆管上皮及胆汁中白细胞分泌的酶增多, 且细胞膜的通透性增大, 释放入细胞外的酶量就会增加. Osnes et al[21]发现, 胆总管胆汁中LPS的水平与结石的发病密切相关, 推测其中的一个机制是: LPS通过细胞毒效应激活胆道黏膜细胞及位于胆汁中的白细胞, 促进释放内源性β-GD. 如果胆汁中的β-GD超出了抑制剂的作用, 就会水解结合胆红素, 导致结石的发生.
我们的研究发现, 正常BALB/c小鼠血清内可以检测到一定活性的β-GD, 其肝脏细胞亦有一定的GUSB mRNA表达. ip LPS以后, 无论是血清β-GD活性, 还是肝细胞GUSB mRNA表达, 都有增加. 对于β-GD活性, 这种增加开始于内毒素注射后0.5 h, 在4 h增加到高峰, 随后下降, 在24 h已经和对照组的酶活性无显著性差异; 对于肝细胞GUSB mRNA表达, 这种增加也具有一定的时间依赖性, 即在LPS刺激的24 h之内, β-GD活性随刺激时间的延长, 呈现先升高, 后下降的趋势, 只不过这种增加直到LPS注射2 h后才和对照组有显著性差异, 在24 h也下降到与对照组相差无几的水平. 针对此处肝细胞GUSB mRNA表达的增加反而滞后于血清β-GD活性增加的现象, 我们认为有两种可能的原因: (1)实验误差造成的; (2)小鼠在ip LPS后, 血清中β-GD活性的增加机制, 是独立于肝脏细胞GUSB mRNA表达, 即血清β-GD活性的增加很有可能是LPS作用于血细胞的结果. 由于我们从体质量<30 g的BALB/c小鼠身上, 总共取血不足0.5 mL, 分离白细胞提取RNA比较困难, 故LPS对BALB/c小鼠外周血单核细胞GUSB mRNA表达的影响情况, 我们未知.
LPS增加血清中β-GD活性的机制可能如下: LPS与肝脏细胞和外周血单核细胞表面的CD14结合后[22-23], 具有信号传导功能[24-25], 通过钟样受体4(Toll like receptor 4, TLR4)实现跨膜转导[26-27], 使核因子-κB(NF-κB)从胞浆转移至核内[28], 从而启动细胞内控制β-GD的基因(GUSB基因)转录更多的mRNA, 增加β-GD蛋白的合成. 我们的研究发现, LPS刺激BALB/c小鼠后, 不但可以增加其血清β-GD的活性, 还可以向上调节小鼠肝脏细胞表达GUSB mRNA, 这就从分子水平证明LPS可以增加组织源性β-GD的合成和释放, 他也许可以解释那些不伴有细菌感染的胆色素结石的发病原因. 由于Oddi括约肌的单向阀门作用(non-return valve action)和肠道黏膜的屏障作用[29-30], 多数细菌很难从肠道进入胆道, 但LPS却很容易. 进入肝胆系统的LPS有可能刺激肝脏细胞, 胆道上皮细胞, 胆汁中的白细胞, 增加GUSB mRNA表达进而增加了胆汁中的β-GD活性, 在一定的环境下, β-GD分解结合胆红素, 成为非结合胆红素(UCB)和葡萄糖醛酸, UCB再与钙结合, 导致结石产生.
总之, BALB/c小鼠经过ip LPS后, 其血清中β-GD的酶活性具有显著性增加. LPS还可以增加小鼠肝脏细胞GUSB mRNA的表达. LPS可能通过增加组织β-GD活性的途径, 参与了胆色素结石的发病.
感谢细胞培养实验室姜涛、张红老师提供的技术支持; 感谢中心实验室何魁休主任、潘莉莉老师提供的帮助.
内源性β-葡萄糖苷酸酶可以分解胆红素双葡糖醛酸酯, 产物之一非结合胆红素与钙质及高分子物质结合, 生成非结合胆红素钙, 参与胆结石形成, 但人体内源性β-葡萄糖苷酸酶在胆汁中活性很弱. 内毒素可以激活人体白细胞, 释放多种细胞因子, 如肿瘤坏死因子、白细胞介素等, 他能否刺激细胞, 释放内源性β-葡萄糖苷酸酶呢?本文章即是为了验证上述假设.
内毒素与细胞表面的CD14结合, 再通过钟样受体4实现跨膜转导, 使核因子-κB从胞浆转移至核内, 从而启动细胞内的基因转录更多的mRNA, 增加蛋白的合成, 此通路系本领域研究的热点问题.
首次发现内毒素可以增加小鼠血清中β-葡萄糖苷酸酶活性, 向上调节该基因mRNA的表达, 为不伴有细菌感染的胆色素结石的发病原因提供间接的证据.
本研究对指导临床预防胆石症的发病提供实验依据, 即通过使用肠黏膜保护剂等措施控制内毒素入血, 对减少胆石症的产生有一定意义.
1内源性β-葡萄糖苷酸酶:又叫组织源性β-葡萄糖苷酸酶, 是一种溶酶体酸性水解酶, 能特异的催化葡萄糖酸C1位上的β-糖苷键水解, 释放出葡糖醛酸, 他是一类四聚体糖蛋白, 分子量275000, 在体内的真正生理功能迄今尚未完全阐明, 可能与胆红素代谢、类固醇激素的生物转化及各种葡萄糖苷酸的水解有关.2FishmanUnit:是β-葡萄糖苷酸酶的活性单位, 以100mL血清每小时水解酚酞葡萄糖苷酸所释放酚酞的微克数表示.
本文研究了内毒素对小鼠肝脏GUSBmRNA表达及血清β-葡萄糖苷酸酶活性的调节作用, 立题新颖, 论证有据, 有一定的参考价值.
编辑: 王晓瑜 电编:郭海丽
| 1. | Shaffer EA. Gallstone disease: Epidemiology of gallbladder stone disease. Best Pract Res Clin Gastroenterol. 2006;20:981-996. [PubMed] |
| 2. | Dhiman RK, Sarkar PK, Sharma A, Vasishta K, Kohli KK, Gupta S, Suri S, Chawla Y. Alterations in gallbladder emptying and bile retention in the absence of changes in bile lithogenicity in postmenopausal women on hormone replacement therapy. Dig Dis Sci. 2004;49:1335-1341. [PubMed] |
| 3. | Sayers C, Wyatt J, Soloway RD, Taylor DR, Stringer MD. Gallbladder mucin production and calcium carbonate gallstones in children. Pediatr Surg Int. 2007;23:219-223. [PubMed] |
| 4. | Osnes T, Sandstad O, Skar V, Osnes M. beta-Glucuronidase in common duct bile, methodological aspects, variation of pH optima and relation to gallstones. Scand J Clin Lab Invest. 1997;57:307-315. [PubMed] |
| 5. | Yasuda T, Takeyama Y, Ueda T, Shinzeki M, Kishi S, Sawa H, Nakajima T, Kuroda Y. Protective effect of caspase inhibitor on intestinal integrity in experimental severe acute pancreatitis. J Surg Res. 2007;138:300-307. [PubMed] |
| 6. | Ochi T, Nakazawa S, Naito Y, Tsukamoto Y. Endoscopic manometry of the sphincter of Oddi and pancreatic duct in patients with papillary stenosis. Endoscopy. 1991;23:255-258. [PubMed] |
| 7. | Cullen JJ, Park H, Ephgrave KS, Conklin JL. Lipopolysaccharide temporarily impairs sphincter of Oddi motility. Nitric Oxide. 2001;5:547-554. [PubMed] |
| 8. | Heagy W, Nieman K, Hansen C, Cohen M, Danielson D, West MA. Lower levels of whole blood LPS-stimulated cytokine release are associated with poorer clinical outcomes in surgical ICU patients. Surg Infect (Larchmt). 2003;4:171-180. [PubMed] |
| 10. | Kasahara T, Miyazaki T, Nitta H, Ono A, Miyagishima T, Nagao T, Urushidani T. Evaluation of methods for duration of preservation of RNA quality in rat liver used for transcriptome analysis. J Toxicol Sci. 2006;31:509-519. [PubMed] |
| 11. | Fishman WH, Kato K, Anstiss CL, Green S. Human serum beta-glucuronidase; its measurement and some of its properties. Clin Chim Acta. 1967;15:435-447. [PubMed] |
| 12. | Lisiewicz J, Gierek T, Pilch J. Deficiency of beta-glucuronidase in neutrophils from patients with precancerous states of the larynx. Folia Haematol Int Mag Klin Morphol Blutforsch. 1978;105:194-199. [PubMed] |
| 13. | Donsante A, Levy B, Vogler C, Sands MS. Clinical response to persistent, low-level beta-glucuronidase expression in the murine model of mucopolysaccharidosis type VII. J Inherit Metab Dis. 2007;30:227-238. [PubMed] |
| 14. | Karolewski BA, Wolfe JH. Genetic correction of the fetal brain increases the lifespan of mice with the severe multisystemic disease mucopolysaccharidosis type VII. Mol Ther. 2006;14:14-24. [PubMed] |
| 15. | Liu XT, Hu J. Relationship between bilirubin free radical and formation of pigment gallstone. World J Gastroenterol. 2002;8:413-417. [PubMed] |
| 16. | Maki T. Pathogenesis of calcium bilirubinate gallstone: role of E. coli, beta-glucuronidase and coagulation by inorganic ions, polyelectrolytes and agitation. Ann Surg. 1966;164:90-100. [PubMed] |
| 17. | Ostrow JD, Murphy NH. Isolation and properties of conjugated bilirubin from bile. Biochem J. 1970;120:311-327. [PubMed] |
| 18. | Ho KJ, Hsu SC, Chen JS, Ho LH. Human biliary beta-glucuronidase: correlation of its activity with deconjugation of bilirubin in the bile. Eur J Clin Invest. 1986;16:361-367. [PubMed] |
| 19. | 杨 波, 朱 善德, 赵 永光, 岳 辉, 杜 晓炬, 李 荫山, 张 弘, 于 众, 于 安民. 肝细胞内源性β-葡萄糖醛酸酶与胆红素结石关系的免疫电镜研究. 中华肝胆外科杂志. 2000;6:123-125. |
| 20. | Cao HJ, Fang Y, Zhang X, Chen WJ, Zhou WP, Wang H, Wang LB, Wu JM. Tumor metastasis and the reciprocal regulation of heparanase gene expression by nuclear factor kappa B in human gastric carcinoma tissue. World J Gastroenterol. 2005;11:903-907. [PubMed] |
| 21. | Osnes T, Sandstad O, Skar V, Osnes M. Lipopolysaccharides and beta-glucuronidase activity in choledochal bile in relation to choledocholithiasis. Digestion. 1997;58:437-443. [PubMed] |
| 23. | Faivre V, Lukaszewicz AC, Alves A, Charron D, Payen D, Haziot A. Accelerated in vitro differentiation of blood monocytes into dendritic cells in human sepsis. Clin Exp Immunol. 2007;147:426-439. [PubMed] |
| 25. | Tyml K, Wang X, Lidington D, Ouellette Y. Lipopolysaccharide reduces intercellular coupling in vitro and arteriolar conducted response in vivo. Am J Physiol Heart Circ Physiol. 2001;281:H1397-1406. [PubMed] |
| 26. | Saitoh S, Miyake K. Mechanism regulating cell surface expression and activation of Toll-like receptor 4. Chem Rec. 2006;6:311-319. [PubMed] |
| 27. | Dai J, Liu B, Ngoi SM, Sun S, Vella AT, Li Z. TLR4 hyperresponsiveness via cell surface expression of heat shock protein gp96 potentiates suppressive function of regulatory T cells. J Immunol. 2007;178:3219-3225. [PubMed] |
| 28. | Sawaki J, Tsutsui H, Hayashi N, Yasuda K, Akira S, Tanizawa T, Nakanishi K. Type 1 cytokine/chemokine production by mouse NK cells following activation of their TLR/MyD88-mediated pathways. Int Immunol. 2007;19:311-320. [PubMed] |
| 29. | Sun XQ, Fu XB, Zhang R, Lu Y, Deng Q, Jiang XG, Sheng ZY. Relationship between plasma D(-)-lactate and intestinal damage after severe injuries in rats. World J Gastroenterol. 2001;7:555-558. [PubMed] |