修回日期: 2007-01-01
接受日期: 2007-01-31
在线出版日期: 2007-06-08
目的: 观察生长抑素类似物(奥曲肽)对实验性急性胰腺炎(acute pancreatitis, AP)胰腺炎相关蛋白(pancreatitis-associated protein, PAP)的表达及胰腺组织病理变化的影响.
方法: Wistar大鼠80只, 随机分为阴性对照组、假手术组、手术组、治疗组, 每组均在6, 12 h采集标本. 胰腺组织病理切片证实后, 对PAP进行半定量RT-PCR及免疫组化检测, 其血清做ELISA检测.
结果: 免疫组化结果显示, 手术组PAP表达比假手术组显著增强(χ2 = 26.11, P<0.01), 治疗组比手术组显著降低(χ2 = 15.65, P<0.05). RT-PCR及ELISA显示, PAP在手术后组织和血清中的表达明显升高, 经奥曲肽治疗后明显降低, 3组间有显著差异(RT-PCR: F = 71.3, P<0.01; ELISA: F = 925, P<0.001). 免疫组化、RT-PCR及ELISA结果组内比较显示, 手术组PAP表达随时间逐渐显著升高, 6, 12 h之间比较有显著差异(χ2 = 16.92, P<0.05; t = 2.49, P<0.05; t = 2.56, P<0.05), 而其他组(治疗组ELISA结果除外)6, 12 h之间无显著差异(P>0.05). 手术组病理改变明显.
结论: PAP是AP早期表达明显升高的蛋白, 对奥曲肽反应敏感, 对胰腺炎的诊断和预后判断有一定作用.
引文著录: 佟柏峰, 周昊昕, 邹小明, 彭海, 周文学, 杨维良. 生长抑素类似物对大鼠急性胰腺炎PAP的影响. 世界华人消化杂志 2007; 15(16): 1794-1799
Revised: January 1, 2007
Accepted: January 31, 2007
Published online: June 8, 2007
AIM: To investigate the influence of somatostatin anologue octreotide on the expression of pancreatitis-associated protein (PAP) and pathological changes in pancreas in rats with acute pancreatitis (AP). Then the level of serum PAP was measured by enzyme-linked immunosorbent assay (ELISA).
METHODS: Eighty Wistar rats were randomized into group A, B, C and D, served as negative control group, sham operation group, AP model group and octreotide-treated group, respectively. The experimental samples were collected at the 6th and 12th h in all the groups. The expression of PAP in pancreas was detected by semi-quantitative reverse transcription-polymerase chain reaction (RT-PCR) and immunohistochemistry (IHC) after the AP tissues were verified by pathological method. Then the level of serum PAP was measured by enzyme-linked immunosorbent assay (ELISA).
RESULTS: IHC showed that the expression of PAP was significantly higher in group C than that in group B (χ2 = 26.11, P < 0.01), but it was markedly lower in group D than that in group C (χ2 = 15.65, P < 0.05). RT-PCR and ELISA demonstrated a significant PAP increase in tissue and serum in group C, but a notable decrease in group D, and there were significant differences between group B, C and D (RT-PCR: F = 71.3, P < 0.01; ELISA: F = 925, P < 0.001). PAP expression at the 6th and 12th h had obvious difference in group C (IHC: χ2 = 16.92, P < 0.05; RT-PCR: t = 2.49, P < 0.05; ELISA: t = 2.56, P < 0.05), but not in the other groups (except the ELISA result). Dramatic pathological changes were observed in group C.
CONCLUSION: PAP highly expressed at the early stage of AP, and it is sensitive to the treatment of octreotide. PAP is also useful for the diagnosis and prognosis of acute panreatitis.
- Citation: Tong BF, Zhou HX, Zou XM, Peng H, Zhou WX, Yang WL. Influence of somatostatin anologue on pancreatitis-associated protein in rats with acute pancreatitis. Shijie Huaren Xiaohua Zazhi 2007; 15(16): 1794-1799
- URL: https://www.wjgnet.com/1009-3079/full/v15/i16/1794.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i16.1794
近些年的研究发现, 由于胰腺炎相关蛋白(pancreatitis-associated protein, PAP)在急性胰腺炎(acute pancreatitis, AP)时大量合成、分泌, 而在正常胰腺及胰液中并不存在; 并且其与AP的发生、发展密切相关, 故他可作为AP的特异性诊断指标, 并可用于AP的治疗效果评价和预后判断[1-8]. 人工合成的生长抑素类似物已广泛用于临床治疗急性胰腺炎多年, 取得了一定的治疗效果[9-16], 但对其具体作用机制至今也尚未完全阐明, 因此我们研究生长抑素类似物对PAP蛋白水平和基因表达的影响, 探讨生长抑素类似物和PAP之间的关系, 将有助于进一步揭示AP发病机制和指导临床对AP的治疗.
♂健康成年Wistar大鼠80只, 体质量180-200 g, 由哈尔滨医科大学第二临床医学院实验动物中心提供, 适应性饲养1 wk后开始实验. 奥曲肽购自诺华公司. 牛磺胆酸钠(970 g/L)购自Sigma公司. 琼脂糖购自上海蓝季科技发展有限公司. TRIzol试剂为Invitrogen公司产品, RT试剂盒(A3500)购自Promega公司. PAP及β-actin引物由上海申能博彩生物科技有限公司合成, 引物序列(由Primer3软件设计)如下: PAP(目的片段长度为330 bp): 上游: 5'TGCTCTCCTGCCTGATGCTCTTAT3'; 下游: 5'TACTCCACTCCCATCCACCTCCAT3'. β-actin(目的片段长度为452 bp): 上游: 5'GAGAGGGAAATCGTGCGTGAC3'; 下游: 5'CATCTGCTGGAAGGTGGACA3'. 小鼠抗大鼠PAP单克隆抗体购自美国R&D公司, 兔抗小鼠超敏试剂盒(UltraSensitiveTM SP, 即用型)购自福州迈新生物技术有限公司, 操作按说明书进行. 大鼠PAP定量ELISA试剂盒购自美国Rapidbio公司.
1.2.1 动物模型的建立及标本采集: 将实验动物随机分为4组, 分别为A组(阴性对照组)、B组(假手术组)、C组(手术组)、D组(治疗组), 每组20只. 各组内每10只分别于造模后6和12 h采集标本. 用100 mL/L水合氯醛(3 mL/kg)腹腔注射麻醉大鼠, 固定于无菌手术台, 消毒腹部皮肤, 正中切口进腹, 于十二指肠内侧可见片状分布的胰腺. 在近肝门端胆胰管用无损伤金属夹将其夹闭, 通过十二指肠侧壁用注射器针头穿入胆胰管, 细丝线活结结扎胆胰管和针头, 用WZS-50型微量注射泵(浙江大学仪器厂)以20 μL/min速度逆行注射3.5 g/100 mL牛磺胆酸纳(1 mL/kg), 然后松开结扎线和金属夹, 两层连续缝合关闭腹腔[17-18]. 假手术组于胆胰管逆行注射等剂量生理盐水, 手术组于术后30 min背部皮下注射奥曲肽(20 μg/kg). 各组动物每10只分别于造模后6和12 h处死大鼠, 于下腔静脉采血后离心(3000 r/min), 保留血清, -20℃冻存备用. 完整切除胰腺组织, 部分于中性甲醛中固定, 另一部分立即至于-195℃液氮保存备用.
1.2.2 病理评估: 每标本随机选取×100视野30个, 每视野划分100个网络, 计算该区域正常与坏死胰腺组织所占网格数目及间质浸润炎症细胞数量. 坏死为丧失正常腺泡细胞结构及HE改变, 选取造模成功者进行下一步实验.
1.2.3 免疫组化检测: 选取造模成功的标本按试剂盒说明, 采用DAB显色, 苏木素复染. 用推荐的阳性标本和磷酸盐缓冲液(PBS)代一抗分别做阳性和阴性对照. 高倍视野分4区各计数100个细胞, 求其平均数值. 阳性判断标准: 阳性细胞≤25%为+(弱阳性), 25%-50%为++(阳性), ≥50%为+++(强阳性), 未见阳性染色为-(阴性).
1.2.4 胰腺总RNA的提取及RT-PCR: 将保存于液氮中的胰腺组织研碎后加1 mL TRIzol试剂, 按试剂盒说明书提取RNA后至于-80℃保存. 采用紫外分光光度仪测定A260/A280比值为1.9, 按1A = 40 mg/L计算RNA含量. 逆转录反应: 按A3500试剂盒说明书进行反应, 将RNA逆转录为cDNA. PCR反应: 每0.2 mL Eppendorf管中加入MgCl2 (25 mmol/L) 2 μL, 10×反应缓冲液2.5 μL, dNTP(10 mmol/L) 0.5 μL, 上下游特异引物1 μL, Tag DNA聚合酶0.5 μL, 各实验样品(cDNA) 2 μL, 加入RNase Free dH2O 15.5 μL, 补足25 μL反应体系, 94℃ 5 min, 94℃ 30 s, 56℃ 30 s, 72℃ 22 s, 后三步反应进行35个循环, 结束前72℃ 7 min以充分延伸, 产物置4℃保存.
1.2.5 PCR产物电泳及ELISA检测: PCR产物经20 g/L琼脂糖凝胶电泳, 紫外灯下观察结果, 以β-actin为内参照, 结果以PCR产物/β-actin比值表示. 按照试剂盒说明测定各组血清标本PAP
含量.
统计学处理 所有数据以均数加减标准差(mean±SD)表示. 用t检验、χ2检验、单因素方差分析及多个样本均数间的多重比较进行显著性检验, P≤0.05表示差异具有显著性.
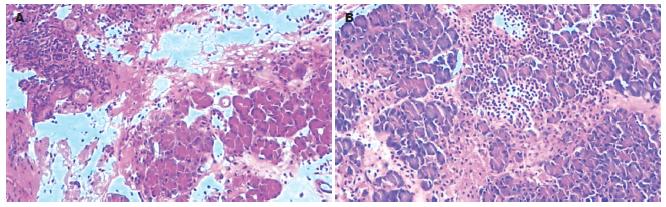
阴性对照组及假手术组胰腺无明显病理改变. 其余各组均可见胰腺组织出血成血块, 多叶成片坏死, 成堆炎细胞浸润, 或破坏原组织, 胰腺炎的炎症改变随时间延长病变明显加重, 相继有间质水肿、灶性出血、白细胞浸润、脂肪坏死、腺泡坏死、小脓肿、大出血等(图1).
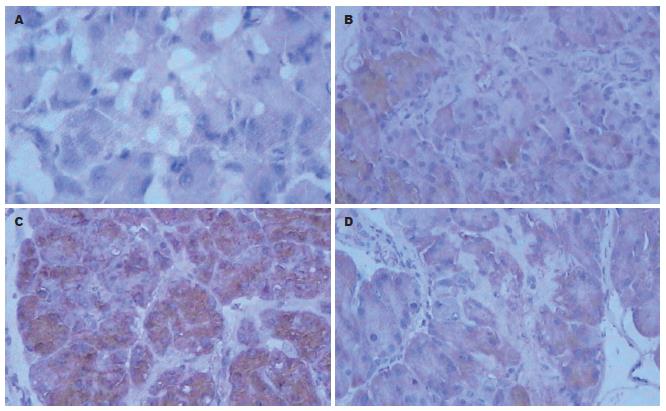
A组及B组在胞质中呈阴性或极少有弱阳性表达. C组在胞质中呈较强棕黄色表达. D组介于两者之间. 与B组相比, C组PAP的表达差异有统计学意义(χ2 = 26.11, P<0.01, 图2A-B). 与C组相比, D组PAP的表达差异有统计学意义(χ2 = 15.65, P<0.05, 图2C-D). 另外, C组中12 h的PAP蛋白90%呈强阳性表达, 且颜色较深, 而6 h组中仅40%呈强阳性, 两者相比表达差异有统计学意义(χ2 = 16.92, P<0.05, 图2B-C). D组中6 h与12 h相比PAP的表达差异无统计学意义(χ2 = 9.91, P>0.05).
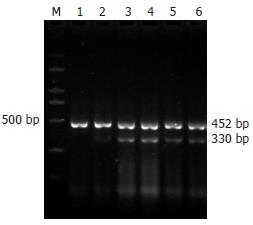
阴性对照组未见PAP表达. B组、C组及D组的mRNA表达明显增强(图3), 3组之间差异具有显著性(F = 71.3, P<0.01, 表1). 各组AP 6与12 h相比较, B组与D组mRNA表达的差异不具有显著性(0.05 vs 0.06, t = 0.82, P>0.05; 0.14 vs 0.16, t = 1.33, P>0.05), C组PAP的表达差异具有显著性(0.32 vs 0.37, t = 2.49, P<0.05).
阴性对照组血清中未能检测到PAP. B组中可检测少量PAP. C组及D组血中PAP的含量明显增加, 3组之间差异具有显著性(F = 925, P<0.001). 各组AP 6与12 h相比较, B组PAP含量差异不具有显著性(230 vs 243, t = 1.21, P>0.05), C组、D组两时间点的PAP含量差异具有显著性(1378 vs 1606, t = 2.56, P<0.05; 1294 vs 1399, t = 2.78, P<0.05, 表2).
AP是以胰腺自身消化为基础, 胰腺实质坏死为主要特征的一种全身性疾病, 发病机制目前尚不完全清楚. 因其起病急、病情重、发展快、并发症多、病死率高而不断受到消化内外科医生以及基础医学学者们的重视. 而AP发病的不确定性一直困扰着他的临床诊断和处理. 目前, 该病诊断的"金标准"为高分辨率CT以及Ranson和APACHEⅡ评分系统[19]. 高分辨率CT在临床常规应用受到一定限制, 而评分系统不仅需要测定很多指标, 而且在症状发生后48 h才可判断. 虽有重症监护和内外科积极处理, 但SAP的病死率仍在20%-40%. 尽早明确诊断和积极干预对SAP的预后至关重要, 因此国内外医学界一直试图建立一种既有较高敏感性、特异性和准确性, 又简单易行的急诊SAP鉴别方法.
PAP是Keim et al[20]在1984年发现的一种新的分泌型蛋白质. 由于这种蛋白质仅发现于诱发AP模型的胰液中, 因此称为PAP. PAP在胰腺外分泌部腺泡细胞的粗面内质网合成, 并储存于酶原颗粒中. 在正常胰腺及胰液中检测不出PAP, 仅在胰腺炎发生后, 尤其重症胰腺炎, 胰腺的酶蛋白基因表达迅速调整[21], 许多编码胰腺酶蛋白的mRNA水平显著降低, 其中淀粉酶, 胰蛋白酶原I, 糜蛋白酶原B, 弹力蛋白酶1, 前羧肽酶A等的mRNA水平在急性期降低了50%. 相反, PAP mRNA表达明显升高, 本实验结果也证实了这一点. 由于PAP基因在胰腺腺泡细胞中过表达, 在胰液及血清中都可检测到较高水平PAP. 因此, PAP可望成为胰腺炎的一个特异性的早期诊断指标. 病理研究发现PAP水平与胰腺炎的严重程度密切相关[22], 胰腺炎程度越高, PAP水平也就越高. 随着病情控制和患者逐渐恢复, 血清PAP水平开始不断下降[23]. 因此, PAP可作为急性期胰腺炎轻重程度、病情预测的依据和病程追踪观察的血清指标. 近年来人工合成的生长抑素八肽拟似剂--奥曲肽, 广泛用于临床治疗AP, 取得了一定的治疗效果, 但对其具体作用机制至今尚未完全阐明. 目前, 较为公认的理论为奥曲肽通过直接和间接的抑制胰酶的释放和活化, 松弛Oddi's括约肌, 降低胰管压力, 减少胰管内胰液进入胰腺组织, 减轻由此引起的胰腺自身消化, 从而在AP的治疗中发挥重要作用[24], 近年来, Hietaranta et al[25]认为, 生长抑素可能通过抑制胰弹性蛋白酶的释放, 进而使TLR信号通路所调控的NF-κB的表达降低, 从而下调了炎性细胞因子的基因表达, 这可能是生长抑素治疗胰腺炎的主要机制.
本实验结果证实, C组中随造模时间延长, PAP mRNA表达明显升高. 奥曲肽在各时间点都可明显降低PAP在胰腺组织中的基因表达. 这提示奥曲肽有可能也是通过TLR信号通路实现其对PAP的表达调控, 而应用PAP的优势在于他的特异性较炎性因子为强. 本实验从多个角度验证了随胰腺炎时间延长, PAP在基因水平、蛋白水平及外周血中表达明显增强, 应用奥曲肽治疗后, 从各个层次均可使PAP表达下降, 而D组中6与12 h相比PAP基因及蛋白的表达差异无统计学意义则提示在今后的实验中可将造模时间延长并增加给药次数以进一步观察有无变化.
虽然, PAP产生的确切机制目前尚不清楚, 但在AP时其增高的程度明显高于其他疾病却是不争的事实. 采用ELISA法, 免疫组化法和RT-PCR方法从蛋白水平和mRNA水平的检测均支持这一点. 对于PAP的功能, 尚处于探索中, Motoo et al[26]研究发现通过诱导PAP mRNA的表达, 合成PAP而抑制胰腺腺泡细胞凋亡的发生, 而奥曲肽治疗AP的机制之一可能是诱导损伤的胰腺细胞凋亡以减轻炎症反应[27], 故奥曲肽可能是通过抑制PAP mRNA的表达, 从而达到治疗胰腺炎的目的. 奥曲肽可直接作用于PAP并从各个层次降低其表达, 其机制尚未完全明了, 进一步研究其机制及PAP蛋白的功能将有助于揭示AP的病因, 指导AP患者的早期诊断和预后判断.
近些年的研究发现, 胰腺炎相关蛋白在AP时大量合成、分泌, 而在正常胰腺及胰液中并不存在;并且其与AP的发生、发展密切相关, 故他可作为AP的特异性诊断指标, 用于AP的治疗效果评价和预后判断. 人工合成的生长抑素类似物已广泛用于临床治疗急性胰腺炎多年, 取得了一定的治疗效果, 但对其具体作用机制至今尚未完全阐明, 因此我们研究生长抑素类似物对PAP蛋白水平和基因表达的影响, 探讨生长抑素类似物和PAP之间的关系, 将有助于进一步揭示AP发病机制和指导临床对AP的治疗.
文章有一定的可读, PAP蛋白发现到现在已有20余年, 是否具有临床意义尚难评价, 但考虑国内外相关报道较少, 因此有一定价值.
编辑: 王晓瑜 电编:张敏
| 1. | Bodeker H, Keim V, Fiedler F, Dagorn JC, Iovanna JL. PAP I interacts with itself, PAP II, PAP III, and lithostathine/regIalpha. Mol Cell Biol Res Commun. 1999;2:150-154. [PubMed] |
| 2. | Kiriyama S, Kumada T, Tanikawa M. Recent advances in biochemical diagnosis and assessment of severity in acute pancreatitis. Nippon Rinsho. 2004;62:2035-2039. [PubMed] |
| 3. | Heller A, Fiedler F, Schmeck J, Luck V, Iovanna JL, Koch T. Pancreatitis-associated protein protects the lung from leukocyte-induced injury. Anesthesiology. 1999;91:1408-1414. [PubMed] |
| 4. | Zhang H, Kandil E, Lin YY, Levi G, Zenilman ME. Targeted inhibition of gene expression of pancreatitis-associated proteins exacerbates the severity of acute pancreatitis in rats. Scand J Gastroenterol. 2004;39:870-881. [PubMed] |
| 5. | Wang X, Wang B, Wu J. Pancreatitis-associated protein-I mRNA expression in mouse pancreas is upregulated by lipopolysaccharide independent of cerulein-pancreatitis. J Gastroenterol Hepatol. 2001;16:79-86. [PubMed] |
| 6. | Fiedler F, Croissant N, Rehbein C, Iovanna JL, Dagorn JC, van Ackern K, Keim V. Acute-phase response of the rat pancreas protects against further aggression with severe necrotizing pancreatitis. Crit Care Med. 1998;26:887-894. [PubMed] |
| 7. | Gronborg M, Bunkenborg J, Kristiansen TZ, Jensen ON, Yeo CJ, Hruban RH, Maitra A, Goggins MG, Pandey A. Comprehensive proteomic analysis of human pancreatic juice. J Proteome Res. 2004;3:1042-1055. [PubMed] |
| 8. | Schiesser M, Bimmler D, Frick TW, Graf R. Conformational changes of pancreatitis-associated protein (PAP) activated by trypsin lead to insoluble protein aggregates. Pancreas. 2001;22:186-192. [PubMed] |
| 9. | Suga H, Tsuruta O, Okabe Y, Saitoh F, Noda T, Yoshida H, Ono N, Kinoshita H, Toyonaga A, Sata M. A case of mediastinal pancreatic pseudocyst successfully treated with somatostatin analogue. Kurume Med J. 2005;52:161-164. [PubMed] |
| 10. | Manfredi R, Calza L, Chiodo F. A case-control study of HIV-associated pancreatic abnormalities during HAART era. Focus on emerging risk factors and specific management. Eur J Med Res. 2004;9:537-544. [PubMed] |
| 11. | Takase K, Ueda T, Kuroda Y. New aspects of pharmaco-therapy for acute pancreatitis. Nippon Rinsho. 2004;62:2074-2078. [PubMed] |
| 12. | Yang YM, Tian XD, Zhuang Y, Wang WM, Wan YL, Huang YT. Risk factors of pancreatic leakage after pancreaticoduodenectomy. World J Gastroenterol. 2005;11:2456-2461. [PubMed] |
| 13. | Jung DH, Hwang S, Lee SG. An analysis on the amount of excreted pancreatic juice after pancreato-duodenectomy. Korean J Gastroenterol. 2004;43:309-315. [PubMed] |
| 14. | Rollins MD, Meyers RL. Frey procedure for surgical management of chronic pancreatitis in children. J Pediatr Surg. 2004;39:817-820. [PubMed] |
| 15. | Chebli JM, Gaburri PD, de Souza AF, Ornellas AT, Martins Junior EV, Chebli LA, Felga GE, Pinto JR. Internal pancreatic fistulas: proposal of a management algorithm based on a case series analysis. J Clin Gastroenterol. 2004;38:795-800. [PubMed] |
| 16. | Kohsaki T, Nishimori I, Onishi S. Treatment of acute pancreatitis with protease inhibitor, H2 receptor antagonist and somatostatin analogue. Nippon Rinsho. 2004;62:2057-2062. [PubMed] |
| 17. | 施 新岗, 李 兆申, 贾 一韬, 许 永春, 满 晓华, 龚 燕芳, 屠 振兴, 许 国铭. 大鼠重症急性胰腺炎发病机制中p38丝裂原活化蛋白激酶的作用. 世界华人消化杂志. 2005;13:653-656. [DOI] |
| 20. | Keim V, Rohr G, Stockert HG, Haberich FJ. An additional secretory protein in the rat pancreas. Digestion. 1984;29:242-249. [PubMed] |
| 21. | Iovanna JL, Keim V, Michel R, Dagorn JC. Pancreatic gene expression is altered during acute experimental pancreatitis in the rat. Am J Physiol. 1991;261:G485-489. [PubMed] |
| 22. | Keim V, Willemer S, Iovanna JL, Adler G, Dagorn JC. Rat pancreatitis-associated protein is expressed in relation to severity of experimental pancreatitis. Pancreas. 1994;9:606-612. [PubMed] |
| 23. | Iovanna JL, Keim V, Nordback I, Montalto G, Camarena J, Letoublon C, Levy P, Berthezene P, Dagorn JC. Serum levels of pancreatitis-associated protein as indicators of the course of acute pancreatitis. Multicentric Study Group on Acute Pancreatitis. Gastroenterology. 1994;106:728-734. [PubMed] |
| 25. | Hietaranta A, Mustonen H, Puolakkainen P, Haapiainen R, Kemppainen E. Proinflammatory effects of pancreatic elastase are mediated through TLR4 and NF-kappaB. Biochem Biophys Res Commun. 2004;323:192-196. [PubMed] |