修回日期: 2007-03-15
接受日期: 2007-03-23
在线出版日期: 2007-06-08
目的: 观察扶正利湿解毒法基本方(简称基本方)对肝纤维化的逆转作用.
方法: 采用DMN诱导大鼠肝纤维化, 造模结束后随机分为模型对照组, 秋水仙碱组, 基本方高剂量组, 基本方中剂量组及基本方低剂量组并分组给药, 同时设空白对照组. 灌胃3 wk后检测肝组织Hyp, ALT水平; HE, Masson染色. 采用HSC-T6细胞培养, 药物作用24 h后光镜下观察拍照, 检测药物对细胞的抑制率并在电镜下观察药物浓度为2 g/L时细胞的变化.
结果: 基本方高、中剂量均可使大鼠肝组织Hyp, 血清ALT显著下降(Hyp: 213.73±58.05 μg/g, 245.95±67.70 μg/g vs 317.37±42.06 μg/g, P<0.01, P<0.05; ALT: 33.56±8.16 kU/L, 42.38±14.99 kU/L vs 58±10.32 kU/L, P<0.01, P<0.05); Masson染色肝纤维化分级评分显示, 基本方高, 中剂量均可使肝纤维化程度显著降低(2.33±0.87, 2.63±0.74 vs 3.70±0.67, P<0.01, P<0.01), 同时显著改善肝组织炎症、出血及纤维沉积; 光镜观察及抑制率检测显示基本方呈剂量依赖性抑制HSC-T6细胞增值. 电镜显示基本方主要导致HSC-T6细胞凋亡.
结论: 基本方显示了显著的体内外逆转肝纤维化作用.
引文著录: 何金洋, 符路娣, 邓文娣, 周映云. 扶正利湿解毒法体内外逆转肝纤维化. 世界华人消化杂志 2007; 15(16): 1781-1787
Revised: March 15, 2007
Accepted: March 23, 2007
Published online: June 8, 2007
AIM: To observe the reversing effect on liver fibrosis by the therapy of strengthening healthy qi combined with draining dampness and relieving toxin (SHQDDRT).
METHODS: Rat model of liver fibrosis was induced by dimethylnitrosamine (DMN). All the rats were randomly divided into 6 groups, named group A (control, n = 10), B (model, n = 10), C (colchicine, n = 10), D (with the basic herb complex, high dose, n = 10), E (with the basic herb complex, middle dose, n = 10) and F (with the basic herb complex, low dose, n = 10). The content of liver hydroxyproline and the serum alanine aminotransferase (ALT) were tested. HE and Masson staining were conducted for pathological examination. HSC-T6 cell line was used as an in vitro model. After 24 h of drug administration, the inhibitory effect was observed under an optical microscope. Cell proliferation was detected by MTT assay. Additionally, HSC-T6 cells were observed by electron microscopy after they were treated with the basic herb complex and control drug at the concentration of 2 g/L.
RESULTS: The content of liver hydroxyproline and the serum ALT in group D and E were significantly lower than those in group B (hydroxyproline: 213.73 ± 58.05 μg/g, 245.95 ± 67.70 μg/g vs 317.37 ± 42.06 μg/g, P < 0.01, P < 0.05; ALT: 33.56 ± 8.16 kU/L, 42.38 ± 14.99 kU/L vs 58 ± 10.32 kU/L, P < 0.01, P < 0.05). Masson staining showed that the fibrotic degrees were significantly decreased in group D and E in contrast with those in group B (2.33 ± 0.87, 2.63 ± 0.74 vs 3.70 ± 0.67, both P < 0.01), and the fiber deposition, inflammation and hemorrhage were also improved. Light endoscopy and MTT assay demonstrated that the basic herb complex inhibited the growth of HSC-T6 cells in a dose-dependent manner. Electron microscopy exhibited typical apoptosis features in HSC-T6 cells.
CONCLUSION: The basic herb complex shows significant reversing effect on liver fibrosis in vitro and in vivo.
- Citation: He JY, Fu LD, Deng WD, Zhou YY. In vivo and in vitro study on liver fibrosis reversion effect by therapy of strengthening healthy qi combined with draining dampness and relieving toxin. Shijie Huaren Xiaohua Zazhi 2007; 15(16): 1781-1787
- URL: https://www.wjgnet.com/1009-3079/full/v15/i16/1781.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i16.1781
肝纤维化(liver fibrosis, LF)是肝病进展的中间阶段, 对于LF的治疗可以减少严重肝病及因肝病而死亡的发生, 因此对于LF的研究一直备受重视. 近年的实验研究证实了LF甚至肝硬化(liver cirrhosis, LC)是可以逆转的[1]. 而目前尚未见有疗效确切的能够经得起检验的逆转LF的公认方法. 我们多年运用扶正利湿解毒法治疗慢乙肝(hepatitis B), 观察到坚持运用该法治疗的患者可能具有较好的远期疗效. 推测该治法可能逆转LF, 我们对该法的基本方-扶正利湿解毒复方进行了体内外实验研究, 现予以报道.
SPF级SD大鼠80只,雌雄各半,体质量120-150 g,购于广州中医药大学实验动物中心。饲养于广州中医药大学实验动物中心清洁级动物房,按照中国实验动物学会规定的大鼠喂饲标准进行喂养.
扶正利湿解毒法基本方(以下简称基本方): 主要由白花蛇舌草、丹参、山药、旱莲草等8味药组成, 购于广州采芝林医药连锁店. 购回后以蒸馏水500 mL煎煮2次, 每次烧开后30 min收集药液, 将2次所得药液合并, 浓缩为1 kg/L浓度, 冷藏后尽快使用. 丹参注射液: 江苏神龙制药厂生产. 秋水仙碱(colchicine): Sigma分装, 购自广州威佳科技有限公司. 二甲基亚硝胺(N-Nitrosodimethylamine, DMN): 购自天津化学试剂研究所. 谷丙转氨酶(ALT)、羟脯胺酸(Hyp)检测试剂盒: 购自南京建成生物工程研究所. HSC-T6细胞系由北京佑安医院汪晓军博士惠赠; DMEM高糖培养基、Hepes、MTT、胎牛血清、胰酶、双抗、细胞培养板、细胞培养瓶均购于广州威佳科技公司.
1.2.1 造模及分组给药: 大鼠适应性喂养3 d, 对70只大鼠进行造模, 其余10只为空白对照组. 造模方法为: 用生理盐水配制1:100 (V/V)的DMN稀释溶液, 每周前3 d对大鼠进行腹腔注射, DMN 10 μL/kg体质量; 空白对照组同时腹腔注射生理盐水; 共注射4 wk. 第4周注射结束后随机分为模型对照组、秋水仙碱组、基本方高剂量组、基本方中剂量组及基本方低剂量组; 秋水仙碱组以0.01 mg/kg体质量灌胃, 基本方高、中、低剂量组分别以20, 10, 5 g/kg体质量灌胃; 模型对照组灌胃生理盐水10 mL/kg. 均每天灌胃, 共21 d. 从开始造模到试验结束观察记录动物死亡情况. 实验结束时摘眼球取血收集血清, 观察腹水情况、肝脏肉眼观形态、色泽; 并取左前叶肝脏, 置于bouin固定液中固定.
1.2.2 血清ALT与肝组织Hyp检测: ALT, Hyp检测分别严格按照试剂盒操作说明书进行操作.
1.2.3 病理检查: 固定36 h后立即取出选块、石蜡包埋、切片5 μm, 然后行苏木素-伊红(HE)染色、Masson染色, 光镜下观察并拍照[2]. 纤维化程度评价用评分方法, 具体分级方法如下: 0分, 无纤维化; 1分, 轻度纤维化, 纤维沉积仅位于小叶中央; 2分, 中度纤维化, 纤维沉积扩展至小叶中央之外, 但仍未至小叶边缘; 3分, 严重肝纤维化, 纤维沉积扩展至小叶边缘; 4分, 肝硬化.
1.2.4 体外实验方法: 细胞复苏、传代与冻存采用常规方法操作. 将已传至第三代的且已长满培养瓶的HSC-T6细胞用2.5 g/L的胰酶消化, 调细胞浓度至2×108/L, 铺于96孔板, 24 h后上药. 基本方从10 g/L起始, 5倍稀释, 共7个浓度, 即分别为10, 2, 0.4, 0.08, 0.016, 0.0032, 0.00064 g/L. 丹参注射液以原液稀释的10, 100, 1000倍共3个浓度进行上药.
根据相关文献[3]常规操作进行MTT检测, 测得的各复孔A值取平均数. 按文献方法[4], 计算出药物对细胞增殖的抑制率IE. 公式如下: IE = 1-Ai/A0注: IE(inhibitory effect)表示药物对细胞增殖的抑制率, Ai表示某药物浓度下的吸光度值, A0表示对照组细胞的吸光度值.
细胞用6 cm方瓶培养, 分为丹参、基本方及正常对照共3瓶, 按前述传代上药, 上药浓度为基本方与丹参均为2 g/L, 正常对照不上药. 作用24 h后用2.5 g/L胰酶消化细胞, 离心用戊二醛固定后, 包埋制超薄切片, 电镜观察拍照.
2.1.1 大鼠死亡、腹水及肝脏肉眼观情况: 造模第1周死亡2只, 第2周未见死亡, 第3周注射完毕后开始有大鼠批量死亡, 至第4周造模结束时造模大鼠共死亡14只, 仍有56只存活, 分组给药时模型组12只, 秋水仙碱组、基本方高、中、低剂量组均为11只. 在给药期间仍陆续有大鼠死亡, 至给药结束采集标本时模型组为10只, 秋水仙碱组为8只, 基本方高剂量组为9只, 中剂量组为8只, 低剂量组为6只.
取肝脏时见模型对照组8只有大量腹水, 均为血性, 另2只少量腹水; 秋水仙碱组2只有腹水, 其余6只未见腹水; 基本方高剂量组1只见少量腹水; 基本方中剂量组4只见中等量腹水; 基本方低剂量组4只有腹水; 其余未见腹水; 空白对照组未见腹水, 肝脏表面平滑, 浅黄色, 边缘锐利, 无肿大、缩小.
2.1.2 基本方对血清ALT水平、肝组织Hyp含量的影响: 模型对照组及各给药组血清ALT水平均升高, 与空白对照组比较, 有非常显著性差异(均P<0.01); 基本方高、中剂量组血清ALT水平显著降低, 与模型对照组比较有显著性差异(分别为P<0.01, P<0.05); 秋水仙碱组血清ALT水平也显著降低, 与模型对照组比较有显著性差异(P<0.05); 而基本方低剂量组血清ALT水平均数也有降低, 但与模型对照组比较无显著意义(P>0.05). 说明基本方高、中剂量均对该LF模型血清ALT水平有显著降低作用(表1).
模型对照组及各给药组肝组织Hyp水平均升高, 与空白对照组比较, 有显著性差异(均P<0.01); 秋水仙碱组与模型对照组比较, Hyp含量显著降低(P<0.01); 基本方高、中剂量组与模型对照组比较, Hyp含量均显著降低(分别为P<0.01, P<0.05), 说明基本方高、中剂量组均可使纤维化大鼠的肝组织Hyp含量明显下降, 而高剂量优于中剂量(表1).
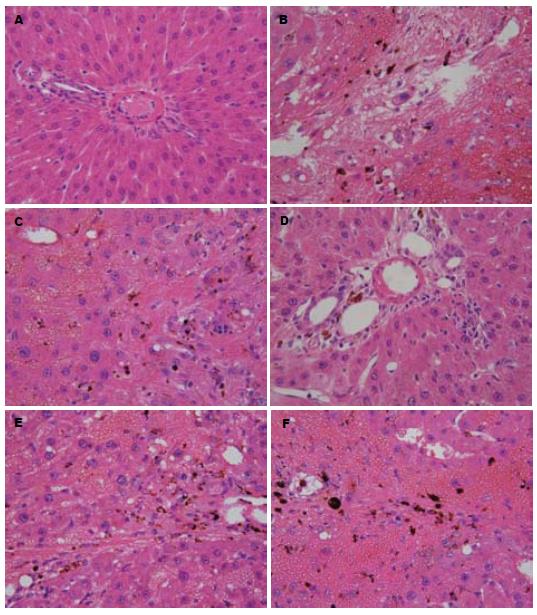
2.1.3 各组肝组织病理检查结果: 空白对照组大鼠肝组织肝小叶排列整齐, 各大鼠均未见明显异常(图1A); 模型对照组所有标本汇管区大量纤维沉积, 有8个样本形成假小叶; 肝细胞排列紊乱, 所有标本均有脂肪沉积, 汇管区大片炎细胞浸润, 肝组织大片出血灶(图1B); 秋水仙碱组所有标本汇管区大量纤维沉积, 有5个样本形成假小叶; 肝细胞排列紊乱, 4个标本肝细胞有脂肪沉积, 汇管区大片炎细胞浸润(图1C); 基本方高剂量组中有2个标本大量纤维沉积于汇管区, 其中1个形成假小叶, 大部分肝细胞排列整齐, 所有标本均有少量炎细胞浸润(图1D); 基本方中剂量组所有标本均有大量汇管区纤维沉积, 有6个标本形成假小叶, 肝细胞排列紊乱, 有3个标本肝细胞中有脂滴沉积, 汇管区大片炎细胞浸润; 肝组织大片出血灶(图1E); 基本方低剂量组所有标本均有大量汇管区纤维沉积, 有5个标本形成假小叶, 肝细胞排列紊乱, 有3个标本肝细胞中有脂滴沉积, 汇管区大片炎细胞浸润; 肝组织大片出血灶(图1F).
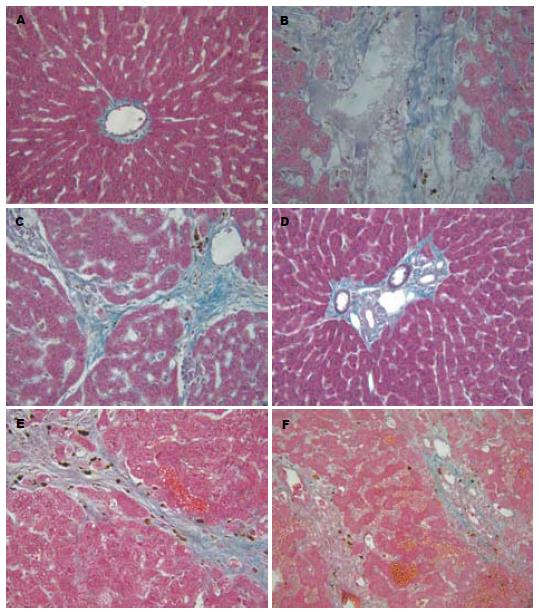
Masson染色所见与HE染色中纤维化基本一致, 纤维沉积基本为胶原纤维, 显色为淡绿色(图2).纤维化程度分级定量(表2).
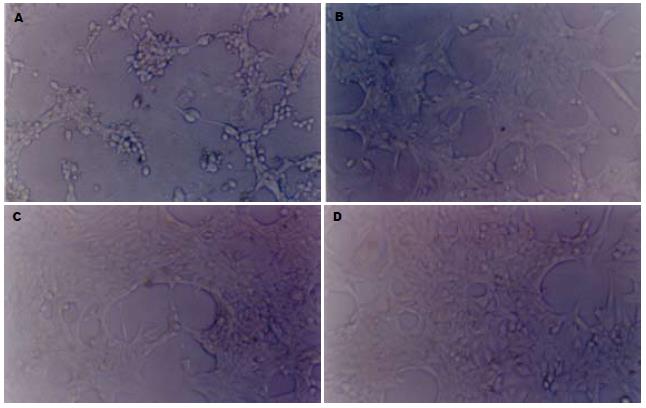
2.2.1 上药24 h后各药物浓度光镜下观察: 上药24 h后, 基本方10 g/L剂量组细胞与对照组细胞相比, 数量明显稀少, 大部分细胞伪足收缩, 不呈星状. 2 g/L剂量组细胞较10 g/L剂量组数量明显增多, 外形正常的星状细胞明显增多, 但与对照组细胞比较数量仍明显减少, 外形仍有较多未呈星状, 0.4 g/L剂量组又较2 g/L剂量组细胞致密, 外形更为接近正常星状, 但与对照组细胞比较仍然能看出数量及形态差别, 0.08 g/L剂量组细胞在数量与外形上均看不出与对照组细胞有明显区别(图3), 这些说明从光镜下观察细胞数量及形态可以看出, 基本方从10 g/L浓度5倍稀释至0.08 g/L浓度, 对HSC-T6细胞生长呈梯度抑制, 说明基本方对HSC-T6生长有明显抑制作用, 且呈现剂量依赖型.
2.2.2 MTT检测结果: 基本方在0.016 g/L以上浓度时均对HSC-T6具有抑制作用, 随着药物浓度的增大, 其对HSC-T6增殖的抑制作用逐渐增强, 有明显的量效关系(表3).
| 项目 | 10 | 2 | 0.4 | 0.08 | 0.016 | 0.0032 | 0.00064 | 对照 |
| A | 0.433 | 0.634 0.721 | 1.036 | 1.120 | 1.136 | 1.156 | 1.13 | |
| IE(%) | 62 | 44 | 36 | 8.3 | 1 | -0.6 | -2.6 | - |
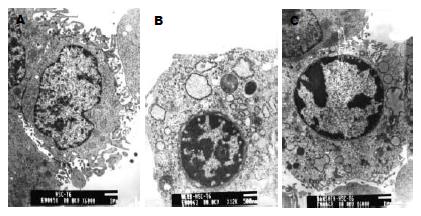
2.2.3 电镜观察结果: 丹参和基本方作用于HSC-T6细胞24 h后均可使HSC-T6细胞大量凋亡, 丹参组细胞凋亡的特点是凋亡细胞的数量明显多于复方组, 其凋亡细胞形态变小, 核染色体堆积, 线粒体、内质网等细胞器明显减少, 代之以大量空泡. 基本方组大量细胞形态明显缩小, 出现大批双核细胞, 此点明显不同于丹参组, 细胞质中线粒体、内质网等细胞器明显减少, 也出现大量空泡. 而且大量还未成熟的细胞已开始显现凋亡特征, 这点也与丹参组明显不同(图4).
LF是一个病理过程, 中医大多从湿、热、毒、瘀、虚来解释其病理机制[5], 目前治疗LF大多以活血化瘀为基础, 配合扶正, 取得一定疗效[6-9]. 而实际情况是LF大多有湿热毒邪的存在[10-11], 或十分明显, 或潜伏不显, 从现代医学角度讲, 大多是HBV慢性感染者[12]. 而目前用于治疗LF的中药大都不具有解毒祛湿功效. 不能祛除湿热毒邪, LF病理机制就不能去除; 因此只有兼顾解毒祛湿清热, 才可能使LF彻底逆转和恢复.
扶正利湿解毒法正好符合上述理念, 而且基本方是在具有确切抑制HBV和保护免疫性肝损伤效果的"复方肝毒清"的基础上组方而成[13-14], 因此其具有确切的解毒祛湿清热功效, 再辅以扶正和活血化瘀, 使基本方能够针对LF的整体病机, 因此具有较好的逆转LF的作用.
DMN导致的大鼠LF具有停用DMN后不自发逆转的特点[15-16], 因此用此模型可以观察药物是否能够逆转LF[17-19]. 而实验显示, 基本方高、中剂量组均可使血清ALT水平和肝组织Hyp含量下降, 其中基本方高剂量组效果较好, 肝组织病理切片也证明了这一点, 病理染色切片分级评分显示, 基本方高、中剂量组均能显著改善LF大鼠的肝组织病理改变, 综合HE染色观察结果, 表明基本方具有改善肝组织出血、炎症, 减轻LF作用. 从基本方高、中剂量组病理切片及ALT水平、Hyp含量来看, 基本方高、中剂量组具有确切的逆转LF效果.
近年来临床何实验研究都证实了LF可以逆转以及肝星状细胞在LF逆转中的核心作用[20-27], 因此我们采用HSC-T6细胞作为体外模型, 结果表明, 基本方在0.016 g/L以上浓度时均对HSC-T6具有抑制作用, 电镜观察发现, 基本方抑制HSC-T6细胞的机制主要是导致HSC-T6细胞凋亡, 这点与对照组的丹参类似但又有显著不同, 基本方作用后大量细胞形态变小, 但只有较少细胞出现染色体堆积现象, 大部分细胞尚未明显出现染色体堆积现象, 而是出现大量双核细胞, 而且尚未成熟的幼稚细胞即已开始凋亡, 说明一方面可能基本方能够刺激HSC-T6的生长, 而另一方面能够在其生长的初期即可导致其凋亡; 而丹参则不是这样, 因此基本方导致HSC-T6凋亡的分子机制可能不同于丹参, 值得进一步研究.
肝纤维化是所有慢性肝病进展到肝硬化的必经阶段, 肝纤维化的逆转将大大降低因肝病导致的死亡率.
近年来研究表明了肝纤维化可以逆转, 但到目前为止还未找到确切地逆转肝纤维化的方法.
目前对于肝纤维化的逆转的研究主要集中在机制方面. 在药物逆转效果方面只有个别报道. 例如有研究报道"扶正化瘀方"有促进CCl4实验性肝纤维化逆转的作用.
本研究首次提出了中医理论去除湿热毒邪在肝纤维化逆转中的重要性. 采用DMN致大鼠肝纤维化模型, 在造模结束后给药, 突出了逆转肝纤维化的特点. 且本研究在体外细胞培养中采用电镜、光镜、MTT等多种方法进行检测, 使基本方逆转肝纤维化的效果及机制更加客观.
本文表明了扶正利湿解毒法具有逆转实验性肝纤维化的作用, 为临床肝纤维化治疗用药提出指导意见.
抑制率(IE): 药物对细胞增值的抑制率, 一般是用MTT法检测吸光度A, 以药物作用的细胞孔的A值与无药物作用的细胞孔A值进行比较, 1减去此比值.
该论文研究内容丰富, 从体内外实验观察了扶正利湿解毒法逆转肝纤维化的作用, 有一定的可读性和理论价值.
编辑: 张焕兰 电编:何基才
| 1. | Elsharkawy AM, Oakley F, Mann DA. The role and regulation of hepatic stellate cell apoptosis in reversal of liver fibrosis. Apoptosis. 2005;10:927-939. [PubMed] |
| 2. | Brunt EM. Grading and staging the histopathological lesions of chronic hepatitis: the Knodell histology activity index and beyond. Hepatology. 2000;31:241-246. [PubMed] |
| 3. | Denizot F, Lang R. Rapid colorimetric assay for cell growth and survival. Modifications to the tetrazolium dye procedure giving improved sensitivity and reliability. J Immunol Methods. 1986;89:271-277. [PubMed] |
| 6. | 王 继, 陈 俊红, 李 兵顺. 活血、益气、软坚不同中医治则逆转大鼠肝纤维化的实验观察. 中国中医基础医学杂志. 2006;12:420-422. |
| 8. | Liu P, Liu C, Xu LM, Hu YY, Xue HM, Liu CH, Zhang ZQ. Effects of Fuzheng Huayu 319 recipe on liver fibrosis in chronic hepatitis B. World J Gastroenterol. 1998;4:348-353. [PubMed] |
| 15. | Jenkins SA, Grandison A, Baxter JN, Day DW, Taylor I, Shields R. A dimethylnitrosamine-induced model of cirrhosis and portal hypertension in the rat. J Hepatol. 1985;1:489-499. [PubMed] |
| 16. | He JY, Ge WH, Chen Y. Iron deposition and fat accumulation in dimethylnitrosamine-induced rat liver fibrosis. World J Gastroenterol. 2007;13:2061-2065. [PubMed] |
| 17. | Yen MH, Weng TC, Liu SY, Chai CY, Lin CC. The hepatoprotective effect of Bupleurum kaoi, an endemic plant to Taiwan, against dimethylnitrosamine-induced hepatic fibrosis in rats. Biol Pharm Bull. 2005;28:442-448. [PubMed] |
| 18. | Sakaida I, Hironaka K, Terai S, Okita K. Gadolinium chloride reverses dimethylnitrosamine (DMN)-induced rat liver fibrosis with increased matrix metalloproteinases (MMPs) of Kupffer cells. Life Sci. 2003;72:943-959. [PubMed] |
| 19. | Hu QW, Liu GT. Effects of bicyclol on dimethylnitrosamine-induced liver fibrosis in mice and its mechanism of action. Life Sci. 2006;79:606-612. [PubMed] |
| 20. | Dufour JF, DeLellis R, Kaplan MM. Reversibility of hepatic fibrosis in autoimmune hepatitis. Ann Intern Med. 1997;127:981-985. [PubMed] |
| 21. | Wanless IR. Use of corticosteroid therapy in autoimmune hepatitis resulting in the resolution of cirrhosis. J Clin Gastroenterol. 2001;32:371-372. [PubMed] |
| 22. | Kaplan MM, DeLellis RA, Wolfe HJ. Sustained biochemical and histologic remission of primary biliary cirrhosis in response to medical treatment. Ann Intern Med. 1997;126:682-688. [PubMed] |
| 23. | Kweon YO, Goodman ZD, Dienstag JL, Schiff ER, Brown NA, Burchardt E, Schoonhoven R, Brenner DA, Fried MW. Decreasing fibrogenesis: an immunohistochemical study of paired liver biopsies following lamivudine therapy for chronic hepatitis B. J Hepatol. 2001;35:749-755. [PubMed] |
| 24. | Hammel P, Couvelard A, O'Toole D, Ratouis A, Sauvanet A, Flejou JF, Degott C, Belghiti J, Bernades P, Valla D. Regression of liver fibrosis after biliary drainage in patients with chronic pancreatitis and stenosis of the common bile duct. N Engl J Med. 2001;344:418-423. [PubMed] |
| 25. | Yang F, Yang XP, Liu YH, Xu J, Cingolani O, Rhaleb NE, Carretero OA. Ac-SDKP reverses inflammation and fibrosis in rats with heart failure after myocardial infarction. Hypertension. 2004;43:229-236. [PubMed] |