修回日期: 2007-03-20
接受日期: 2007-03-31
在线出版日期: 2007-05-28
目的: 分别使用碘克沙醇和Ficoll-400密度梯度液纯化大鼠胰岛细胞, 比较两者分离纯化大鼠胰岛细胞的收获量、纯度、活性和功能.
方法: 将20只SD大鼠随机分为碘克沙醇纯化组和Ficoll-400纯化组, 以胶原酶P消化分离SD大鼠胰腺, 分别采用碘克沙醇及Ficoll-400密度梯度液来纯化胰岛细胞. 通过DTZ染色, 计数胰岛细胞的数量和纯度, 用胰岛素释放试验和胰岛移植评估胰岛细胞的功能.
结果: 碘克沙醇-HCA液纯化组的胰岛细胞收获量及纯度与Ficoll-HCA无明显差别, 碘克沙醇-HCA组纯化的胰岛细胞活率则显著高于Ficoll-HCA组(93.3%±3.5% vs 84.8%±3.8%, P<0.01), 同时胰岛细胞逆转糖尿病大鼠高血糖状态的时间显著延长(11.4±2.1 d vs 7.0±1.6 d, P<0.05).
结论: 与Ficoll-400相比, 使用碘克沙醇纯化大鼠胰岛可提高胰岛细胞的活率及功能.
引文著录: 张桦, 陈宏, 张振, 杨力, 孙嘉, 李明, 刘宏, 蔡德鸿. 碘克沙醇及Ficoll-400分离纯化大鼠胰岛细胞的效果对比. 世界华人消化杂志 2007; 15(15): 1759-1762
Revised: March 20, 2007
Accepted: March 31, 2007
Published online: May 28, 2007
AIM: To compare the yield, purity, quality and function of rat islets after purification by iodixanol or Ficoll-400 density gradient method.
METHODS: Twenty Sprague Dawley rats were randomly divided into iodixanol and Ficoll group according to the corresponding purification methods. Rat pancreas was isolated by collagenase P digestion, and the rat islets of two groups were purified by iodixanol or Ficoll-400 density gradient method. After isolation, the islet yield and purity were evaluated by DTZ staining and the islet function was assessed by insulin release assays in vitro and islet allotransplantation in vivo.
RESULTS: There were no marked differences in the yield and purity of islets between both groups. The survival rate of islets in iodixanol group was significantly higher than that in Ficoll group (93.3% ± 3.5% vs 84.8% ± 3.8%, P < 0.01), and the time of hyperglycemia reversal in diabetic rat was also longer (11.4 ± 2.1 d vs 7.0 ± 1.6 d, P < 0.05).
CONCLUSION: Iodixanol density gradient method is superior to Ficoll-400 method in improving the quality and function of purified rat islets.
- Citation: Zhang H, Chen H, Zhang Z, Yang L, Sun J, Li M, Liu H, Cai DH. Efficacy comparison of rat islet purification between iodixanol and Ficoll density gradient method. Shijie Huaren Xiaohua Zazhi 2007; 15(15): 1759-1762
- URL: https://www.wjgnet.com/1009-3079/full/v15/i15/1759.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i15.1759
能否获取到足够的具有生物活性的胰岛细胞是影响胰岛细胞移植成功与否的主要原因之一, 而目前胰岛纯化常用的高渗性Ficoll-400密度梯度介质对大鼠胰岛细胞的活性存在着不良影响, 我们对新型无内毒素的等渗性密度梯度分离液-碘克沙醇密度梯度液与Ficoll-400密度梯度液分离纯化大鼠胰岛细胞的效果进行了对比研究, 现报告如下.
♂SD大鼠, 体质量200-250 g, 由南方医科大学动物实验中心提供, 胶原酶P溶液(Roche公司), 碘克沙醇工作液 (EZ-SepTM, 达科为公司产品), HCA液(上海长征医院产品), RMPI1640培养液(Gibco公司), 新生小牛血清(杭州四季青公司), 冷冻离心机(上海安亭), 电子密度计(梅特勒公司). 20只SD大鼠随机均分为2组: 碘克沙醇组及Ficoll-400组; 两组分别使用碘克沙醇-HCA或Ficoll-400-HCA作为密度梯度液来分离纯化胰岛细胞.
1.2.1 胰岛细胞的分离纯化: SD大鼠通过戊巴比妥钠[按30 mg/(kg·w)]腹腔内注射麻醉, 取腹壁正中切口打开腹腔, 将4℃ 0.5 g/L的胶原酶P溶液(Roche公司)约8-10 mL缓慢经胆总管逆行注入胰管内, 使胰腺充分膨胀, 迅速摘取完整胰腺, 置入预温至带有小玻璃珠的38℃ Hanks液小瓶中, 在38℃水浴锅中静止消化约10-12 min后, 轻柔振荡1-2 min或以玻璃吸管轻柔吹打胰腺使胰腺组织均匀分散呈泥沙状, 将胰腺消化物悬液以40目不锈钢筛网过滤以去除淋巴结、导管及血管等组织, 然后迅速加入装有40 mL 4℃含200 mL/L小牛血清的RMPI1640培养液(Gibco公司)的离心管中, 低速(800 r/min)离心洗涤2次.
1.2.2 胰腺消化物的孵育: 将上述所得之胰腺消化物按1∶3比例加入4℃含200 mL/L小牛血清的HCA器官保存液混匀, 取样分别行双硫腙(DTZ)及碘化丙啶/亚啶橙(PI/AO)染色计算纯化前胰岛细胞团的产量及活率. 将胰腺组织孵育液置0-4℃冰浴中孵育10 min. 每隔2 min对孵育液进行轻微振荡以免胰腺消化物黏结.
1.2.3 胰岛纯化: (1)碘克沙醇组: 参考van der Burg et al[1]及Delle et al[2]的方法结合本室的推进式离心管离心法加以改良, 将10 mL孵育好的胰腺消化物悬液离心去上清后与5 mL碘克沙醇工作液[EZ-SepTM, 自行用电子密度计以HCA液(上海长征医院产品)调整其密度为1075 g/L, 渗透压280±15 mOsm/L, 达科为公司产品]充分混匀后加入含1090 g/L碘克沙醇-HCA液10 mL的推进式离心管中, 置4℃立式冷冻离心机, 设置离心力为500 g, 离心5 min; 收集两层密度梯度液之间悬浮的细胞层; (2)Ficoll-400组: 将10 mL孵育好的胰腺消化物悬液离心去上清后, 与5 mL 200 g/L的Ficoll-400-HCA液(Sigma)充分混匀后, 加入含10 mL 250 g/L Ficoll-400-HCA密度梯度液的推进式离心管中, 置4℃立式冷冻离心机500 g, 离心5 min; 用活塞推出20%与25%层面交界部位的细胞层; 两组收集的细胞均以4℃含100 mL/L小牛血清的RMPI1640培养液1200 r/min离心洗涤2遍, 纯化胰岛细胞取样鉴定.
1.2.4 胰岛细胞鉴定: 收集纯化胰岛细胞, 取样行DTZ染色后解剖镜下计数并观察纯化后胰岛细胞团的形态, 计算得率[胰岛细胞团数量以胰岛细胞当量来计算(IEQ)]及纯度(纯度 = DTZ染色阳性的胰岛个数/细胞团总数).
1.2.5 纯化后胰岛细胞的活力测定: 将胰岛制备物与碘化丙啶/亚啶橙储备液混合10 min, 在荧光显微镜下用490 nm激发光滤光片, 510 nm光栅滤光片观察. 胰岛活细胞发出绿色荧光, 死细胞发出红色荧光. 胰岛细胞活率用胰岛活细胞占所有胰岛细胞总数的百分比表示.
1.2.6 胰岛分泌功能的测定: 分别从两组手工挑取50个直径在150-200 μm之间的胰岛细胞, 加入含100 mL/L胎牛血清、10 mmol/L HEPES、3.3 mmol/L葡萄糖的RMPI1640培养液2 mL中, 置于34℃, 50 mL/L CO2的培养箱中6 h, 留取上清液标本后, 弃去所有上清液; 再加入2 mL含16.7 mmol/L葡萄糖的RMPI1640培养液, 继续培养6 h, 分别检测两者培养液上清的胰岛素含量, 胰岛素测定采用间接放射免疫法(放射免疫测量药盒大鼠胰岛素放免试剂盒, 美国Linco公司).
1.2.7 大鼠糖尿病模型的制备: 随机选取Wistar大鼠, 分笼饲养, 禁食过夜, 测定空腹血糖. 用柠檬酸缓冲液(pH 4.2-4.6)配制10 g/L的链脲佐菌素(STZ), 由阴茎背静脉注入[按60 mg/(kg·w)]. 连续观察空腹血糖变化, 血糖浓度每3 d测定1次, 连续两次高于16.8 mmol/L者定为糖尿病模型.
1.2.8 大鼠胰岛细胞移植: 与供体胰岛相对应将Wistar糖尿病成模大鼠随机分为碘克沙醇组和Ficoll-400组以及对照组, 每组5只, 在碘克沙醇组和Ficoll-400组的糖尿病成模大鼠的双侧肾包囊中植入纯化后的SD大鼠胰岛细胞团1000个IEQ, 对照组糖尿病大鼠肾包囊内注射1 mL Hanks液. 移植后每隔1 d测血糖、尿糖1次, 非空腹血糖连续低于11.2 mmol/L及尿糖阴性, 作为移植物功能存活的标准; 否则作为移植物受排斥、功能丧失的指标.
统计学处理 应用SPSS10.0软件进行统计分析, 数据以mean±SD表示, 具体统计方法采用配对t检验(Paired-Samples t Test)方法.
经分离、纯化后的胰岛细胞被DTZ染成猩红色, 而外分泌腺组织不着色. 胰岛细胞纯度在镜下用胰岛细胞数量与外分泌组织量的百分比来估计. 两组胰岛细胞纯化后的收获量、纯度及活率鉴定(表1).
碘克沙醇与Ficoll-400纯化后的SD大鼠胰岛细胞对胰岛素释放刺激反应良好, 高糖(16.7 mmol/L)时与低糖(3.3 mmol/L)时胰岛素的释放量比较有显著差异(P<0.001), 提示纯化后胰岛β细胞功能良好. 但2组间葡萄糖刺激胰岛素的分泌量有显著性差异(P<0.05), 提示碘克沙醇纯化后的胰岛细胞具有更好的功能(表2).
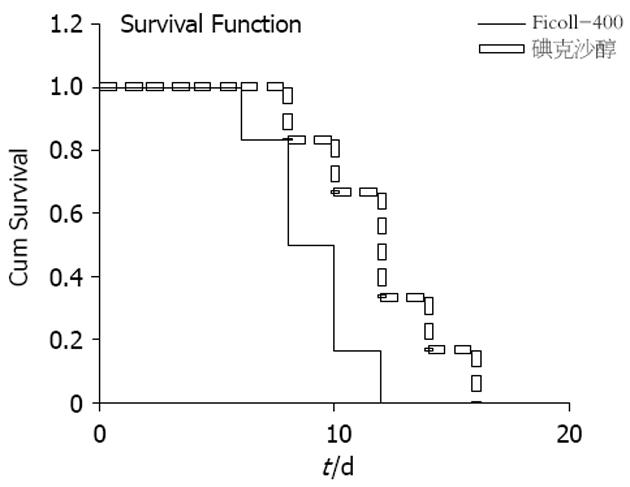
两组糖尿病Wistar大鼠接受胰岛移植第2天, 血糖、尿糖均可迅速下降至正常, 碘克沙醇组平均维持11.4±2.1 d; Ficoll组平均维持7.0±1.6 d; 两组相比有显著性差异(t = 3.23, P<0.05). 对照组血糖、尿糖均无显著性改变, 提示经碘克沙醇纯化后的胰岛细胞具有更好的活力和功能. 胰岛细胞移植后生存曲线图(图1).
碘克沙醇其化学名为: 5, 5'-[(2-羟基-1, 3-丙二基)-双(乙酰基氨基)]-双(N, N'-双(2, 3-二羟基丙基)-2, 4, 6-三碘-1, 3-苯二甲酰胺), 是一种无色至淡黄色澄明水溶液. 碘克沙醇是一非离子型、双体、六碘、水溶性的X线造影剂, 是目前临床上较为普遍使用的等渗性造影剂, 具有极低内毒素、对细胞损伤少、等渗透压、配制密度范围较大等优点[3-4], 国外已初步成功使用该试剂进行人胰岛细胞的分离纯化, 并被认为是单供体胰腺胰岛移植成功的重要条件之一[5-7]. 目前国内大部分胰岛分离实验室均采用高渗的Ficoll-400(渗透压约为400 mOsm/L)作为密度分离介质来纯化胰岛细胞[8-9], 但是在繁琐的分离纯化过程中, 胰岛细胞与高渗性的Ficoll-400分离液长时间混匀后, 胰岛细胞功能必然会受高渗环境的不良影响, 此外Ficoll-400本身的生产亦不具备GMP标准, 其中含有一定的有毒物质如较高浓度的内毒素对细胞功能具有较大的不良影响, 因此其并不适用于临床人胰岛移植实验. 我们在结合既往长期胰岛分离的工作基础上, 成功的使用新型无毒等渗的碘克沙醇-HCA密度梯度液获取了高活性的大鼠胰岛细胞, 其纯化的胰岛细胞在接受低糖及高糖刺激后胰岛素的分泌量均显著高于传统Ficoll-400密度梯度液纯化组, 接受碘克沙醇纯化组胰岛细胞的糖尿病大鼠模型的正常血糖维持时间亦显著高于Ficoll纯化组及对照组, 上述及国外的研究结果[10-12]均明确提示, 使用碘克沙醇密度梯度介质可以获取更高生物活性的胰岛细胞, 尤其适合将其用于人胰岛细胞的分离纯化过程, 以降低临床移植风险同时提高临床人胰岛细胞移植的成功率.
此外, 我们改进了将消化后的胰岛组织悬液和最高密度梯度液混合后再加载其他低密度梯度介质的传统方法, 转而使用较低的密度梯度介质(1.075 g/L)与胰岛细胞悬液预先混匀, 然后再将其加载在已经预先放置在推进式离心管内的适合的密度梯度液(密度1.090 g/L)上, 实验结果表明, 使用两种密度梯度介质的实验中均可获得满意的分离、纯化效果. 该方法要点如下: (1)试验前预先将使用电子密度计校正后的单一的密度梯度预先加入灭菌离心管内, 密封后冷藏; (2)胰腺消化物与较低密度的密度梯度液混匀后, 由于密度梯度液具有一定的黏度和密度, 胰腺消化物与其充分混匀后不会很快沉淀到底部, 而是较均匀的悬浮在密度梯度液中, 反而避免了细胞之间互相黏连对其密度的影响, 使得各类细胞在不同的时间通过密度梯度界面, 增加了胰岛细胞的最终收获量, 这与国内黄跃南 et al[13]采用的方法及国外连续密度梯度纯化法[3]中将胰腺细胞消化物悬液加载于密度梯度液之上, 使其在离心力的作用下逐级按密度分离开来具有相似的原理; (3)采用自制的推进式离心管极大地方便了密度梯度介质和细胞悬液的加载及出样, 缩短了纯化时间, 减少了胰岛细胞的冷缺血时间, 改善了胰岛细胞的生理功能, 同时收集纯化胰岛细胞的过程可以做到迅速及几乎无菌, 有利于进行下一步的胰岛实验研究.
总之, 我们在国内初步成功建立了使用新型碘克沙醇密度梯度液纯化大鼠胰岛细胞的技术方法, 为今后进一步在临床人及大动物胰岛细胞分离纯化过程打下了基础.
目前国内胰岛分离实验室均采用Ficoll-400作为密度分离介质来纯化人及动物的胰岛细胞, 但是高渗的Ficoll含有较高含量的内毒素可能显著加速影响胰岛细胞的生物活性. 而碘克沙醇是一种临床常用的非离子型等渗性造影剂, 具有极低内毒素、对细胞损伤少、等渗透压、配制密度范围较大等优点, 被认为是单供体人胰岛移植成功的重要条件之一. 国内对碘克沙醇的使用则多集中在外周血细胞分离领域, 用于胰岛分离尚未见报道, 本研究主要目的是利用国内现有的试剂及实验条件, 为今后获取更高生物活性的胰岛细胞团建立全新的技术方法.
成功胰岛移植的关键是胰岛的分离和纯化技术, 本研究探讨不同分离方法的效果, 有一定实用价值.
电编: 张敏 编辑:王晓瑜
| 1. | van der Burg MP, Graham JM. Iodixanol density gradient preparation in university of wisconsin solution for porcine islet purification. ScientificWorldJournal. 2003;3:1154-1159. [PubMed] [DOI] |
| 2. | Delle H, Saito MH, Yoshimoto PM, Noronha IL. The use of iodixanol for the purification of rat pancreatic islets. Transplant Proc. 2007;39:467-469. [PubMed] [DOI] |
| 3. | 王 利新, 景 在平, 包 俊敏, 赵 志青, 冯 翔, 赵 珺. 等渗造影剂碘克沙醇对腹主动脉瘤腔内隔绝术患者肾功能的影响(附21例分析). 中国现代普通外科进展. 2004;7:300-302. |
| 4. | 王 利新, 景 在平, 包 俊敏, 赵 志青, 曲 乐丰, 赵 珺, 黄 晟, 陆 清声, 梅 志军, 汤 敬东. 等渗造影剂(碘克沙醇)在介入微创治疗中对患者肾功能的影响(附59例分析). 上海医学. 2005;28:840-842. |
| 5. | Shapiro AM, Ricordi C. Unraveling the secrets of single donor success in islet transplantation. Am J Transplant. 2004;4:295-298. [PubMed] [DOI] |
| 6. | Briones RM, Miranda JM, Mellado-Gil JM, Castro MJ, Gonzalez-Molina M, Cuesta-Munoz AL, Alonso A, Frutos MA. Differential analysis of donor characteristics for pancreas and islet transplantation. Transplant Proc. 2006;38:2579-2581. [PubMed] [DOI] |
| 7. | Zeng Y, Torre MA, Karrison T, Thistlethwaite JR. The correlation between donor characteristics and the success of human islet isolation. Transplantation. 1994;57:954-958. [PubMed] [DOI] |
| 10. | Matsumoto S, Tanaka K. Pancreatic islet cell transplantation using non-heart-beating donors (NHBDs). J Hepatobiliary Pancreat Surg. 2005;12:227-230. [PubMed] [DOI] |
| 11. | Markmann JF, Deng S, Desai NM, Huang X, Velidedeoglu E, Frank A, Liu C, Brayman KL, Lian MM, Wolf B. The use of non-heart-beating donors for isolated pancreatic islet transplantation. Transplantation. 2003;75:1423-1429. [PubMed] [DOI] |
| 12. | Nano R, Clissi B, Melzi R, Calori G, Maffi P, Anto-nioli B, Marzorati S, Aldrighetti L, Freschi M, Grochowiecki T. Islet isolation for allotrans-plantation: variables associated with successful islet yield and graft function. Diabetologia. 2005;48:906-912. [PubMed] [DOI] |