修回日期: 2007-03-15
接受日期: 2007-04-02
在线出版日期: 2007-05-28
目的: 研究RECK, MMP-9和TGF-β1在胃癌及正常胃组织中的表达, 探讨其在胃癌的发生、发展、浸润和转移中的作用.
方法: 选择临床及病理资料齐全的存档胃腺癌蜡块标本54例, 另取正常胃黏膜标本15例作对照. 采用第二代通用型二步法监测系统(PV-9000)免疫组化方法检测RECK, MMP-9及TGF-β1在胃癌及正常胃组织中的表达.
结果: RECK在胃癌组织中低表达(51.9%), 并随肿瘤浸润深度的加深、淋巴转移的产生、远隔转移的发生、临床分期的提高、肿瘤病理分化程度的降低而降低(P<0.05). MMP-9在胃癌组织中高表达(75.9%), 并随肿瘤浸润深度的加深、淋巴转移的产生、临床分期的提高、肿瘤病理分化程度的降低而增高(P<0.05). TGF-β1在胃癌组织中高表达(77.8%), 并随淋巴转移的产生、临床分期的提高、肿瘤病理分化程度的降低而增高(P<0.05). 胃癌组织中RECK与MMP-9、TGF-β1的表达呈负相关(r = -0.618, P<0.001; r = -0.620, P<0.001), MMP-9与TGF-β1的表达呈正相关(r = 0.716, P<0.001).
结论: 胃癌组织中RECK低表达, MMP-9, TGF-β1高表达. RECK, MMP-9及TGF-β1可以作为评估胃癌发生浸润转移的重要指标.
引文著录: 宋国庆, 王强. RECK, MMP-9及TGF-β1在胃癌组织中的表达及其相互关系. 世界华人消化杂志 2007; 15(15): 1731-1737
Revised: March 15, 2007
Accepted: April 2, 2007
Published online: May 28, 2007
AIM: To study the expression of RECK (reversion-inducing-cysteine-rich protein with Kazal motifs), MMP-9 (matrix metalloproteinase-9), and TGF-β1 (transforming growth factor-β1) as well as their correlations in gastric cancer, and to investigate their roles in the carcinogenesis and and development.
METHODS: PV-9000 immunohistochemistry was used to measure the expression of RECK, MMP-9, and TGF-β1 in 54 samples of gastric carcinoma selected from paraffin wax-embodied specimens with complete clinicopathological data, and another 15 cases of normal gastric mucosa.
RESULTS: The expression rate of RECK in gastric cancer was low (51.9%), and reduced with the increased invasive depth and clinical stages, decreased histological differentiation and occurrence of lymphatic and long-distance metastasis (P < 0.05). The expression rate of MMP-9 in gastric cancer was high (75.9%), and elevated with the increased invasive depth and clinical stages, decreased histological differentiation, and occurrence of lymphatic metastasis (P < 0.05). The expression rate of TGF-β1 in gastric cancer was also high (77.8%), and enhanced with the increased clinical stages, reduced histological differentiation and occurrence of lymphatic metastasis (P < 0.05). The expression of RECK was negatively correlated with the expression of MMP-9 and TGF-β1 (r = -0.618, P < 0.001; r = -0.620, P < 0.001), while the expression of MMP-9 was positively correlated with that of TGF-β1 (r = 0.716, P < 0.001).
CONCLUSION: RECK is lowly expressed in gastric caner, but MMP-9 and TGF-β1 are highly expressed. RECK, MMP-9 and TGF-β1 may serve as the markers in the estimation of metastasis and dissemination of gatric cnacer.
- Citation: Song GQ, Wang Q. Expression of reversion-inducing-cysteine-rich protein with Kazal motifs, matrix metalloproteinase-9 and transforming growth factor-β1 and their correlations in gastric carcinomas. Shijie Huaren Xiaohua Zazhi 2007; 15(15): 1731-1737
- URL: https://www.wjgnet.com/1009-3079/full/v15/i15/1731.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i15.1731
胃癌是最常见的恶性肿瘤之一, 死亡率占恶性肿瘤的首位, 为了寻找早期诊断及判断预后的方法, 目前针对胃癌侵袭及转移的机制探讨已进入分子生物学的水平. 细胞外基质和基底膜的降解是恶性肿瘤浸润和转移的关键环节. 基质金属蛋白酶及其抑制剂在肿瘤的生长过程中发挥了重要的调节作用, 因此也成为目前肿瘤侵袭转移研究领域的热点. 其中MMP-9可特异性降解Ⅳ型胶原. RECK(reversion-inducing-cysteine-rich protein with kazal motifs)基因是1998年新发现的抑癌基因, 研究表明其通过抑制MMP活性与肿瘤血管生成从而阻断肿瘤侵袭和转移. 已有研究显示在人类多种恶性肿瘤中均可以检测到MMP-9的过表达, RECK的突变与缺失. TGF-β1是一种多功能的蛋白质, 他对多种细胞的生长、分化具有调控作用. 人体许多正常和肿瘤细胞可分泌TGF-β1. 在多种恶性肿瘤组织中, TGF-β1的表达发生变化, 通过多种途径促进恶性肿瘤转移播散. 我们对胃癌组织中的RECK, MMP-9及TGF-β1的表达与临床病理特征的相关性研究如下.
选择临床及病理资料完整的中国医科大学附属盛京医院普外科2001-2003手术切除并经病理证实为胃癌的蜡块标本54例, 全部病例术前均未行放化疗, 病理观察证实均为腺癌. 其中男性37例, 女性17例; 年龄38-78(平均60.4)岁; 肿瘤的原发灶大小(D)、浸润深度(T)、淋巴结转移(N)均由病理观察确定, 远处转移(M)由病理学和临床联合确定. 组织学分化: 高分化19例, 中分化17例, 低分化18例; 局部淋巴结转移25例, 无转移29例; 根据1997年国际抗癌联盟(UICC)制定的TNM分期标准进行临床分期:Ⅰ期12例, Ⅱ期14例, Ⅲ期16例, Ⅳ期12例. 另取良性病变胃黏膜组织15例, 标本取自胃溃疡或十二指肠溃疡手术切除组织块, 经病理观察证实且排除重度不典型增生. 其中男性10例, 女性5例, 年龄44-77(平均58.2)岁. 浓缩型RECK兔抗人mAb购于美国Santa Cruz公司产品, MMP-9兔抗人mAb购于北京中山生物制品有限公司, TGF-β1鼠抗人mAb购于武汉博士德生物工程有限公司, PV-9000试剂盒及DAB显色试剂盒购于北京中杉金桥生物技术有限公司. 免疫组织化学染色所需的常规试剂: 枸橼酸盐缓冲液(0.01 mmol/L pH6.0)、磷酸氢二钠、磷酸二氢钠、氯化钠、二甲苯、酒精、过氧化氢、苏木素等均为化学分析纯试剂. 低温冰箱、冰冻切片机、烤片机、高压消毒锅、温育箱、OlympusBX41显微镜、显微照相装置OlympusBX40F4、湿盒等, 均由中国医科大学附属盛京医院病理科提供.
将蜡块切片HE染色, 确定标本的组织分化程度. 采用第二代通用型二步法监测系统(PV-9000)免疫组化方法检测RECK, MMP-9及TGF-β1在胃癌及正常胃组织中的表达. 一抗工作浓度: RECK为1∶75, MMP-9为1∶100, TGF-β1为1∶160. 用已知阳性的乳腺癌切片作为阳性对照, PBS缓冲液代替一抗作阴性对照. 以细胞内出现明显棕黄色颗粒为阳性细胞, 按其占同类记数细胞的百分比计数3种蛋白染色结果. RECK: 阴性(-): 阳性细胞率<5%; 弱阳性(+): 阳性细胞率为5%-25%; 阳性(++): 阳性细胞率为25%-50%; 强阳性(+++): 阳性细胞率>50%. MMP-9: 于肿瘤侵袭边缘及肿瘤内染色相对密集区选取5个视野, 阴性(-): 无明显的阳性细胞; 弱阳性(+): 阳性细胞率<25%; 阳性(++): 阳性细胞率为25%-75%; 强阳性(+++): 阳性细胞率>75%. TGF-β1: 阴性(-): 阳性细胞率<5%; 阳性(+): 阳性细胞率≥5%.
统计学处理 采用SPSS13.0软件进行统计学处理, 各项指标间差别检验均应用χ2检验, 组间相关性采用Spearman相关分析. 以P<0.05为差异显著标准.
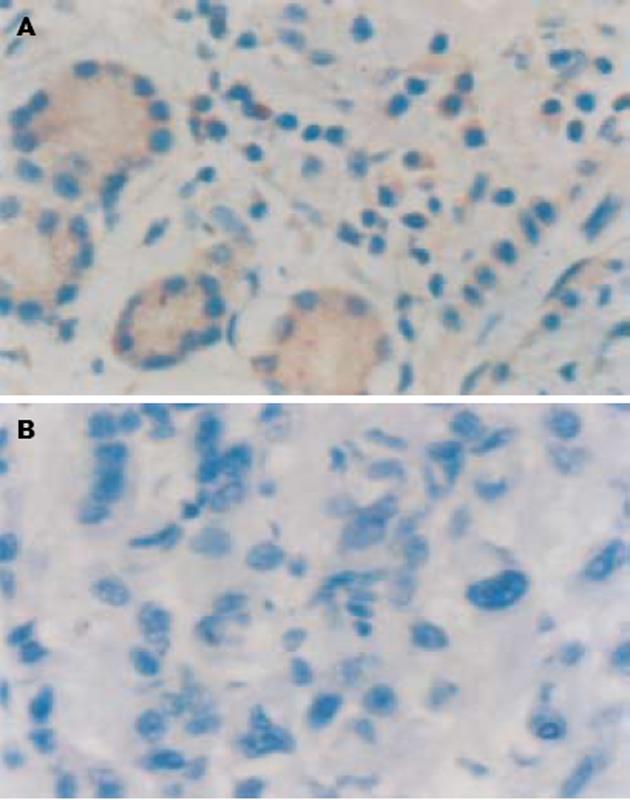
RECK在非肿瘤胃黏膜组织中的阳性表达率(+~+++)为100%(15/15), 位于胞质(图1A). RECK在胃癌组织中的阳性表达率为51.9%(28/54)(图1B), 明显低于在非肿瘤胃黏膜组织中的表达(P<0.01), 且与胃癌的肿瘤浸润深度、淋巴转移、远隔转移、临床分期呈负相关(P<0.05), 随肿瘤浸润深度的加深、淋巴转移的产生、远隔转移的发生、临床分期的提高、肿瘤病理分化程度的降低而降低(P<0.05). 胃癌组织中RECK的表达与患者的性别、年龄及肿瘤大小无相关性(P>0.05)(表1-2).
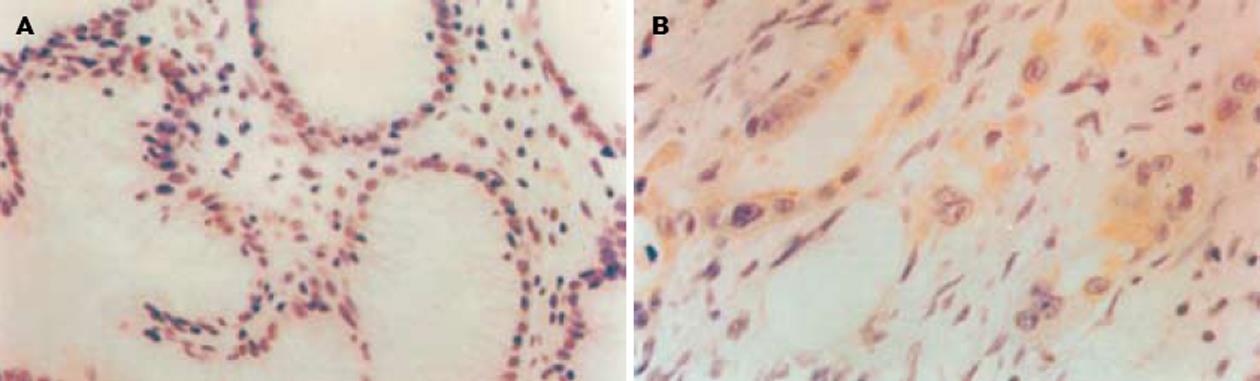
MMP-9在非肿瘤胃黏膜组织中的阳性表达率(+~+++)为26.7% (4/15)(图2A). MMP-9在胃癌组织中的阳性表达率为75.9%(41/54), 主要表达于癌巢和正常组织交接部位, 癌细胞及间质细胞都有表达, 多定位于胞质(图2B). MMP-9在胃癌组织中的阳性表达率明显高于在非肿瘤胃黏膜组织中的表达(P<0.05), 并随肿瘤浸润深度的加深、淋巴转移的产生、临床分期的提高、肿瘤病理分化程度的降低而增高(P<0.05). 胃癌组织中MMP-9的表达与患者的性别、年龄及肿瘤大小无相关性(P>0.05, 表1-2).
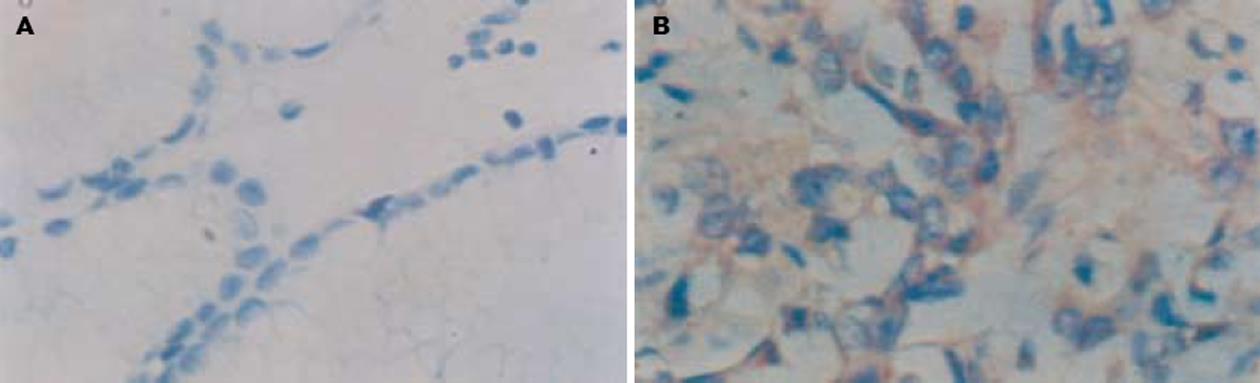
TGF-β1在非肿瘤胃黏膜组织中的阳性表达率为46.7%(7/15)(图3A).TGF-β1在胃癌组织中的阳性表达率为77.8% (42/54), 癌细胞及间质细胞都有表达, 多定位于胞质(图3B), 明显高于在非肿瘤胃黏膜组织中的表达(P<0.05), 并随淋巴转移的产生、临床分期的提高、肿瘤病理分化程度的降低而增高(P<0.05). TGF-β1在胃癌组织中的阳性表达率与患者的性别、年龄、肿瘤大小、浸润深度、远隔转移无相关性(P>0.05)(表1-2).
胃癌组织中RECK与MMP-9的表达呈负相关(P<0.001, rs = -0.618), RECK与TGF-β1的表达呈负相关(P<0.001, rs = -0.620), MMP-9与TGF-β1的表达呈正相关(P<0.001, rs = 0.716).
RECK基因是1998年Takahashi et al[1]在v-Ki-ras转染的NIH3T3细胞中发现的一种新基因, 定位于9p12-p13, 长度约87 kb, 包含21个外显子, 20个内含子, 共有13个已发现的单核苷酸多态性(single nucleotide polymorphism, SNP), 其中4个位于编码区域(外显子1, 9, 13, 15), 而另外9个位于内含子区域(内含子5, 8, 10, 12, 15, 17), 其转录产物为4.6 kb. RECK基因编码一个相对分子量为110×103的膜锚合葡萄糖蛋白, 其中半胱氨酸含量高达9%[2]. Southern blot分析显示, RECK序列在人, 鼠, 果蝇中呈高度保守. 在16种人体组织中均发现了4.6 kb的RECK转录产物. RECK基因在进化上的高度保守和组织上的广泛分布说明其有着重要的生物学功能. RECK基因在正常组织中高表达, 而在各种肿瘤来源的细胞系及转染了ras等癌基因的细胞中低表达[3-5]. 许多癌基因如ras, fos, myc等均可下调RECK基因的表达, 这说明RECK基因可能是癌基因共同作用的一个负调节靶位点. 此外基因敲除研究发现, RECK基因还与血管生成密切相关, 其适量表达能抑制血管的生成[6-8]. 最初认为RECK是一个新的转化抑制基因, 后来发现他能抑制3个基质金属蛋白酶(metrix metalloproteinase, MMP)的成员MMP-2、MMP-9及MT1-MMP的分泌与活性, 其抑制作用属于转录后水平的调节机制[9-10]. 本实验发现, RECK在胃癌组织中的表达率(51.9%)明显低于在非肿瘤胃黏膜组织中的表达(100%), 并随肿瘤病理分化程度的降低、浸润深度的加深、淋巴转移的发生、远隔转移的产生及临床分期的增高而降低(P<0.05), 与文献报道相符[11-13], 提示RECK基因表达的缺失与胃癌的发生、发展、浸润和转移密切相关, 而且可能为判断胃癌的恶性程度提供依据.
基底膜和细胞外基质(extracellulla matrix, ECM)是阻止肿瘤侵袭和转移的主要屏障, 肿瘤的侵袭和转移首要条件就是应具备降解细胞外基质和基底膜的能力[14-15], 这一过程涉及大量的蛋白酶及其抑制剂, 其中MMP几乎能降解ECM中所有的成分和基底膜的胶原, 促使细胞侵袭周边结缔组织进入脉管系统, 最后到达继发组织器官扩展性生长[16-17]. 研究表明, MMP过度表达与肿瘤的恶性程度密切相关, MMP对原发肿瘤和继发肿瘤的生长有促进作用[18-20]. 抑制MMP对抑制肿瘤的侵袭、生长、转移和血管生成有重要的意义[21-23]. MMP-9是MMPs家族的重要成员, 由Sopata和Dancewicz于1974年从中性粒细胞提纯获得的, 于1989年正式命名[21], 该基因位于染色体20q12-q13, 能够降解、破坏细胞外基质中最主要的组成成分Ⅳ、Ⅴ型胶原和明胶, 从而破坏基底膜的完整性[24-29]. David et al[27]采用免疫组化法研究发现, 与正常胃黏膜相比,胃癌组织MMP表达明显升高, MMP与胃癌病期显著相关. Sier et al[30]研究结果显示, 胃癌组织MMP-9表达显著高于邻近的正常胃黏膜, 其高表达胃癌患者生存期明显缩短. 研究发现, 在恶性细胞株中恢复RECK的表达, 除了能抑制浸润行为以外还总是伴有MMP-9的分泌减少, 这提示在正常细胞中RECK可能是MMP-9的负调节因子, RECK基因被致癌信号下调将导致MMP-9分泌增加, 促进细胞外基质的降解, 有利于肿瘤的浸润和转移[28-30]. 本实验结果显示, RECK和MMP-9在胃癌组织中的表达呈负相关(P<0.001, rs = -0.618), MMP-9的表达随RECK的降低而升高, 提示胃癌组织中RECK表达的缺失, 导致了对MMP-9的抑制作用降低, 而使MMP-9高表达, 促进了肿瘤细胞的侵袭和转移.
转化生长因子(transforming growth factor, TGF)是指具有刺激细胞从贴壁依赖性生长转变为贴壁非依赖性生长的一类具有转化作用的生长因子. TGF-β1是TGF-β家族的主要成员, 是调节正常细胞生长和各种功能的主要因子[31-33]. 近年来研究表明TGF-β1与多种肿瘤的发生、发展有关, 乳腺癌[34-35]、肝癌[36]等癌细胞均可自分泌TGF-β1, 并受其影响, 在前列腺癌、胃癌[37]乳腺癌、结直肠癌[38]等恶性肿瘤中呈过度表达, 其过度表达在肿瘤转化、进展中起重要作用并与预后相关. 对正常细胞, TGF-β1通过其信号通路使细胞停止在G1期抑制细胞增殖, 可看作一种抑癌因子. 但当细胞恶变时, TGF-β1信号通路的组成成分发生改变, 表现为TGF-β1受体改变、下游信号Smads突变及癌基因突变等, 导致细胞对TGF-β1耐受. 在肿瘤的早期阶段, TGF-β1可看作肿瘤的抑制物; 在肿瘤的进展阶段, 细胞因TGF-β1的抑制增殖作用消失而出现优势生长; 在肿瘤的晚期阶段, TGF-β1作为肿瘤的促进因子, 通过刺激血管生成、细胞播散、免疫抑制及合成细胞外基质而提供适宜于肿瘤生长、浸润及转移的微环境[39]. 本实验发现, 胃癌组织中RECK与TGF-β1的表达呈负相关(P<0.001, rs = -0.620), 且TGF-β1的表达随RECK的降低而升高, 提示RECK基因表达的缺失, 丧失了对TGF-β1活性的促进作用, 而降低了其促进肿瘤细胞凋亡的作用, 导致癌细胞的无限制生长. TGF-β1表达与胃癌组织学类型和分化程度无关, 而与淋巴结转移、临床病理分期(TNM分期)相关, TGF-β1促进了胃癌细胞浸润和转移并影响预后. 可以推测, RECK也可能调节其他细胞外信号分子(如TGF-β)的数量及功能或调节血管生成的其他方面, 其具体机制有待于进一步的研究.
MMP通过降解血管周围细胞外基质, 调节和释放血管活性因子, 可促进肿瘤新生血管形成[40-42]. 本实验亦发现胃癌组织中TGF-β1与MMP-9的表达呈正相关(P<0.001, rs = 0.716), MMP-9的阳性表达率随TGF-β1的升高而升高, 提示TGF-β1通过刺激血管生成、细胞播散、免疫抑制及合成细胞外基质而提供适宜于肿瘤生长、浸润及转移的微环境和MMP-9降解细胞外基质和基底膜而促进的细胞迁移和侵袭在胃癌的发生、发展中互相制约而共同起作用. 但目前国内外对他们之间关系的研究很少, 很可能二者之间不存在直接的相互制约作用, 而是分别受RECK等其他因素调控而同时影响恶性肿瘤的发生、发展.
总之, RECK、MMP-9及TGF-β1的表达在胃癌的发生、发展和浸润转移过程中起重要作用, 近来成为研究的热点, 有可能成为判断胃癌生物学行为的重要指标. 但其具体机制和途径目前尚不清楚, 需要更深入的研究来明确他们之间的关系.
RECK基因是1998年新发现的抑癌基因, 通过抑制MMP活性与肿瘤血管生成从而阻断肿瘤侵袭和转移. 其抑癌机制还不很清楚. MMP-9可降解细胞外基质和基底膜而促进恶性肿瘤浸润和转移. TGF-β1对细胞的生长、分化具有调控作用, 在多种恶性肿瘤组织中, TGF-β1高表达与恶性肿瘤转移播散相关.
RECK、MMP-9及TGF-β1的表达在胃癌的发生、发展和浸润转移过程中起重要作用, 近来成为研究的热点, 有可能成为判断胃癌生物学行为的重要指标. 但其具体机制和途径目前尚不清楚, 需要更深入的研究来明确他们之间的关系.
研究发现RECK能抑制3个MMP的成员MMP-2、MMP-9及MT1-MMP的分泌与活性. RECK对MMP的抑制作用属于转录后水平的调节机制. 此外基因敲除研究发现, RECK基因还与血管生成密切相关, 其适量表达能抑制血管的生成.
关于RECK, MMP-9, TGF-β1的表达与临床病理特征的相关性, 及他们间的相互关系的研究, 在胃癌组织方面目前较为少见. 研究他们之间的关系对认识RECK的抑癌机制有提示作用.
RECK, MMP-9, TGF-β1可以作为判断胃癌的浸润转移的指标, 检测他们的联合表达, 能帮助我们更好地判断胃癌的浸润转移, 从而更好地判断预后. 对RECK基因的深入研究有利于我们更进一步的了解肿瘤的生物学行为, 阐明肿瘤侵袭和转移的机制, 同时为研究新的抗肿瘤药物提供新靶点.
1 RECK基因: 是1998年发现的一种新基因, 定位于9p12-p13, 研究表明其通过抑制MMP活性与肿瘤血管生成从而阻断肿瘤侵袭和转移.
2 TGF: 是指具有刺激细胞从贴壁依赖性生长转变为贴壁非依赖性生长的一类具有转化作用的生长因子.
本文研究了RECK, MMP-9和TGF-β1在胃癌组织中的表达, 有关RECK与胃癌的关系目前研究不多. 文章立题新颖, 有一定的参考价值.
电编: 张敏 编辑:张焕兰
| 1. | Takahashi C, Sheng Z, Horan TP, Kitayama H, Maki M, Hitomi K, Kitaura Y, Takai S, Sasahara RM, Horimoto A. Regulation of matrix metalloproteinase-9 and inhibition of tumor invasion by the membrane-anchored glycoprotein RECK. Proc Natl Acad Sci U S A. 1998;95:13221-13226. [PubMed] [DOI] |
| 2. | Eisenberg I, Hochner H, Sadeh M, Argov Z, Mitrani-Rosenbaum S. Establishment of the genomic structure and identification of thirteen single-nucleotide polymorphisms in the human RECK gene. Cytogenet Genome Res. 2002;97:58-61. [PubMed] [DOI] |
| 3. | Masui T, Doi R, Koshiba T, Fujimoto K, Tsuji S, Nakajima S, Koizumi M, Toyoda E, Tulachan S, Ito D. RECK expression in pancreatic cancer: its correlation with lower invasiveness and better prognosis. Clin Cancer Res. 2003;9:1779-1784. [PubMed] |
| 4. | Furumoto K, Arii S, Mori A, Furuyama H, Gorrin Rivas MJ, Nakao T, Isobe N, Murata T, Takahashi C, Noda M. RECK gene expression in hepatocellular carcinoma: correlation with invasion-related clinicopathological factors and its clinical significance. Reverse-inducing--cysteine-rich protein with Kazal motifs. Hepatology. 2001;33:189-195. [PubMed] [DOI] |
| 5. | Takeuchi T, Hisanaga M, Nagao M, Ikeda N, Fujii H, Koyama F, Mukogawa T, Matsumoto H, Kondo S, Takahashi C. The membrane-anchored matrix metalloproteinase (MMP) regulator RECK in combination with MMP-9 serves as an informative prognostic indicator for colorectal cancer. Clin Cancer Res. 2004;10:5572-5579. [PubMed] [DOI] |
| 6. | Oh J, Takahashi R, Kondo S, Mizoguchi A, Adachi E, Sasahara RM, Nishimura S, Imamura Y, Kitayama H, Alexander DB. The membrane-anchored MMP inhibitor RECK is a key regulator of extracellular matrix integrity and angiogenesis. Cell. 2001;107:789-800. [PubMed] [DOI] |
| 7. | Sasahara RM, Brochado SM, Takahashi C, Oh J, Maria-Engler SS, Granjeiro JM, Noda M, Sogayar MC. Transcriptional control of the RECK metastasis/angiogenesis suppressor gene. Cancer Detect Prev. 2002;26:435-443. [PubMed] [DOI] |
| 8. | Welm B, Mott J, Werb Z. Developmental biology: vasculogenesis is a wreck without RECK. Curr Biol. 2002;12:R209-211. [PubMed] [DOI] |
| 9. | Baker AH, Edwards DR, Murphy G. Metalloproteinase inhibitors: biological actions and therapeutic opportunities. J Cell Sci. 2002;115:3719-3727. [PubMed] [DOI] |
| 10. | Wood M, Fudge K, Mohler JL, Frost AR, Garcia F, Wang M, Stearns ME. In situ hybridization studies of metalloproteinases 2 and 9 and TIMP-1 and TIMP-2 expression in human prostate cancer. Clin Exp Metastasis. 1997;15:246-258. [PubMed] [DOI] |
| 11. | Rhee JS, Coussens LM. RECKing MMP function: implications for cancer development. Trends Cell Biol. 2002;12:209-211. [PubMed] [DOI] |
| 12. | Song SY, Son HJ, Nam E, Rhee JC, Park C. Expres-sion of reversion-inducing-cysteine-rich protein with Kazal motifs (RECK) as a prognostic indicator in gastric cancer. Eur J Cancer. 2006;42:101-108. [PubMed] [DOI] |
| 13. | Span PN, Sweep CG, Manders P, Beex LV, Leppert D, Lindberg RL. Matrix metalloproteinase inhibitor reversion-inducing cysteine-rich protein with Kazal motifs: a prognostic marker for good clinical outcome in human breast carcinoma. Cancer. 2003;97:2710-2715. [PubMed] [DOI] |
| 14. | Srivastava A, Pastor-Pareja JC, Igaki T, Pagliarini R, Xu T. Basement membrane remodeling is essential for Drosophila disc eversion and tumor invasion. Proc Natl Acad Sci USA. 2007;104:2721-2726. [PubMed] [DOI] |
| 15. | Nguyen TH. Mechanisms of metastasis. Clin Dermatol. 2004;22:209-216. [PubMed] [DOI] |
| 20. | Curran S, Murray GI. Matrix metalloproteinases in tumour invasion and metastasis. J Pathol. 1999;189:300-308. [PubMed] [DOI] |
| 21. | Egeblad M, Werb Z. New functions for the matrix metalloproteinases in cancer progression. Nat Rev Cancer. 2002;2:161-174. [PubMed] [DOI] |
| 22. | Deryugina EI, Soroceanu L, Strongin AY. Up-regulation of vascular endothelial growth factor by membrane-type 1 matrix metalloproteinase stimulates human glioma xenograft growth and angiogenesis. Cancer Res. 2002;62:580-588. [PubMed] |
| 23. | Sounni NE, Devy L, Hajitou A, Frankenne F, Munaut C, Gilles C, Deroanne C, Thompson EW, Foidart JM, Noel A. MT1-MMP expression promotes tumor growth and angiogenesis through an up-regulation of vascular endothelial growth factor expression. FASEB J. 2002;16:555-564. [PubMed] [DOI] |
| 24. | Van Wart HE, Birkedal-Hansen H. The cysteine switch: a principle of regulation of metallopro-teinase activity with potential applicability to the entire matrix metalloproteinase gene family. Proc Natl Acad Sci U S A. 1990;87:5578-5582. [PubMed] [DOI] |
| 25. | Johnson C, Galis ZS. Matrix metalloproteinase-2 and -9 differentially regulate smooth muscle cell migration and cell-mediated collagen organization. Arterioscler Thromb Vasc Biol. 2004;24:54-60. [PubMed] [DOI] |
| 26. | Collen A, Hanemaaijer R, Lupu F, Quax PH, van Lent N, Grimbergen J, Peters E, Koolwijk P, van Hinsbergh VW. Membrane-type matrix metalloproteinase-mediated angiogenesis in a fibrin-collagen matrix. Blood. 2003;101:1810-1817. [PubMed] [DOI] |
| 27. | David L, Nesland JM, Holm R, Sobrinho-Simoes M. Expression of laminin, collagen IV, fibronectin, and type IV collagenase in gastric carcinoma. An immunohistochemical study of 87 patients. Cancer. 1994;73:518-527. [PubMed] [DOI] |
| 28. | Noda M, Oh J, Takahashi R, Kondo S, Kitayama H, Takahashi C. RECK: a novel suppressor of malignancy linking oncogenic signaling to extracellular matrix remodeling. Cancer Metastasis Rev. 2003;22:167-175. [PubMed] [DOI] |
| 30. | Sier CF, Kubben FJ, Ganesh S, Heerding MM, Griffioen G, Hanemaaijer R, van Krieken JH, Lamers CB, Verspaget HW. Tissue levels of matrix metalloproteinases MMP-2 and MMP-9 are related to the overall survival of patients with gastric carcinoma. Br J Cancer. 1996;74:413-417. [PubMed] [DOI] |
| 31. | Lyons RM, Moses HL. Transforming growth factors and the regulation of cell proliferation. Eur J Biochem. 1990;187:467-473. [PubMed] [DOI] |
| 32. | Moses HL, Yang EY, Pietenpol JA. TGF-beta stimulation and inhibition of cell proliferation: new mechanistic insights. Cell. 1990;63:245-247. [PubMed] [DOI] |
| 34. | Ghellal A, Li C, Hayes M, Byrne G, Bundred N, Kumar S. Prognostic significance of TGF beta 1 and TGF beta 3 in human breast carcinoma. Anticancer Res. 2000;20:4413-4418. [PubMed] |
| 35. | Murray PA, Barrett-Lee P, Travers M, Luqmani Y, Powles T, Coombes RC. The prognostic significance of transforming growth factors in human breast cancer. Br J Cancer. 1993;67:1408-1412. [PubMed] [DOI] |
| 36. | Tsai JF, Jeng JE, Chuang LY, Yang ML, Ho MS, Chang WY, Hsieh MY, Lin ZY, Tsai JH. Elevated urinary transforming growth factor-beta1 level as a tumour marker and predictor of poor survival in cirrhotic hepatocellular carcinoma. Br J Cancer. 1997;76:244-250. [PubMed] [DOI] |
| 37. | Saito H, Tsujitani S, Oka S, Kondo A, Ikeguchi M, Maeta M, Kaibara N. An elevated serum level of transforming growth factor-beta 1 (TGF-beta 1) significantly correlated with lymph node metastasis and poor prognosis in patients with gastric carcinoma. Anticancer Res. 2000;20:4489-4493. [PubMed] |
| 40. | John A, Tuszynski G. The role of matrix metalloproteinases in tumor angiogenesis and tumor metastasis. Pathol Oncol Res. 2001;7:14-23. [PubMed] [DOI] |
| 41. | Yoon SO, Park SJ, Yun CH, Chung AS. Roles of matrix metalloproteinases in tumor metastasis and angiogenesis. J Biochem Mol Biol. 2003;36:128-137. [PubMed] [DOI] |