修回日期: 2007-02-04
接受日期: 2007-03-06
在线出版日期: 2007-05-08
目的: 建立并优化乙型肝炎肝纤维化组织蛋白质组研究所需的双向凝胶电泳技术, 提高其分辨率和重复性.
方法: 外科手术获取乙型肝炎肝纤维化组织, 提取肝组织总蛋白. 利用固相pH梯度双向凝胶电泳技术分离总蛋白, 考马斯亮蓝染色后分析凝胶图像. 对2-DE中的关键因素与环节, 如样本处理、上样量、电泳参数等各步条件进行了一系列优化.
结果: 优化条件后的乙型肝炎肝纤维化组织双向凝胶电泳图谱水平拖尾减少、斑点分辨率改善、斑点检出数量增加(246±33→729±83).
结论: 该双向凝胶电泳技术可应用于乙型肝炎肝纤维化组织的蛋白质组学研究.
引文著录: 罗新华, 杨勤, 张权, 程明亮. 乙型肝炎肝纤维化组织双向电泳技术的优化. 世界华人消化杂志 2007; 15(13): 1554-1557
Revised: February 4, 2007
Accepted: March 6, 2007
Published online: May 8, 2007
AIM: To establish and optimize the technique of two-dimensional gel electrophoresis (2-DE) for studying the proteomics of liver fibrosis tissue from patients with hepatitis B.
METHODS: Liver fibrosis tissues were obtained by surgical method, and the total proteins were extracted. Immobilized pH gradient isoelectric two-dimensional gel electrophoresis was used to separate the total protein. After coomassie brilliant blue staining, 2-DE maps were analyzed with ImageMaster 2D Platinum Software. A series of conditions such as the sample size, electrophoresis parameters and the way to treat the sample were improved.
RESULTS: After optimization, the horizontal trail was decreased; the resolution of the spot was improved; the number of protein spot was increased from 246 ± 33 to 729 ± 83 in the 2-DE maps.
CONCLUSION: The optimized technique of 2-DE can be introduced to study the proteomics of liver fibrosis tissue from patients with hepatitis B.
- Citation: Luo XH, Yang Q, Zhang Q, Cheng ML. Optimization of two-dimensional gel electrophoresis technique for liver fibrosis tissue from patients with hepatitis B. Shijie Huaren Xiaohua Zazhi 2007; 15(13): 1554-1557
- URL: https://www.wjgnet.com/1009-3079/full/v15/i13/1554.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i13.1554
随着人类基因组草图的正式完成, 生命科学的研究进入了后基因时代, 蛋白质组学(proteomics)作为后基因时代研究的一个重要内容, 已广泛深入到生命科学和医药学的各个领域, 其理论和技术的发展完善亦为肝纤维化的研究带来了新的思维方式和研究领域[1]. 双向凝胶电泳(two dimensional electrophoresis, 2-DE)是蛋白质组学研究的核心技术, 近年来得到了较大的发展与改善, 但重复性和稳定性仍然是2- DE技术存在的主要问题[2]. 目前, 有关乙型肝炎肝纤维化组织的2-DE少见报道. 为此, 我们对人乙型肝炎肝纤维化组织进行了双向电泳, 并对其中的关键因素与环节进行了研究和实验条件优化, 建立稳定、重复性好、分辨率高的肝纤维化组织蛋白质分离技术, 为进一步开展肝纤维化蛋白质组学研究奠定基础.
肝纤维化组织来源于2006-02/08贵阳医学院附属医院肝胆外科乙肝后肝癌切除术患者的癌周组织, 取得组织后立即在无菌状态下用含3 mmol/L PMSF的冰生理盐水洗净血液, 液氮中速冻1 h后转入-80 ℃冰箱中保存备用. 选取其中经HE染色病理诊断为肝纤维化3级的肝组织为研究对象, 诊断符合2000年病毒性肝炎防治方案标准[3]. 超纯尿素(Urea)、硫脲(Thiourea)、过硫酸铵(APS)、二硫苏糖醇(DTT)、苯甲基磺酰氟(PMSF)、丙基硫酸盐(CHAPS)、十二烷基硫酸钠(SDS)、四甲基乙二胺(TEMED)、三羟基甲基氨基甲烷(Tris)、甘氨酸、琼脂糖、核酶混合物(Nuclease Mix)、蛋白酶抑制剂试剂盒、矿物油、甲叉双丙烯酰胺、溴酚蓝、碘乙酰胺均购自Amersham公司, 两性电解质、固相pH梯度干胶条(IPG strip)购自Bio-Rad公司, 低分子标准蛋白购自北京天根公司, 冰醋酸、无水乙醇为国产分析纯. 所有试剂均用去离子水配制. Ettan IPG phor Ⅱ等电聚焦系统、Ettan DALTsix垂直电泳系统、Imagescanner扫描仪、LabScan扫描软件、ImageMaster 2D Platinum Software(Version 5.0)图象分析软件为Amersham产品, 国产高速冷冻离心机、721分光光度仪.
1.2.1 肝纤维化组织蛋白质的提取: 参照文献[4-8]加以改进. 称取肝纤维化组织100 mg, 于匀浆器中加入1.5 mol/L pH6.8 Tris-HCl 100 μL后冰上手工匀浆至组织破碎, 再加核酶混合物10 μL, 短暂振荡混匀后在室温下培育40 min. 加入裂解液(8 mol/L尿素、2 mol/L硫脲、40 g/L CHAPS、40 mol/L Tris、5 mL/L两性电解质、10 mL/L蛋白酶抑制剂、10 g/L DTT) 400 μL充分混匀. 4 ℃12 000 g离心5 min, 吸取上清液即为肝组织的总蛋白质, Bradford法蛋白定量.
1.2.2 等电聚焦(IEF): 参照IPGphor等电聚焦系统指南和Gorg et al[9]的方法加以改进. 按1000 μg上样量计算出上样体积, 加入50 mmol/L DTT、5 mL/L两性电解质、水化液(8 mol/L尿素、2 mol/L硫脲、40 g/L CHAPS、40 mmol/LTris、溴酚蓝痕量)混匀, 终体积达350 μL. 将含样本的水化液均匀加入溶胀盘中, 胶面向下放入IPG干胶条, 矿物油覆盖, 20 ℃下被动水化12 h后胶条转移至电泳槽中, 胶面向上20 ℃下自动进行IEF, 电泳参数设置500V 1 h、1000V 1 h, 8000V 5 h, 8000V 6 h, 总达69 500伏小时.
1.2.3 平衡: 等电聚焦结束后, 立即在平衡液Ⅰ(6 mol/L尿素、20 g/L SDS、1.5 mol/L pH8.8的Tris-HCl、200 mL/L甘油、10 g/L DTT)中平衡15 min, 再于平衡液Ⅱ(25 g/L碘乙酰胺替代平衡液Ⅰ中10 g/L DTT)中平衡15 min, 滤纸吸去胶条多余的平衡液.
1.2.4 SDS-PAGE电泳: 配制130 g/L的SDS-PAGE均一凝胶. 将平衡后的IPG胶条转移至凝胶的上端, 在胶的一端加入低分子标准蛋白, 用含痕量溴酚蓝的5 g/L的琼脂糖封顶. 设置电泳参数: 初始电流为10 mA/strip, 45 min, 待溴酚蓝前沿移入SDS胶时, 加大电流至30 mA/strip, 直至溴酚蓝距离凝胶底部约0.5 cm 时, 停止电泳, 约4 h.
1.2.5 考马斯亮蓝染色: 考马斯亮蓝R250染色2 h, 250 mL/L乙醇、80 mL/L乙酸、双蒸水脱色2 h, 双蒸水浸泡过夜.
1.2.6 凝胶图像采集与分析: 染色后凝胶通过Imagescanner扫描仪及LabScan扫描软件透射扫描, 分辨率采用300 dpi扫描获取图像, 利用ImageMaster 2D Platinum Software(Version 5.0) 图像分析软件对图像先进行蛋白质斑点自动检测, 然后手工删除假点、添加未检出的斑点, 最后进行斑点匹配.
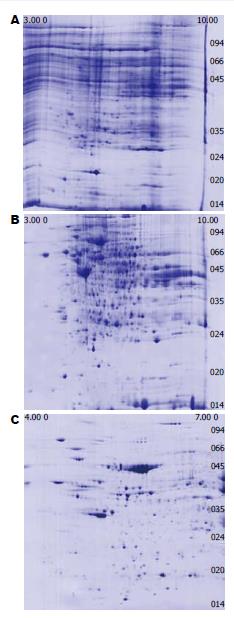
条件优化后蛋白提取浓度由优化前5.2 g/L提高到12.1 g/L, 在相同条件下对同一肝纤维化组织分别进行了3次重复性2-DE检测, 优化条件后的肝纤维化组织的2-DE图谱水平拖尾减少, 斑点的分辨率明显改善, 斑点检出数量由优化前的平均246±33增加至729±83. 所有蛋白斑点主要集中在等电点5-7、物质的相对分子质量Mr66 000-24 000范围(图1).
双向电泳是蛋白质组学研究的核心技术[10]. 清晰、分辨率高和重复性好的2-DE图谱是蛋白质组学研究的关键[11]. 由于乙型肝炎肝纤维化组织成分的复杂性及个体差异, 难以象动物和细胞研究那样严格控制实验条件, 导致其2-DE更为复杂. 为此, 我们对肝纤维化组织的采集、组织总蛋白质的抽提、2-DE的上样量及IPG胶条的选择上进行了反复的摸索, 建立并优化了肝纤维化组织蛋白质组分析的2-DE技术, 获得了重复性好、分辨率高的2-DE图像.
蛋白质样品的制备是2-DE的关键环节, 直接关系到蛋白质组研究结果的准确性[12]. 整个样品提取过程需尽可能地溶解和解聚蛋白质[13]. 为此, 我们在样本处理时进行了如下改进: 优化裂解液的组成, 以增加蛋白质的溶解度. 本实验针对肝纤维化组织在裂解液中将能改善蛋白质尤其是疏水蛋白的溶解性的硫脲浓度提高到2 mol/L. 去污剂可防止蛋白质通过疏水作用而集聚, 但阳离子和阴离子去污剂可引起天然分子结构的变化, 并使蛋白变性, 故使用两性离子去污剂CHAPS, 可以温和地使蛋白解聚, 并保留活性. DTT作为还原剂断开二硫键, 以维持蛋白质还原状态的作用, 保证蛋白质的折叠完全打开. 通过反复实验发现, 10 g/L DTT既能使碱性蛋白得到较好分离, 又能减少2-DE图谱拖尾. 细胞破碎后, 蛋白酶被释放出或激活, 使蛋白质分解, 在尿素、Tris碱等条件下, 大多数蛋白酶被有效抑制, 但仍有一部分蛋白酶存在活性. 因此我们在裂解液中再加入复合蛋白酶抑制剂, 防止蛋白质降解, 保持蛋白质的完整性. 此外除了考虑增加蛋白质本身的溶解度外, 还应排除细胞混合物中核酸、脂肪酸和盐离子等干扰蛋白质溶解的物质, 尤其是核酸, 与蛋白质结合后, 会产生人工假象和条纹(图1A). 因此加入微量的DNA酶和RNA酶, 并在室温下培育40 min, 以充分降解核酸, 减少干扰, 消减背景. 如果样品中盐分过多, 胶条的电内渗增高, 等电聚焦时电压上不去, 导致等电聚焦时间延长, 严重影响双向电泳效果[14-18]. 经过调整上述条件获得的2-DE图谱水平拖尾减少, 斑点的分辨率明显改善(图1B).
低丰度蛋白质的分离一直是2-DE研究的难点. 提高上样量有利于低丰度蛋白质的检测. 但上样量过高, 高丰度蛋白质的斑点过大会影响其他蛋白质点的分离和分析. 而且样本量过大, 可能导致IPG胶条再水化不充分, 影响等电聚焦的效果. 经过多次实验比较, 我们发现采用18 cm胶条、考马斯亮蓝染色, 选择1000 μg上样量获得了清晰的图像. 实验初期我们选择pH3-10L(线性)的IPG胶条分析蛋白总体情况, 发现肝纤维化组织蛋白点主要集中在pH5-7范围内, 使用pH4-7胶条, 蛋白分辨率明显提高[19](图1C). 因此我们选用扩大了pH4-6相对长度的pH3-10NL(非线性)胶条, 既能满足分析样本蛋白总体情况, 又提高了蛋白点较多的pH4-7段的分辨率. 目前应用最为广泛2-DE染色方法主要是硝酸银和考马斯亮蓝染色. 就蛋白质分辨率而言, 银染是考染的100倍, 且上样量较小, 可检出ng级的蛋白质. 但考马斯亮蓝染色在操作的简便性及与下游蛋白质鉴定技术的兼容性方面优于硝酸银染色[20]. 本实验采用考马斯亮蓝染色平均检出700余个蛋白点, 可满足后续筛选差异蛋白的需要.
总之, 我们对肝纤维化组织标本预处理等2-DE的各个环节进行了调整与优化, 建立了稳定、重复性好、分辨率高的肝纤维化组织2-DE图谱, 为进一步开展乙型肝炎肝纤维化组织蛋白质组学研究奠定了基础.
近年来, 随着蛋白质组学理论和相关技术的发展与完善, 亦为肝纤维化的研究带来了新的思维方式, 他不仅可以从组织或细胞蛋白质整体水平这一全新角度来研究肝纤维化的发生机制,而且有助于寻找与疾病相关的新的标志物.
双向电泳是蛋白质组学研究的核心技术. 清晰、稳定、重复性好的2-DE图谱是蛋白质组学研究的关键, 也是目前面临的挑战.
本文对乙型肝炎肝纤维化组织的采集、组织总蛋白质的抽提、2-DE的上样量及IPG胶条的选择上进行了反复的摸索, 建立了应用于肝纤维化组织蛋白质组分析的2-DE技术.
本技术为进一步开展肝纤维化组织蛋白质组学研究奠定了基础.
电编: 郭海丽 编辑:王晓瑜
| 2. | Stanley BA, Neverova I, Brown HA, Van Eyk JE. Optimizing protein solubility for two-dimensional gel electrophoresis analysis of human myocardium. Proteomics. 2003;3:815-820. [PubMed] [DOI] |
| 4. | Staudenmann W, Hatt PD, Hoving S, Lehmann A, Kertesz M, James P. Sample handling for proteome analysis. Electrophoresis. 1998;19:901-908. [PubMed] [DOI] |
| 5. | Nabetani T, Tabuse Y, Tsugita A, Shoda J. Proteomic analysis of livers of patients with primary hepatolithiasis. Proteomics. 2005;5:1043-1061. [PubMed] [DOI] |
| 6. | An JH, Seong J, Oh H, Kim W, Han KH, Paik YH. Protein expression profiles in a rat cirrhotic model induced by thioacetamide. Korean J Hepatol. 2006;12:93-102. [PubMed] |
| 7. | Liu Y, Liu P, Hu YY, Xu L, Wang L, Mu Y, Du G. Dynamic change of metabolism related protein in liver tissue of rats' model of hepatic fibrosis and regulatory effect of fuzheng huayu decoction on it. Zhongguo Zhong Xi Yi Jie He Za Zhi. 2006;26:224-227. [PubMed] |
| 8. | Liu Y, Liu P, Liu CH, Hu YY, Xu LM, Mu YP, Du GL. Proteomic analysis of proliferation and apoptosis in carbon tetrachloride induced rat liver fibrosis. Zhonghua Gan Zang Bing Za Zhi. 2005;13:563-566. [PubMed] |
| 9. | Gorg A, Obermaier C, Boguth G, Harder A, Scheibe B, Wildgruber R, Weiss W. The current state of two-dimensional electrophoresis with immobilized pH gradients. Electrophoresis. 2000;21:1037-1053. [PubMed] [DOI] |
| 10. | Quadroni M, James P. Proteomics and automation. Electrophoresis. 1999;20:664-677. [PubMed] [DOI] |
| 11. | Hamdan M, Righetti PG. Modern strategies for protein quantification in proteome analysis: advantages and limitations. Mass Spectrom Rev. 2002;21:287-302. [PubMed] [DOI] |
| 12. | Gorg A, Weiss W, Dunn MJ. Current two-dimensional electrophoresis technology for proteomics. Proteomics. 2004;4:3665-3685. [PubMed] [DOI] |
| 13. | Butt RH, Coorssen JR. Pre-extraction sample handling by automated frozen disruption significantly improves subsequent proteomic analyses. J Proteome Res. 2006;5:437-448. [PubMed] [DOI] |
| 14. | Churchward MA, Butt RH, Lang JC, Hsu KK, Coorssen JR. Enhanced detergent extraction for analysis of membrane proteomes by two-dimensional gel electrophoresis. Proteome Sci. 2005;3:5. [PubMed] [DOI] |
| 15. | Santoni V, Rabilloud T, Doumas P, Rouquie D, Mansion M, Kieffer S, Garin J, Rossignol M. Towards the recovery of hydrophobic proteins on two-dimensional electrophoresis gels. Electrophoresis. 1999;20:705-711. [PubMed] [DOI] |
| 16. | 郭 尧君. 蛋白质电泳实验技术. 第2版. 北京: 科学出版社 2005; 213-221. |
| 17. | Schwarz K, Fiedler T, Fischer RJ, Bahl H. A Standard Operating Procedure (SOP) for the preparation of intra- and extracellular proteins of Clostridium acetobutylicum for proteome analysis. J Microbiol Methods. 2007;68:396-402. [PubMed] [DOI] |
| 18. | Long XH, Zhu JW, Mo ZH, Feng S, Cheng G, Zhou XW, Zhang YZ, Yang PY. Development of an effective sample preparation approach for proteomic analysis of silkworm eggs using two-dimensional gel electrophoresis and mass spectrometry. J Chromatogr A. 2006;1128:133-137. [PubMed] [DOI] |
| 19. | Westbrook JA, Yan JX, Wait R, Welson SY, Dunn MJ. Zooming-in on the proteome: very narrow-range immobilised pH gradients reveal more protein species and isoforms. Electrophoresis. 2001;22:2865-2871. [PubMed] [DOI] |
| 20. | Candiano G, Bruschi M, Musante L, Santucci L, Ghiggeri GM, Carnemolla B, Orecchia P, Zardi L, Righetti PG. Blue silver: a very sensitive colloidal Coomassie G-250 staining for proteome analysis. Electrophoresis. 2004;25:1327-1333. [PubMed] [DOI] |