修回日期: 2007-01-04
接受日期: 2007-01-27
在线出版日期: 2007-05-08
目的: 利用质粒pSilencer3.1-H1构建针对人血管内皮生长因子-C(VEGF-C)基因的表达载体, 测序鉴定并观察在胃癌细胞中的表达.
方法: 根据质粒pSilencer3.1-H1要求设计两对小干扰RNA靶序列, 退火形成互补的双链, 通过与线性化的pSilencer3.0-H1相应位点连接、转化大肠杆菌, 扩增、纯化得到所需质粒, 酶切电泳及测序鉴定后转染胃癌细胞株SGC-7901, Western blot检测转染前后VEGF-C基因的蛋白表达.
结果: 经酶切和测序鉴定, 针对VEGF-C基因的siRNA表达载体构建成功. 转染胃癌细胞株SGC-7901后, Western blot检测显示VEGF-C基因蛋白表达明显降低, pSilencer3.1-VEGF-C1组抑制效果明显, 其抑制率为81.2%, 与阴性对照组相比差异具有显著性(P<0.05).
结论: 成功构建了针对人VEGF-C基因的siRNA表达载体和稳定转染的胃癌细胞株SGC-7901.
引文著录: 周慧聪, 亢春彦, 张艳, 李继昌. VEGF-C基因靶向RNA干扰重组表达载体的构建和表达. 世界华人消化杂志 2007; 15(13): 1549-1553
Revised: January 4, 2007
Accepted: January 27, 2007
Published online: May 8, 2007
AIM: To clone the recombinant plasmid affecting vascular endothelial growth factor-C (VEGF-C) gene transcription by RNA interference and observe VEGF-C expression in human gastric cancer cell.
METHODS: Two DNA sequences containing small hairpin structure were designed and synthesized. The complement form was obtained by annealing and then cloned into vector pSilencer3.1-H1. The recombinant plasmid was transformed into strain DH5α. After amplification and purification, the target plasmid, identified by restriction enzyme, was obtained sequenced. Finally, gastric carcinoma cell line SGC-7901 was transfected with the plasmid, and the protein expression of VEGF-C was detected by Western blot.
RESULTS: After enzyme digestion and sequencing, the VEGF-C siRNA expression vector was successfully constructed. Western blot analysis showed that the protein expression of VEGF-C was markedly decreased after transfection, especially in the cells transfected with pSilencer3.1-VEGF-C1, and the inhibitory rate was 81.2%, significantly different from that in the negative control group (P < 0.05).
CONCLUSION: The recombinant plasmid containing VEGF-C siRNA is successfully constructed. RNAi may continually and stably suppress VEGF-C protein expression, which is a potential approach for tumor gene therapy.
- Citation: Zhou HC, Kang CY, Zhang Y, Li JC. Construction and expression of small interfering RNA vector targeting on vascular endothelial growth factor-C. Shijie Huaren Xiaohua Zazhi 2007; 15(13): 1549-1553
- URL: https://www.wjgnet.com/1009-3079/full/v15/i13/1549.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i13.1549
淋巴管生成可以促进肿瘤细胞转移, 血管内皮生成因子-C(vascular endothelial growth factor-C, VEGF-C)属于VEGF家族, 与血管内皮生成因子受体-3结合刺激淋巴管内皮细胞生长和淋巴管生成. 在许多肿瘤如食管癌、胰腺癌、甲状腺癌、胃癌、乳腺癌中, VEGF-C的表达与淋巴结转移密切相关[1-5]. RNA干扰(RNA interference, RNAi)是一种由双链RNA(double-stranded RNA, dsRNA)诱发的同源基因表达沉默, 该技术因其高效且特异的靶基因抑制而在基因功能研究以及肿瘤等疾病的基因治疗中显示出巨大的潜在应用价值. 本研究以小干扰RNA(small interference RNA, siRNA)表达载体为介导, 为胃癌VEGF-C基因靶向RNA干扰治疗的可行性作一初步探讨.
胃癌细胞株SGC-7901为本实验室保存, 胎牛血清购自北京元亨生物公司, LipofectermineTM 2000购自lnvitrogen公司, siRNA表达载体pSilencer3.1为美国Ambion公司产品, 大肠杆菌DH5α、限制性内切酶Hind Ⅲ、BamH Ⅰ、DNA Mark、T4DNA连接酶、TaqDNA聚合酶和胶回收试剂盒均购自TaKaRa公司, G418为Gibco公司产品, 质粒抽提试剂盒购自V-gene公司.
1.2.1 siRNA的设计和合成: 根据Genbank报道的VEGF-C基因的cDNA序列(NM_005429), 参考siRNA设计原则, 利用TaKaRa公司的在线设计软件, 并根据载体pSilencer3.1-H1-neo说明书, 设计2条干扰序列和阴性对照, 通过BLAST软件确定与其他非相关基因无同源性, 具体设计如下: pSilencer3.1-VEGF-C1: OligoCon1: 5'-GATCCGAAGTTCCACCACCAAACATTCAAGAGATGTTTGGTGGTGGAACTTCTTTTTTGGAAA-3', OligoCon2: 5'-AGCTTTTCCAAAAAAGAAGTTCCACCACCAAACATCTCTTGAATGTTTGGTGGTGGAACTTCG-3'; pSiencer3.1-VEGF-C2:OligoCon1: 5'-GATCCGTGTCAGCTAAGGAAAGGATTCAAGAGATCCTTTCCTTAGCTGACACTTTTTTGGAAA-3', OligoCon2: 5'-AGCTTTTCCAAAAAAGTGTCAGCTAAGGAAAGGATCTCTTGAATCCTTTCCTTAGCTGACACG-3'; 阴性对照: OligoCon1: 5'-GATCCGTTCTCCGAACGTGTCACGTTTCAAGAGAACGTGACACGTTCGGAGAATTTTTTGGAAA-3', OligoCon2: 5'-AGCTTTTCCAAAAAAGTGTGTCGTTGTGTCCCTTTCTCTTGAAAAGGGACACAACGACACACG-3' 两端分别带上Hind Ⅲ和BamHⅠ酶切位点, 化学合成siRNA模板, 长度均为63个碱基.
1.2.2 单链DNA片段的退火连接: 每对要退火的两条片段分别取10 μL与退火缓冲液混合, 94 ℃水浴加热4 min, 然后缓慢冷却至室温使其变性生成双链. 退火DNA寡核苷酸模板链的终浓度为100 μmol/L.
1.2.3 酶切和连接反应: 载体pSilencer3.1-neo经BamHⅠ和 Hind Ⅲ双酶切, 酶切产物10 g/L琼脂糖凝胶电泳鉴定, 目的片段清楚, 用UNIQ10柱式DNA回收试剂盒回收并纯化, 将退火片段与经酶切后的载件按摩尔比3:1的比例进行连接反应, 置16 ℃过夜.
1.2.4 重组质粒的转化、筛选和鉴定: 氯化钙法制备DH5α大肠杆菌感受态细菌, 连接产物各取2.5 μL分别接种于200 μL的DH5α感受态细菌中进行转化, 37 ℃平放20 min, 倒置培养10-14 h. 随机挑取LA平板上单菌落, 分别接种于3 mL LA培养液中, 37 ℃ 180 r/min震荡培养过夜, 取1 mL菌液送上海生工生物公司测序鉴定. 质粒中插入片段的测序采用M13Forward primer: (-40): 5'-GTTTTCCCAGTCACGAC-3'; reversr primer: 5'-GAGTTAGCTCACTCATTAGGC-3', 将鉴定证实的细菌扩增培养, 摇至对数生长期, 每0.8 mL过夜培养细菌加0.2 mL无菌甘油, 混匀后-70 ℃冰箱保存.
1.2.5 细胞培养与转染: 人胃癌细胞细胞株SGC7901以含l00 mL/L小牛血清, 青、链霉素各100 U/mL为培养基, 细胞进行常规培养和传代. 使用Lipofenectin2000进行基因转染, 按照说明书进行操作. 转染后24 h传代, 加入G418进行筛选, G418浓度为600 mg/L, 2 wk后挑取单克隆株扩大培养. 获得稳定表达细胞系7901, 分别建立表达pSilencer3.1-VEGF-C1、pSilencer3.1-VEGF-C2和阴性对照pSilencer3.1-VEGF-CN的单克隆胃癌细胞株SGC7901.
1.2.6 Western印迹确定VEGF-CsiRNA的沉默效率: 提取转染细胞系的总蛋白, 以BCA检测定量,总蛋白电泳于10%凝胶后, 电转移于硝酸纤维素膜, 封闭液(5%脱脂奶粉和0.05% Tween20TBS缓冲液)中4 ℃过夜; 1:200 VEGF-C一抗, 室温1 h, TBST洗膜3次, 结合辣根过氧化物酶标记的二抗1 h, TBST洗膜3次, ECL发光. 计算机扫描图像, 测出各条带面积灰度值, 以各组VEGF-C与自身actin灰度值的比作为各组细胞中VEGF-C蛋白的相对含量.
统计学处理 采用美国Biorad公司Quantity One4.0图像分析软件进行扫描分析, SPSS13.0统计软件包进行单因素方差分析, 检验水准α = 0.05.
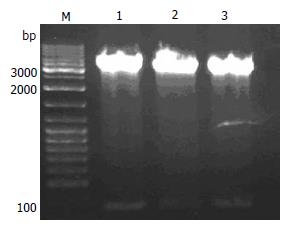
限制性内切酶BamHⅠ和 Hind Ⅲ双酶切pSilencer3.1-neo载体, 然后取5 μL酶切产物在10 g/L的琼脂糖凝胶上进行电泳(图1).
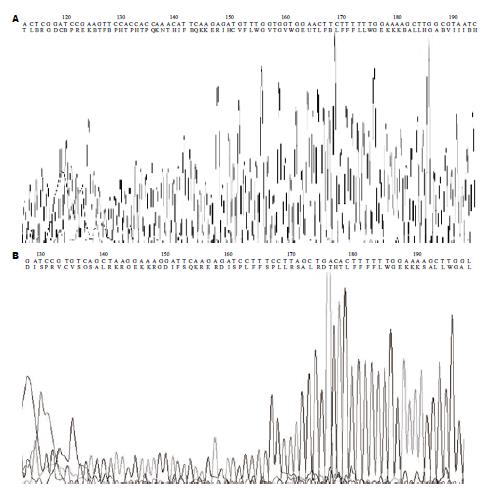
测序结果表明, 合成的寡核苷酸已成功克隆入pSilencer3.1-H1-neo载体, 未发现缺失、突变等插入异常存在, 表明已成功构建了VEGF-C的pSilencer3.1-H1-neo表达质粒分别为pSilencer3.1-VEGF-C1和pSilencer3.1-VEGF-C2(图2).
Western blot检测SGC-7901细胞内VEGF-C蛋白水平, 结果显示pSilencer3.1-VEGF-C1组与pSilencr3.1-VEGF-C2组细胞内VEGF-C蛋白水平下调, 尤以pSilencer3.1-VEGF-C1组抑制效果明显, 其抑制率为81.2%, 与阴性对照组相比差异具有显著性(P<0.05)(图3).
淋巴管系统是许多肿瘤转移的重要途径, 是否伴有淋巴结转移是肿瘤主要的预后指标. Jeltsch et al[6]首次报道VEGF-C转基因小鼠中, VEGF-C过表达能够特异性的诱导淋巴管内皮的增殖和淋巴管的增生. 肿瘤淋巴管生成已在动物实验模型研究中得到证实, 临床病理研究亦显示, 淋巴管生成因子与许多人类原发恶性肿瘤的淋巴结转移显著相关[7-10], VEGFR-3为成人组织中淋巴管内皮的特异性受体, VEGF-C与VEGFR-3结合后通过MEK/ERK和PI3-激酶/Akt途径引起淋巴管内皮细胞增生. VEGF-C与VEGFR-3结合后, 具有强大特异的淋巴管生成作用, 并认为与肿瘤的淋巴道转移有密切关系[11]. 由于VEGF-C与VEGFR-3的高亲和力, 使VEGF-C的促淋巴管生成作用成为主导, 而正是VEGF-C这种独特的淋巴管生成作用使其成为研究者们关注的焦点. 如何有效抑制VEGF-C基因在转录和翻译水平的表达, 成为治疗淋巴结转移的关键. 现在抑制基因表达的方法有多种, 如反义核酸法、核酶法、基因敲除以及最近提出的RNA干扰方法. 在哺乳动物细胞的RNA干扰研究中, siRNAs主要有以下几种方法生成: 体外化学合成、体外转录以及用质粒或病毒表达载体在细胞内直接生成siRNAs等几种方式. 其中通过质粒等表达载体在细胞内直接转录siRNAs不仅具有经济和容易操作等优点, 更重要的是可以通过建立稳定地表达siRNAs的细胞克隆而达到延长RNA干扰的效应. 本研究所构建的质粒pSilencer3.1是通过体内转录的方式生成发夹状双链RNA分子, 然后通过Dicer酶生成siRNAs分子从而引发基因沉默. 该质粒采用H1启动子, H1启动子属于RNA聚合酶Ⅲ启动子, 能够在哺乳动物细胞中指导合成发夹状双链RNA分子, 诱导基因特异性沉默. Paddison et al[12]发现, 短发夹状RNA(short hairpin RNA, shRNA)可以在哺乳动物细胞中调控基因的表达, 用带有RNA聚合酶Ⅲ启动子并表达shRNA的表达载体转染细胞后, 细胞能产生长期稳定的基因沉默[13-15].
通过限制性酶切和基因测序鉴定证实本实验成功构建了靶向VEGF-C基因的真核表达载体, 转染胃癌细胞株SGC-7901, 我们应用Western blot在蛋白水平上检测其抑制效率以筛选有效的抑制序列, 结果显示所设计的两组shRNA片段对VEGF-C表达的抑制作用各不相同, 以第一对抑制效果最为明显为81.2%, 而第二抑制作用较弱, 抑制效率为17.5%, 进一步说明了RNAi的高效性和特异性. 为进一步从整体水平研究VEGF-C基因的功能提供了保证.
胃癌是世界上最常见的肿瘤之一,淋巴结转移是其主要的转移方式,探索其治疗方法具有重要的应用价值. 淋巴结转移与淋巴管生成密切, VEGF-C是重要的促淋巴管生长的细胞因子, 抑制VEGF-C的表达或阻断与其受体的结合是防止肿瘤淋巴管转移的主要方法, RNA干扰作为特异性阻断基因表达的新方法, 已应用于基因功能、肿瘤等的研究.
本试验通过RNA干扰的方法抑制人胃癌细胞株VEGF-C的表达,并获得成功, 具有一定的创新性.
利用RNA干扰抑制VEGF-C的表达, 为进一步阐明VEGF-C的作用机制和预防淋巴结转移提供了方法和途径, 有着十分重要的理论和实践意义.
siRNA: 小干扰RNA: 一种短片段双链RNA分子, 能够以同源互补序列的mRNA为靶目标降解特定的mRNA,这个过程就是RNA干扰途径(RNA interference pathway).
本文进行VEGF-C基因靶向RNA干扰重组表达载体的构建和表达. 总体设计合理, 方法得当, 结果基本可靠, 有一定的实际指导意义.
电编: 郭海丽 编辑:王晓瑜
| 1. | Ding MX, Lin XQ, Fu XY, Zhang N, Li JC. Expression of vascular endothelial growth factor-C and angiogenesis in esophageal squamous cell carcinoma. World J Gastroenterol. 2006;12:4582-4585. [PubMed] [DOI] |
| 2. | Yu XM, Lo CY, Chan WF, Lam KY, Leung P, Luk JM. Increased expression of vascular endothelial growth factor C in papillary thyroid carcinoma correlates with cervical lymph node metastases. Clin Cancer Res. 2005;11:8063-8069. [PubMed] [DOI] |
| 3. | Tang RF, Wang SX, Peng L, Wang SX, Zhang M, Li ZF, Zhang ZM, Xiao Y, Zhang FR. Expression of vascular endothelial growth factors A and C in human pancreatic cancer. World J Gastroenterol. 2006;12:280-286. [PubMed] [DOI] |
| 4. | Yonemura Y, Endo Y, Tabata K, Kawamura T, Yun HY, Bandou E, Sasaki T, Miura M. Role of VEGF-C and VEGF-D in lymphangiogenesis in gastric cancer. Int J Clin Oncol. 2005;10:318-327. [PubMed] [DOI] |
| 5. | Koyama Y, Kaneko K, Akazawa K, Kanbayashi C, Kanda T, Hatakeyama K. Vascular endothelial growth factor-C and vascular endothelial growth factor-d messenger RNA expression in breast cancer: association with lymph node metastasis. Clin Breast Cancer. 2003;4:354-360. [PubMed] [DOI] |
| 6. | Jeltsch M, Kaipainen A, Joukov V, Meng X, Lakso M, Rauvala H, Swartz M, Fukumura D, Jain RK, Alitalo K. Hyperplasia of lymphatic vessels in VEGF-C transgenic mice. Science. 1997;276:1423-1425. [PubMed] [DOI] |
| 7. | Van Trappen PO, Pepper MS. Lymphatic dissemination of tumour cells and the formation of micrometastases. Lancet Oncol. 2002;3:44-52. [PubMed] [DOI] |
| 8. | Shintani S, Li C, Ishikawa T, Mihara M, Nakashiro K, Hamakawa H. Expression of vascular endothelial growth factor A, B, C, and D in oral squamous cell carcinoma. Oral Oncol. 2004;40:13-20. [PubMed] [DOI] |
| 9. | Taniguchi K, Iida T, Hori T, Yagi S, Imai H, Shiraishi T, Uemoto S. Impact of lymph node micrometastasis in hilar bile duct carcinoma patients. World J Gastroenterol. 2006;12:2549-2555. [PubMed] [DOI] |
| 10. | Kitadai Y, Kodama M, Cho S, Kuroda T, Ochiumi T, Kimura S, Tanaka S, Matsumura S, Yasui W, Chayama K. Quantitative analysis of lymphangiogenic markers for predicting metastasis of human gastric carcinoma to lymph nodes. Int J Cancer. 2005;115:388-392. [PubMed] [DOI] |
| 11. | Skobe M, Hawighorst T, Jackson DG, Prevo R, Janes L, Velasco P, Riccardi L, Alitalo K, Claffey K, Detmar M. Induction of tumor lymphangiogenesis by VEGF-C promotes breast cancer metastasis. Nat Med. 2001;7:192-198. [PubMed] [DOI] |
| 12. | Paddison PJ, Caudy AA, Sachidanandam R, Hannon GJ. Short hairpin activated gene silencing in mammalian cells. Methods Mol Biol. 2004;265:85-100. [PubMed] [DOI] |
| 13. | Paddison PJ, Caudy AA, Bernstein E, Hannon GJ, Conklin DS. Short hairpin RNAs (shRNAs) induce sequence-specific silencing in mammalian cells. Genes Dev. 2002;16:948-958. [PubMed] [DOI] |
| 14. | Paul CP, Good PD, Winer I, Engelke DR. Effective expression of small interfering RNA in human cells. Nat Biotechnol. 2002;20:505-508. [PubMed] [DOI] |