修回日期: 2007-01-14
接受日期: 2007-01-27
在线出版日期: 2007-05-08
目的: 研究温胃舒、养胃舒对产毒幽门螺杆菌(H. pylori)浓缩培养上清液(concentrated culture supernatant, CCS)所致小鼠胃黏膜损伤的保护作用.
方法: 75只健康♂BALB/c小鼠随机分成5组: 生理盐水组(Ⅰ组)、单纯损伤组(Ⅱ组)、硫糖铝保护组(Ⅲ组)、温胃舒保护组(Ⅳ组)、养胃舒保护组(Ⅴ组). 分别用生理盐水(Ⅰ、Ⅱ组)、硫糖铝(Ⅲ组)和温胃舒(Ⅳ组)及养胃舒(Ⅴ组)提前给小鼠灌胃, 然后用生理盐水(Ⅰ组)及产毒H. pylori菌CCS灌胃(Ⅱ、Ⅲ、Ⅳ、Ⅴ组)灌胃, 在光镜及电镜下观察胃黏膜组织学改变, 分别测定各组胃黏膜上皮损伤积分(EDS), 以评价胃黏膜损伤程度及药物的预防保护效果.
结果: 单纯损伤组在组织病理和超微结构水平产生明显损害, 保护组胃黏膜损害较单纯损伤组明显减轻. Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ组的胃黏膜EDS依次为1.18±0.31, 2.47±0.58, 1.72±0.73, 1.61±0.73, 1.56±0.67. 单纯损伤组胃黏膜EDS明显高于生理盐水对照组(P<0.05); 温胃舒、养胃舒保护组与硫糖铝保护组胃黏膜EDS明显低于单纯损伤组(P<0.05), 各保护组之间比较EDS无显著性差异(P>0.05).
结论: 温胃舒、养胃舒对H. pylori培养上清液所致的小鼠胃黏膜损伤有明显的预防和保护作用.
引文著录: 牟方宏, 胡伏莲, 杨桂彬. 温胃舒、养胃舒预防幽门螺杆菌培养上清液所致小鼠胃黏膜损伤. 世界华人消化杂志 2007; 15(13): 1505-1509
Revised: January 14, 2007
Accepted: January 27, 2007
Published online: May 8, 2007
AIM: To evaluate the effect of traditional Chinese medicine Wenweishu and Yangweishu on gastric mucosal injury induced by H. pylori concentrated culture supernatant (CCS) in BALB/c mice.
METHODS: Seventy-five BALB/c mice were divided into group A, B, C, D and E. The mice in group A and B were treated with normal saline, and those in group C, D and E were treated intragastrically with sucralfate, Wenweishu and Yangweishu, respectively, in advance. Then the mice in group A served as normal controls, and gastric mucosal lesions were induced by intragastric administration of H. pylori CCS in the other four groups. The gastric mucosal changes were assessed by microscopic examination, quantitative histology and electron microscopy.
RESULTS: Histology and ultrastructure were remarkably damaged in group B, but they were obviously alleviated in group C, D and E. The epithelial damage scores (EDS) were 1.18 ± 0.31, 2.47 ± 0.58, 1.72 ± 0.73, 1.61 ± 0.73 and 1.56 ± 0.67 in group A, B, C, D and E, respectively. The value of EDS in group B was markedly higher than that in group A (P < 0.05); the values of EDS in group C, D and E were significantly lower than those in group B (all P < 0.05). There were no evident difference between group C, D and E (P > 0.05).
CONCLUSION: Wenweishu and Yangweishu as well as sucralfate can reduce gastric mucosal lesions induced by H. pylori CCS in mice.
- Citation: Mu FH, Hu FL, Yang GB. Protective effects of traditional Chinese medicine Wenweishu and Yangweishu against gastric mucosal lesions induced by Helicobacter pylori concentrated culture supernatant in mice. Shijie Huaren Xiaohua Zazhi 2007; 15(13): 1505-1509
- URL: https://www.wjgnet.com/1009-3079/full/v15/i13/1505.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i13.1505
温胃舒和养胃舒对各种"胃病"的疗效得到了长期和广泛的临床验证, 但是对其疗效的观察和治疗机制的解释大都是在传统医学的范畴中进行的, 缺乏现代医学以及符合现代医学原则的动物实验的证据支持. H. pylori感染是慢性胃炎、胃溃疡、胃癌及胃黏膜组织相关性淋巴瘤(MALT)等胃黏膜疾病最重要的病因[1-3]. 有关温胃舒及养胃舒对H. pylori相关性胃炎的治疗效果尚未见报道. 本研究通过H. pylori毒素所致BALB/c小鼠急性胃黏膜损伤模型, 研究温胃舒、养胃舒对H. pylori毒素所致的胃黏膜损伤是否有保护作用.
实验动物为健康SPF级♂BALB/c小鼠75只, 体质量20±2 g, 北京大学医学部动物实验室提供. 菌株为复苏固体培养传代的H. pylori NCTC11637标准菌株. 温胃舒及养胃舒原药由合肥神鹿制药公司提供, 硫糖铝由协和药业有限公司提供.
1.2.1 H. pylori培养及浓缩培养上清液(concentrated culture supernatant, CCS)制备: 参照Leunk et al[4]的方法, 标准产毒菌NCTC11637接种于固体培养基上, 在37 ℃微需氧条件下培养3-7 d. 用无菌接种环挑取适量H. pylori菌落, 接种于液体培养基中, 松瓶盖, 在CO2培养箱(37 ℃)放置2 h, 然后盖紧瓶口, 置于恒温振荡器上(37 ℃, 140-150 r/min)培养48-72 h. 液体培养基离心后加等量饱和硫酸铵溶液沉淀上清, 留集沉淀, 加入0.1 mol/L PBS稀释, 用0.22 mm的滤膜过滤除菌, 分装保存于-70 ℃冰箱备用. 取固体培养菌落及液体培养沉淀, 分别进行革兰染色、尿素酶试验、过氧化氢试验等, 证明无杂菌生长后留取CCS. 用考马斯亮兰法在紫外分光光度计上测定H. pylori培养上清液的蛋白含量.
1.2.2 实验动物分组: 75只小鼠随机分为5组, 每组15只, 分别为生理盐水组(Ⅰ组)、单纯损伤组(Ⅱ组)、硫糖铝保护组(Ⅲ组)、温胃舒保护组(Ⅳ组), 养胃舒保护组(Ⅴ组). 所有动物实验前禁食12 h, 可自由饮水; Ⅰ、Ⅱ组分别予生理盐水(每只0.25 mL), Ⅲ组予硫糖铝(每只0.25 mL, 含15 mg), Ⅳ组和Ⅴ组分别予温胃舒和养胃舒(每只0.25 mL, 含20 mg)灌胃, 12 h后上述药物同样剂量重复灌胃1次, 第2次灌胃0.5 h后Ⅰ组予生理盐水(每只0.25 mL), 其他4组分别予H. pylori的CCS(每只0.25 mL, 含100 mg)灌胃, 2 h后进食. 48 h后将小鼠断颈处死(处死前一晚禁食), 立即开腹取胃, 沿胃大弯侧剪开胃壁, 在胃窦小弯侧剪下1块组织放置于40 g/L甲醛溶液中固定, 石蜡包埋, 制成4-6 mm厚的切片进行HE染色. 每组各取2只在胃窦部剪下0.1 cm×0.1 cm黏膜组织块置于20 g/L戊二醛中, 制成电镜标本.
1.2.3 组织学及超微结构观察: 光镜下胃黏膜组织形态学改变以表皮损伤积分(epithelial damage scoring, EDS)[5]评估: 黏膜正常为1分, 黏膜表层细胞受损为2分, 损伤累及腺体细胞为3分, 黏膜糜烂、出血或溃疡形成为4分. 电镜下观察超微结构改变.
统计学处理 所有数据使用SPSS11.0进行处理, 各组胃黏膜EDS采用mean±SD表示, 组间比较采用方差分析, P<0.05表示差异有显著性.
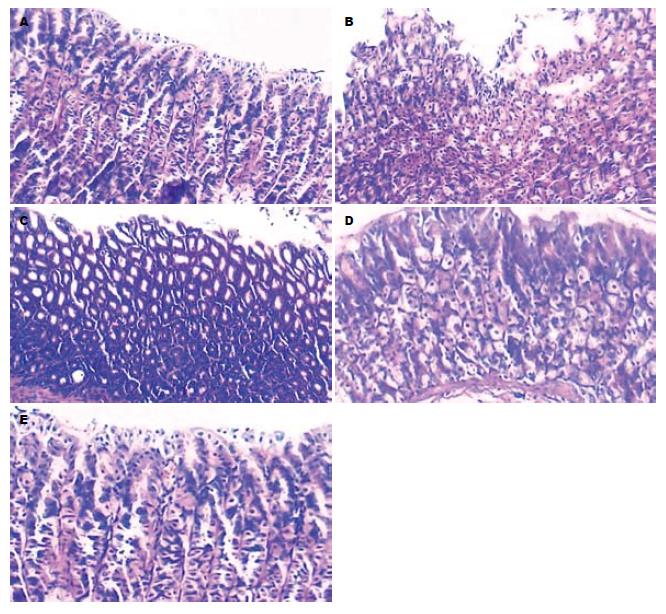
Ⅰ组黏膜层、固有层、肌层结构完整连续, 依次排列, 腺体排列紧密, 极少炎症细胞浸润(图1A). Ⅱ组小鼠胃黏膜上皮细胞可见大量的空泡, 部分上皮细胞及腺体排列紊乱, 有的腺体结构被完全破坏(图1B), 7只发现糜烂, 但炎症细胞浸润不明显, 其中3只发现溃疡, 2只在胃黏膜固有层内见到灶性出血. 硫糖铝及温胃舒和养胃舒保护组损伤情况明显较单纯损伤组为轻. 结构连续, 上皮细胞排列整齐, 炎症细胞浸润不明显, 未见靡烂及溃疡(图1C-E). 温胃舒保护组偶见表层黏膜上皮细胞损伤, 少量上皮细胞里有空泡.
Ⅰ组小鼠的超微结构可见细胞排列紧密, 细胞器结构完整, 微绒毛排列整齐, 可见到正常的分泌颗粒及黏液颗粒(图2A). Ⅱ组小鼠细胞间隙明显增宽, 微绒毛稀疏、脱落, 线粒体和内质网高度肿胀扩张, 基本结构不清楚, 有的形成空泡(图2B). 各保护组小鼠的超微结构见细胞排列比较紧密, 细胞器结构基本完整, 可以看到微绒毛(图2C-E).
各组胃黏膜EDS(mean±SD, n = 15)分别为:Ⅰ组: 1.18±0.31; Ⅱ组: 2.47±0.58; Ⅲ组: 1.72±0.73; Ⅳ组: 1.61±0.73; Ⅴ组: 1.56±0.67. Ⅱ组损伤积分(2.47±0.58)明显高于Ⅰ组(1.18±0.31)(P<0.05), 各保护组的损伤积分均明显低于单纯损伤组(P<0.05); 而硫糖铝与温胃舒和养胃舒保护组比较, 胃黏膜损伤程度均无明显差异(P>0.05). 养胃舒保护组表皮损伤积分略低于温胃舒保护组, 二者无统计学差异(P>0.05).
H. pylori毒素是H. pylori最重要的致病因子[6-13], 单纯用H. pylori培养上清液灌胃即可使小鼠产生明显的胃黏膜损伤[14-20]. 孙兆金 et al[21]应用产毒H. pylori菌株的CCS灌服Balb/c小鼠, 观察到黏膜上皮细胞产生了大量的空泡、腺体结构排列紊乱, 黏膜见糜烂、溃疡形成. 超微结构发现细胞质肿胀变性, 微绒毛排列紊乱、脱落, 细胞间隙增宽, 吞噬溶酶体增多等改变, 而非产毒株的CCS却没有引起相应的损伤, 说明胃黏膜上皮损伤是由H. pylori培养上清液里的空泡毒素导致的, 表明H. pylori毒素可致胃黏膜病理损伤. 这些损伤改变与文献报道类似, 提示细胞毒素在导致胃黏膜病变方面起重要作用[21-23].
我们以前的研究表明, 替普瑞酮及其他胃黏膜保护剂可以预防H. pylori所致的小鼠胃黏膜损伤[24-25]. 温胃舒和养胃舒是否对H. pylori毒素所致的胃黏膜损伤有预防保护作用, 目前国内外尚无类似报道. 在本研究中利用H. pylori浓缩培养上清液所致小鼠胃黏膜损伤模型对温胃舒和养胃舒的黏膜保护作用进行了初步探讨, 结果显示温胃舒和养胃舒保护组小鼠胃黏膜各层组织排列完整连续, 损伤情况较单纯损伤组明显减轻, 偶见表层黏膜上皮细胞损伤, 未见糜烂、溃疡、出血灶, 炎症细胞浸润不明显, 其超微结构也基本正常. 胃黏膜损伤积分明显低于单纯损伤组, 与硫糖铝保护组无明显差异. 本研究提示温胃舒和养胃舒颗粒对H. pylori毒素所致胃黏膜损伤具有明显的预防保护作用. 胃黏膜屏障防御因素包括黏膜、黏液屏障、黏液及碳酸氢盐的分泌、黏膜血流、细胞更新、生长抑素、表皮生长因子、前列腺素、氨基己糖、NO、巯基等[26-32]. 温胃舒和养胃舒通过上述何种因素预防H. pylori培养上清所致的胃黏膜损伤尚有待进一步研究.
"一病两药, 分型论治"是温胃舒和养胃舒治疗慢性胃炎的一个突破. 即"胃寒要用温胃舒, 胃热要用养胃舒". 临床上对H. pylori相关的慢性胃炎患者要根据每个患者的征候个体化辨证, 给予不同的治疗. 在动物实验中, 不能进行征候辨证, 对H. pylori毒素所致的胃黏膜损伤究竟归于胃寒还是胃热意见不一致. 在本研究中, 温胃舒和养胃舒对H. pylori培养上清所致小鼠胃黏膜损伤都有较好的预防作用. 虽然养胃舒黏膜损伤指数稍低于温胃舒, 但是二者差别H. pylori统计学意义. 提示对H. pylori感染相关性胃炎, 无论其征候辨证属于胃寒还是胃热, 温胃舒和养胃舒都可以明显改善其黏膜病变. 本研究结果提示无论温胃舒或养胃舒对H. pylori所致的胃黏膜损伤有明显的预防和保护作用.
温胃舒和养胃舒对各种"胃病"的疗效得到了长期和广泛的临床验证, 但是对其疗效的观察和治疗机制的解释大都是在传统医学的范畴中进行的, 缺乏现代医学以及符合现代医学原则的动物实验的证据支持. H. pylori感染是慢性胃炎、胃溃疡、胃癌及胃黏膜组织相关性(MALT)淋巴瘤等胃黏膜疾病最重要的病因. 有关温胃舒及养胃舒对H. pylori相关性胃炎的治疗效果尚未见报道.
本文运用动物实验, 对中成药在上消化道疾病的作用机制进行了探讨. 文章实验设计严密, 结论明确,统计学处理恰当,较好地为中药在胃肠疾病临床科研方面提供尝试. 文章的科学性、创新性值得参考.
电编: 张敏 编辑:张焕兰
| 3. | Malfertheiner P, Megraud F, O'morain C, Bazzoli F, El-Omar E, Graham D, Hunt R, Rokkas T, Vakil N, Kuipers EJ. Current concepts in the management of Helicobacter pylori infection: the Maastricht III Consensus Report. Gut. 2007;56:772-781. [PubMed] [DOI] |
| 4. | Leunk RD, Johnson PT, David BC, Kraft WG, Morgan DR. Cytotoxic activity in broth-culture filtrates of Campylobacter pylori. J Med Microbiol. 1988;26:93-99. [PubMed] [DOI] |
| 5. | Genta RM, Lew GM, Graham DY. Changes in the gastric mucosa following eradication of Helicobacter pylori. Mod Pathol. 1993;6:281-289. [PubMed] |
| 6. | Kudo T, Lu H, Wu JY, Ohno T, Wu MJ, Genta RM, Graham DY, Yamaoka Y. Pattern of transcription factor activation in Helicobacter pylori-infected Mongolian gerbils. Gastroenterology. 2007;132:1024-1038. [PubMed] [DOI] |
| 7. | Takata S, Ito M, Yoshihara M, Tanaka S, Imagawa S, Haruma K, Chayama K. Host factors contributing to the discovery of gastric cancer after successful eradication therapy of Helicobacter pylori: preliminary report. J Gastroenterol Hepatol. 2007;22:571-576. [PubMed] [DOI] |
| 8. | Pimanov SI, Makarenko EV, Krylov IuV, Matveenko ME, Malashenko SV, Bondarenko VM. Impact of Helicobacter pylori eradication on morphological changes in gastric mucosa. Arkh Patol. 2006;68:22-27. [PubMed] |
| 9. | Murakami K, Kodama M, Sato R, Okimoto T, Watanabe K, Fujioka T. Helicobacter pylori eradication and associated changes in the gastric mucosa. Expert Rev Anti Infect Ther. 2005;3:757-764. [PubMed] [DOI] |
| 10. | Schneller J, Gupta R, Mustafa J, Villanueva R, Straus EW, Raffaniello RD. Helicobacter pylori infection is associated with a high incidence of intestinal metaplasia in the gastric mucosa of patients at inner-city hospitals in New York. Dig Dis Sci. 2006;51:1801-1809. [PubMed] [DOI] |
| 11. | Murakami K, Kodama M, Fujioka T. Latest insights into the effects of Helicobacter pylori infection on gastric carcinogenesis. World J Gastroenterol. 2006;12:2713-2720. [PubMed] [DOI] |
| 12. | Fiocca R, Villani L, De Giacomo C, Perego M, Trespi E, Solcia E. Morphological evidence of Campylobacter pylori pathogenicity in chronic gastritis and peptic ulcer. Acta Gastroenterol Belg. 1989;52:324-335. [PubMed] |
| 13. | Wang X, Willen R, Svensson M, Ljungh A, Wadstrom T. Two-year follow-up of Helicobacter pylori infection in C57BL/6 and Balb/cA mice. APMIS. 2003;111:514-522. [PubMed] [DOI] |
| 14. | Handa O, Naito Y, Yoshikawa T. CagA protein of Helicobacter pylori: a hijacker of gastric epithelial cell signaling. Biochem Pharmacol. 2007;73:1697-1702. [PubMed] [DOI] |
| 19. | D'Elios MM, Montecucco C, de Bernard M. VacA and HP-NAP, Ying and Yang of Helicobacter pylori-associated gastric inflammation. Clin Chim Acta. 2007;381:32-38. [PubMed] [DOI] |
| 20. | Ghiara P, Marchetti M, Blaser MJ, Tummuru MK, Cover TL, Segal ED, Tompkins LS, Rappuoli R. Role of the Helicobacter pylori virulence factors vacuolating cytotoxin, CagA, and urease in a mouse model of disease. Infect Immun. 1995;63:4154-4160. [PubMed] |
| 21. | 孙 兆金, 胡 伏莲. 幽门螺杆菌的培养上清液诱发鼠胃粘膜组织学损伤的研究. 胃肠病学和肝病学杂志. 1998;7:219-221. |
| 22. | Pai R, Sasaki E, Tarnawski AS. Helicobacter pylori vacuolating cytotoxin (VacA) alters cytoskeleton-associated proteins and interferes with re-epithelialization of wounded gastric epithelial monolayers. Cell Biol Int. 2000;24:291-301. [PubMed] [DOI] |
| 26. | Aase S. Disturbances in the balance between aggressive and protective factors in the gastric and duodenal mucosa. Scand J Gastroenterol Suppl. 1989;163:17-23. [PubMed] [DOI] |
| 28. | West SD, Mercer DW. Cholecystokinin-induced gastroprotection: a review of current protective mechanisms. Dig Dis Sci. 2004;49:361-369. [PubMed] [DOI] |
| 29. | Martin MJ, Jimenez MD, Motilva V. New issues about nitric oxide and its effects on the gastrointes-tinal tract. Curr Pharm Des. 2001;7:881-908. [PubMed] [DOI] |
| 30. | Hojgaard L, Mertz Nielsen A, Rune SJ. Peptic ulcer pathophysiology: acid, bicarbonate, and mucosal function. Scand J Gastroenterol Suppl. 1996;216:10-15. [PubMed] [DOI] |
| 31. | Allen A, Flemstrom G, Garner A, Kivilaakso E. Gastroduodenal mucosal protection. Physiol Rev. 1993;73:823-857. [PubMed] |
| 32. | Hudson N, Hawthorne AB, Cole AT, Jones PD, Hawkey CJ. Mechanisms of gastric and duodenal damage and protection. Hepatogastroenterology. 1992;39 Suppl 1:31-36. [PubMed] |