修回日期: 2007-02-06
接受日期: 2007-02-12
在线出版日期: 2007-04-28
目的: 克隆幽门螺杆菌(H. pylori )NCTC 11637 cagT(HP0532)的编码基因, 并分析其核苷酸序列.
方法: 应用PCR技术从H. pylori基因组DNA中扩增cagT编码基因片段, 克隆至pGEM-T载体后, 再将其定向插入pQE30载体中, 双酶切鉴定筛选阳性克隆, 并进行序列分析.
结果: NCTC 11637 cagT基因全长843 bp(GenBank登录号为EF114758), 编码280个氨基酸, 与GenBank公布的其他H. pylori菌株基因序列的核苷酸同源性为97%-99%.
结论: 成功克隆了cagT基因, 为进一步研究其生物学功能奠定了基础.
引文著录: 崔蕾蕾, 邵世和. 幽门螺杆菌NCTC 11637 cagT基因的克隆及序列分析. 世界华人消化杂志 2007; 15(12): 1433-1436
Revised: February 6, 2007
Accepted: February 12, 2007
Published online: April 28, 2007
AIM: To clone and analyze H. pylori cagT gene.
METHODS: H. pylori cagT gene was amplified from the genome DNA by polymerase chain reaction (PCR). The PCR product was inserted into pGEM-T vector and then transformed into E.coli DH5α. The positive recombinant clone was analyzed by digestion of restriction endonuclease. Next, the cagT gene fragment was inserted directionally into vector pQE30 to construct recombinant clone of cagT, which was sequenced finally.
RESULTS: A cagT gene consisting of 843 base pairs, which encoded a product of 280 amino acids, was obtained using PCR method and was cloned into pGEM-T vector successfully. Its GenBank accession number was EF114758. Sequence analysis showed that cagT gene had shared 97%-99% homology with other strains in GenBank.
CONCLUSION: The correct cagT gene is successfully cloned, which established a basis for further investigation of its biological function.
- Citation: Cui LL, Shao SH. Cloning and sequence analysis of Helicobacter pylori NCTC 11637 cagT gene. Shijie Huaren Xiaohua Zazhi 2007; 15(12): 1433-1436
- URL: https://www.wjgnet.com/1009-3079/full/v15/i12/1433.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i12.1433
幽门螺杆菌(H. pylori)感染在世界范围内广泛流行. 已证实H. pylori感染是慢性胃炎和消化性溃疡的重要病因, 与胃癌和胃黏膜相关性淋巴样组织(MALT)恶性淋巴瘤的发病也有密切关系[1-2]. H. pylori的cagT/H. pylori 0532由cag致病岛编码, Rohde et al[3]用激光共聚焦扫描电镜和免疫场致发射扫描电镜技术发现, H. pylori的cagT定位于H. pylori的外膜上, 分布在细菌表面纤毛样结构的基底部, 推测其可能是分泌素或是与分泌素相关的脂蛋白(引导蛋白), 允许H. pylori 0527和针样纤毛结构通过, 并起着稳固其他蛋白的作用. 我们通过克隆H. pylori cagT基因, 构建原核表达载体, 并对其序列进行分析, 旨在为进一步研究cagT基因在H. pylori致病中的作用奠定基础.
H. pylori NCTC11637购自中国预防科学院流行病学研究所, 大肠埃希菌DH5α为江苏大学医学技术学院中心实验室保存. 哥伦比亚培养基、厌氧袋购自OXOID公司; Ex Taq DNA聚合酶、dNTP、限制性核酸内切酶BamHⅠ及Hind Ⅲ、TaKaRa Agarose Gel DNA Purification Kit Ver 2.0、T4DNA连接酶(快速连接试剂盒)、DL2000 DNA Marker购自TaKaRa公司; 1 kb DNA Ladder购自TOYOBO; pGEM-T载体购自Promega公司; pQE30载体由江苏大学医学技术学院中心实验室保存; PCR基因扩增仪(Mastercycler Gracent, Eppendor公司)、自动凝胶成像系统(美国UVP公司), 其他常规试剂按照《分子克隆实验指南》要求配制.
1.2.1 PCR扩增及纯化DNA: 用常规酚、氯仿抽提法获得, -20 ℃保存备用. 根据GenBank中已报道的H. pylori 26695 NC_000915的HP0532基因 (cagT基因)序列, 利用软件Primer Premier5.0设计PCR引物: P1: 5'-TCCGGATCCATGAAAGTGAGAGCAAGTGT-3'(29 bp); P2: 5'-GCCAAGCTTTCACTTACCACTGAGCAAAC-3'(29 bp). 在上游引物P1 5'端加BamH Ⅰ酶切位点; 在下游引物P2 5'端加Hind Ⅲ酶切位点. 预期的PCR产物长度为843 bp. 引物由上海生工生物技术有限公司合成. 用Ex Taq DNA聚合酶进行PCR扩增(在25 μL反应体系中, 分别加入dNTP 2 μL、Mg2+ 1.5 μL、10×Buffer(Mg2+阴性)2.5 μL、DNA模板1 μL、浓度为20 μmol/L的P1和P2引物各0.7 μL、Ex Taq DNA聚合酶0.2 μL, 按照PCR条件扩增), 其扩增参数为: 94 ℃预变性5 min后, 按94 ℃ 30 s、55.4 ℃ 30 s、72 ℃ 1 min, 30个循环, 最后72 ℃延伸10 min. PCR产物经10 g/L琼脂糖凝胶电泳, EB染色, Genius凝胶电泳图像分析系统分析鉴定.
1.2.2 TA克隆及鉴定: 胶回收试剂盒回收目的片段, 胶回收PCR产物与pGEM-T载体(摩尔比8:1), 加1 μL T4DNA连接酶, 4 ℃连接过夜. 连接产物转化DH5α感受态细胞. 转化后的细菌涂布于含50 mg/L氨苄青霉素的LB平板上, 37 ℃培养16 h. 挑取菌落转种于含氨苄青霉素50 mg/L的LB液体培养基, 37 ℃振摇12 h, 用碱裂解法进行质粒小量提取, 并进行BamH Ⅰ、Hind Ⅲ双酶切鉴定和质粒PCR鉴定.
1.2.3 重组质粒的构建: 将质粒pQE30和TA克隆鉴定阳性的质粒经BamH Ⅰ和Hind Ⅲ双酶切, 回收酶切片段, T4连接酶试剂盒作用下16 ℃连接过夜, 转化宿主菌DH5α, 双酶切鉴定筛选出阳性克隆.
1.2.4 DNA序列测定与分析: 将经过鉴定的阳性重组质粒寄至上海生工生物技术有限公司测序. 测序结果通过GenBank进行同源性比较分析.
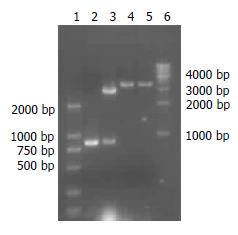
PCR结果发现在843 bp左右有一条带, 与预计大小一致, 无非特异性条带(图1).
将PCR产物与pGEM-T载体连接产物转化至DH5α, 随机挑取菌落, 抽提质粒, 双酶切产物电泳后, 阳性克隆出现的两条带分别位于3003 bp和843 bp处 (图2).
重组质粒pQE30-cagT经BamHⅠ和Hind Ⅲ双酶切鉴定结果(图3).
将经鉴定后的重组质粒送往上海生工生物技术有限公司进行核苷酸序列测定, DNA测序结果表明, 构建的重组质粒上的cagT长度为843 bp, 与设计序列大小完全一致, GenBank登录号为EF114758, 将其测序结果通过GenBank与已知的两种国际标准菌株H. pylori 26695和J99的HP0532基因的核苷酸序列进行比对, 与26695菌株的HP0532比较, 同源性为97%(822/843), 与J99菌株的cagT比较, 同源性为97%(826/843), 碱基总数相同. 而与Censini et al[4]报道(GenBank 登录号: AF282852)的几乎一致, 同源性高达99%(841/843).
H. pylori是定植于人胃部特定的病原菌, 感染呈全球分布, 感染率高达50%以上. 现已证实他是轻度胃炎, 消化性溃疡及胃癌的主要病因. 导致严重胃部疾病的H. pylori菌株中含有一个cag致病岛(cytotoxin associated gene pathogenicity island, cag PAI). cag致病岛是一个约40 kb的特殊基因片段, 该片段只出现于致病相关菌株, 可有部分或全部丢失等不稳定表现, G+C含量与H. pylori整个染色体DNA的平均含量不同, 其侧面为两个31 bp的直接重复序列, 并有插入序列(IS)元件的出现, 随着cag致病岛的分割及缺失, H. pylori的毒力梯度呈下降趋势. cag致病岛基因呈高密度分布并编码一个分泌转运系统(type IV secretion system, TFSS). 根癌农杆菌(Agrobacterium tumefaciens)的VirB-VirD系统或称Ti-DNA输送系统被公认为是TFSS的标准, 他是由virB操纵子的产物(VirB1-VirB11蛋白)和virD4基因编码的产物VirD4装配而成, 形成跨膜通道将蛋白直接注入宿主细胞内[5]. Tanaka et al[6]认为H. pylori的TFSS装置是一个丝状的大分子结构, 伸出细菌外膜的表面. 在H. pylori中, TFSS组分包括定位于内膜的ATPases即HP0544/CagE和HP0525/Cagα, 以及偶联蛋白HP0524/Cagβ, 他们分别是VirB4、VirB11及VirD4的同源物, 为装运底物提供能量. HP0523可能与VirB1的功能相似, 可能是一个糖基转移酶, 切断肽聚糖, 使得TFSS装置能够横跨细菌细胞壁[3,7]. 跨膜通道本身连接内外膜, 由HP0529/VirB6, HP0532(CagT)/VirB7, HP0530/VirB8, HP0528(CagX)/VirB9和HP0527/VirB10组成, 一般认为HP0530/VirB8和HP0527/VirB10形成转运装置的核心, 可能跨越内外膜形成一个孔道. HP0529/VirB6有多层跨膜螺旋, 与HP0530/VirB8和HP0527/VirB10形成内膜复合体. HP0528/VirB9与脂蛋白HP0532/VirB7形成外膜复合体. Tanaka et al[6]用免疫金电镜技术发现, VirB7和VirB9的同系物HP0532/cagT和 HP0528/CagX沿着菌毛的长度定植, 而Rohde et al[3]描述HP0532/cagT在菌毛的基部环形分布. 在根癌农杆菌中, VirB7其自身稳定是通过cys-24形成二硫键交联的同型二聚体, VirB9的cys-262与VirB7的cys-24间形成二硫键交联的异型二聚体, 然后与内膜蛋白VirB8和VirB10作用形成装运装置孔道, 其VirB7在形成转运装置的过程中, 介导菌毛与通道的核心复合物VirB8-VirB9-VirB10的连接, 对稳定其他VirB蛋白起着关键的作用[8-12]. HP0546是TFSS伸出细菌表面菌毛样结构的主要成分, 其作用可能是建立细菌和宿主细胞的接触[13]. 目前认为, 由cag致病岛编码的蛋白构成的细菌IV型分泌系统(TFSS), 通过转运细胞相关毒素CagA而参与H. pylori诱导上皮细胞内的酪氨酸磷酸化、细胞骨架重排、基垫结构形成、活化核转录因子NF-κB、诱导促炎细胞因子白细胞介素-8的表达等, 在H. pylori致病中起着关键作用[14-15].
我们从H. pylori NCTC11637菌株中克隆cagT基因并对其DNA序列进行测定, 利用生物信息数据库及生物学软件对cagT基因序列进行同源性分析, 结果表明, cagT基因是一类高度保守的原核型基因, 与H. pylori其他菌株的同源性在97%-99%, 与真核生物无同源序列. 测序结果证实cagT基因克隆成功, 为深入研究其生物学功能及潜在的临床应用前景提供了良好的实验基础.
H. pylori已被证实是慢性胃炎和消化性溃疡的重要病因, 且与胃癌和胃黏膜相关性淋巴样组织(MALT)恶性淋巴瘤的发病也有密切关系,已被IARC/WHO定为I类致癌原. 导致严重胃部疾病的H. pylori菌株中含有一个cag致病岛, 基因呈高密度分布并编码一个分泌转运系统(type IV secretion system, TFSS), 通过转运细胞相关毒素CagA而参与H. pylori诱导上皮细胞内的酪氨酸磷酸化、细胞骨架重排、基垫结构形成、活化核转录因子NF-κB、诱导促炎细胞因子白细胞介素-8的表达等, 在H. pylori致病中起着关键作用.
本文通过对cagT基因的克隆及其序列的核苷酸同源性分析, 发现NCTC 11637 cagT 基因与GenBank 公布的其他H. pylori菌株基因序列的核苷酸同源性为97%-99%, 为进一步研究其生物学功能及其在致病中的作用奠定基础.
本文首次克隆H. pylori NCTC 11637菌株cagT基因全长, 比较其与其他菌株的同源性, 并成功构建了原核表达载体, 为后续的研究工作奠定基础.
本文进行了幽门螺杆菌NCTC 11637 cagT基因的克隆及序列分析, 介绍了有关cag克隆的基因的结果, 方法先进, 结果可信, 有一定的科学性.
电编: 郭海丽 编辑:王晓瑜
| 1. | Cover TL, Blaser MJ. Helicobacter pylori and gastroduodenal disease. Annu Rev Med. 1992;43:135-145. [PubMed] [DOI] |
| 2. | Correa P. Human gastric carcinogenesis: a multistep and multifactorial process--First American Cancer Society Award Lecture on Cancer Epidemiology and Prevention. Cancer Res. 1992;52:6735-6740. [PubMed] |
| 3. | Rohde M, Puls J, Buhrdorf R, Fischer W, Haas R. A novel sheathed surface organelle of the Helicobacter pylori cag type IV secretion system. Mol Microbiol. 2003;49:219-234. [PubMed] [DOI] |
| 4. | Censini S, Lange C, Xiang Z, Crabtree JE, Ghiara P, Borodovsky M, Rappuoli R, Covacci A. cag, a pathogenicity island of Helicobacter pylori, encodes type I-specific and disease-associated virulence factors. Proc Natl Acad Sci USA. 1996;93:14648-14653. [PubMed] [DOI] |
| 5. | Cascales E, Christie PJ. The versatile bacterial type IV secretion systems. Nat Rev Microbiol. 2003;1:137-149. [PubMed] [DOI] |
| 6. | Tanaka J, Suzuki T, Mimuro H, Sasakawa C. Structural definition on the surface of Helicobacter pylori type IV secretion apparatus. Cell Microbiol. 2003;5:395-404. [PubMed] [DOI] |
| 7. | Hoppner C, Liu Z, Domke N, Binns AN, Baron C. VirB1 orthologs from Brucella suis and pKM101 complement defects of the lytic transglycosylase required for efficient type IV secretion from Agrobacterium tumefaciens. J Bacteriol. 2004;186:1415-1422. [PubMed] [DOI] |
| 8. | Fischer W, Puls J, Buhrdorf R, Gebert B, Odenbreit S, Haas R. Systematic mutagenesis of the Helicobacter pylori cag pathogenicity island: essential genes for CagA translocation in host cells and induction of interleukin-8. Mol Microbiol. 2001;42:1337-1348. [PubMed] [DOI] |
| 9. | Spudich GM, Fernandez D, Zhou XR, Christie PJ. Intermolecular disulfide bonds stabilize VirB7 homodimers and VirB7/VirB9 heterodimers during biogenesis of the Agrobacterium tumefaciens T-complex transport apparatus. Proc Natl Acad Sci USA. 1996;93:7512-7517. [PubMed] [DOI] |
| 10. | Aras RA, Fischer W, Perez-Perez GI, Crosatti M, Ando T, Haas R, Blaser MJ. Plasticity of repetitive DNA sequences within a bacterial (Type IV) secretion system component. J Exp Med. 2003;198:1349-1360. [PubMed] [DOI] |
| 11. | Buhrdorf R, Forster C, Haas R, Fischer W. Topological analysis of a putative virB8 homologue essential for the cag type IV secretion system in Helicobacter pylori. Int J Med Microbiol. 2003;293:213-217. [PubMed] [DOI] |
| 12. | Busler VJ, Torres VJ, McClain MS, Tirado O, Friedman DB, Cover TL. Protein-protein interactions among Helicobacter pylori cag proteins. J Bacteriol. 2006;188:4787-4800. [PubMed] [DOI] |
| 13. | Yeo HJ, Waksman G. Unveiling molecular scaffolds of the type IV secretion system. J Bacteriol. 2004;186:1919-1926. [PubMed] [DOI] |
| 14. | Asahi M, Azuma T, Ito S, Ito Y, Suto H, Nagai Y, Tsubokawa M, Tohyama Y, Maeda S, Omata M. Helicobacter pylori CagA protein can be tyrosine phosphorylated in gastric epithelial cells. J Exp Med. 2000;191:593-602. [PubMed] [DOI] |
| 15. | Li SD, Kersulyte D, Lindley IJ, Neelam B, Berg DE, Crabtree JE. Multiple genes in the left half of the cag pathogenicity island of Helicobacter pylori are required for tyrosine kinase-dependent transcription of interleukin-8 in gastric epithelial cells. Infect Immun. 1999;67:3893-3899. [PubMed] |