修回日期: 2007-02-10
接受日期: 2007-03-06
在线出版日期: 2007-04-28
目的: 从抗幽门螺杆菌(H. pylori)全菌蛋白的单克隆抗体(mAb)中, 应用重组中性粒细胞激活蛋白(NAP), 筛选出抗NAP单抗并进行鉴定.
方法: 临床分离H. pylori DY01, DY04株. 免疫BALB/c小鼠后, 应用杂交瘤技术制备mAb. 再用ELISA方法以重组表达的NAP蛋白筛选相应的单抗, 对NAP单抗进行亚类鉴定和效价检测, 并用Western blot和免疫组化方法鉴定其特异性.
结果: 获得3株针对H. pylori-NAP蛋白的特异性mAb, 抗体亚类为IgG1, 轻链为k型. 单抗细胞培养液的抗体效价为1/16-1/32, 腹水的抗体效价是1/32000-1/64000. Western blot鉴定表明, 抗NAPmAb针对NAP蛋白产生特异性条带, 具有高度的特异性; 免疫组化分析显示: 3株NAP mAb能与H. pylori临床菌株发生特异性结合反应, 菌体染成深棕色.
结论: 获得抗H. pylori-NAP蛋白的特异性mAb,为幽门螺杆菌感染的诊断、预后判断及表位疫苗的研究提供基础.
引文著录: 龙敏, 李妍, 罗军, 李明. 抗幽门螺杆菌中性粒细胞激活蛋白的单克隆抗体的制备和鉴定. 世界华人消化杂志 2007; 15(12): 1429-1432
Revised: February 10, 2007
Accepted: March 6, 2007
Published online: April 28, 2007
AIM: To screen and identify the monoclonal antibodies (mAbs) against H. pylori neutrophils activating protein (NAP).
METHODS: H. pylori DY01 and DY04 strains were clinically isolated. After BALB/c mice were immunized, the mAbs against H. pylori were obtained by hybridoma technique. Then, the mAbs against H. pylori-NAP were screened using recombinant H. pylori-NAP. The obtained mAbs were evaluated for subtype and titer, and their specificities were identified by Western blot and immunohistochemical techniques.
RESULTS: Three strains of mAbs against H. pylori-NAP were obtained. All of the mAbs against H. pylori-NAP were identified as immunoglobulin G1 (IgG1) with k light chain. The titer of mAbs in the culture supernatant was 1/16 to1/32, and that in the ascites were 1/32000 to 1/64000. Western blotting showed that the mAbs had specific reaction with the recombinant H. pylori-NAP. Clinical H. pylori strains were stained brown with the mAbs against H. pylori-NAP by immunohistochemical techniques.
CONCLUSION: Three strains of mAbs against H. pylori-NAP are obtained, which are helpful in the diagnosis and prognosis of H. pylori infection as well as vaccine research.
- Citation: Long M, Li Y, Luo J, Li M. Preparation and identification of monoclonal antibodies against Helicobacter pylori neutrophils activating protein. Shijie Huaren Xiaohua Zazhi 2007; 15(12): 1429-1432
- URL: https://www.wjgnet.com/1009-3079/full/v15/i12/1429.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i12.1429
幽门螺杆菌(H. pylori)感染世界人口的50%, 是慢性胃炎、消化性溃疡的主要致病因子, 并与胃癌密切相关. 幽门螺杆菌的定植, 伴随着胃黏膜中性粒细胞、单核细胞和淋巴细胞的浸润, 中性粒细胞浸润程度与黏膜损伤程度密切相关[1-5].
中性粒细胞激活蛋白(neutrophils activating protein, NAP)是幽门螺杆菌的重要毒力因子, 他由napA基因编码, 分子质量150 kDa, 位于H. pylori菌体内, 通过自溶释放后, 募集中性粒细胞, 并与中性粒细胞和单核细胞的外膜相结合, 促进中性粒细胞与胃上皮细胞的黏附, 激活中性粒细胞造成黏膜的炎性反应[2-4], 并能激活粒细胞产生活性氧中间产物(reactive oxygen intermediates, ROI)及趋化因子[6]. 大部分H. pylori感染患者产生NAP抗体, 而且, 用H. pylori-NAP免疫小鼠能保护机体抵抗H. pylori的感染, 表明H. pylori-NAP可作为H. pylori疫苗的候选抗原[7-9]. 本研究以H. pylori全菌作为抗原, 应用杂交瘤技术制备抗H. pylorimAb[10]; 构建H. pylori-NAP原核表达系统, 体外重组表达NAP蛋白[11], 并用表达的NAP蛋白对抗体进行鉴定, 获得3株针对H. pylori-NAP的mAb.
H. pylori标准株NCTC11639由微生物系保存, H. pylori临床分离株DY01, DY04由微生物系从患者胃黏膜活检标本中分离. 其他肠道常见细菌如痢疾志贺菌、福氏志贺菌、宋氏志贺菌、变形杆菌和弯曲杆菌由微生物系保存. 小鼠骨髓瘤细胞SP2/0由本校生物技术学院保存, 弗氏佐剂、聚乙二醇(PEG)1450, HAT, HT以及辣根过氧化物酶标记(HRP)的羊抗小鼠JgG、四甲基联苯胺(TBM)购自Sigma公司; 鼠mAb亚类检测试剂盒购自HyCult公司, RPMI1640培养基为Gibaco-BRL产品, 新生牛血清购于杭州四季青生物工程有限公司, 硝酸纤维素膜购自Milipore公司. 6周龄♀BALB/c小鼠, 购自广州中医药大学实验动物中心.
1.2.1 重组H. pylori-NAP蛋白: 应用PCR技术从H. pylori标准株NCTC11639 DNA染色体中扩增napA编码基因片段, T-A克隆后测序, 扩增的napA基因全长435 bp, 测序后登录在GenBank中(No.DQ341279). 然后, 酶切目的基因片段, 与表达载体连接转化宿主细胞, 构建napA基因原核表达系统pGEX-4T-1-napA-E.coli Top10, 采用SDS-PAGE电泳鉴定表达产物, IPTG诱导表达, GST亲和层析纯化收集rNAP, Western blot法鉴定rNAPA的免疫原性, 获得重组H. pylori-NAP蛋白.
1.2.2 幽门螺杆菌全菌抗原的制备: 将菌株接种于含100 mL/L羊血的空弯培养基平板上, 37 ℃微需氧环境(850 mL/L, 100 mL/L CO2, 50 mL/L O2)培养3 d, 菌苔小心刮入PBS液中, 超声破菌后超速离心, 分别收集上清和沉淀作为免疫和筛选抗原.
1.2.3 动物免疫: 首次用弗氏完全佐剂与抗原乳化皮下多点注射, 50 µg/只, 共5只, 再每隔2 wk后用弗氏不完全佐剂与抗原乳化皮下多点注射, 50 μg/只, 至尾静脉采血测定抗体效价达到1:16 000以上. 融合前3 d腹腔注射50 μg/只进行加强免疫.
1.2.4 杂交瘤细胞的制备和筛选: 末次加强免疫后3 d取小鼠脾细胞(1×108)与骨髓瘤细胞SP2/0(1×107), 在0.5 g/L PEG1450作用下进行融合. 融合细胞先用HAT培养基选择培养, 10 d后改用含200 mL/L小牛血清的RPMI1640培养基培养. 取培养上清用间接荧光法筛选阳性克隆: 以H. pylori超声破菌后的上清和沉淀作为包被抗原, HRP标记的羊抗鼠IgG为二抗, 并以免疫小鼠血清为阳性对照. 采用有限稀释法对鉴定出来的阳性克隆细胞连续亚克隆, 至每株细胞亚克隆阳性率达到100%, 将细胞扩大培养后液氮冷冻.
1.2.5 腹水和mAb的制备: 使用石蜡油预处理BALB/C小鼠, 每只小鼠腹腔注射0.5 mL石蜡油. 1 wk后, 给预处理小鼠腹腔注射已建株的杂交瘤细胞约2×106-3×107个, 7-10 d后采集腹水离心去除细胞沉淀, 11 800 g, 10 min. 上清用0.22 μm滤膜过滤.
1.2.6 针对H. pylori-NAP的mAb的筛选: 重组H. pylori-NAP蛋白与29株mAb的反应: 采用间接ELISA法, 以本室制备的重组表达的H. pylori-NAP蛋白为包被抗原(5 mg/孔), 50 g/L脱脂牛奶封闭2 h后, 加H. pylori mAb(5 mg/孔), 37 ℃作用1 h, 再加入HRP-标记的羊抗鼠IgG(1:1000), 作用0.5-1 h后, DAB显色. 酶标仪读数.
mAb亚类鉴定和效价检测: mAb亚类鉴定采用Hycult公司的鼠mAb亚类检测试剂盒, 按说明书操作. 抗体效价的测定采用间接ELISA法, 每株mAb的细胞培养上清按2倍比稀释, 腹水按200倍比稀释.
ELISA鉴定单抗与其他肠道细菌的交叉反应: 采用间接ELISA法, 以培养的痢疾志贺菌、福氏志贺菌、宋氏志贺菌、伤寒沙门氏菌、变形杆菌和弯曲杆菌超声破菌后的上清和沉淀分别为包被抗原检测单抗.
免疫印迹(Western blot)鉴定mAb特异性: 将重组的H. pylori-NAP蛋白进行SDS-PAGE蛋白电泳, 转印至硝酸纤维素膜, 100 g/L脱脂牛奶4 ℃封闭过夜, 以1:100稀释的mAb作为一抗, HRP-标记的羊抗鼠IgG为二抗, 反应后洗膜, 用化学发光显色.
免疫组化鉴定mAb特异性: 以培养的H. pylori临床株作为抗原涂片, 丙酮固定60 min, 加入1:100稀释的单抗, 再滴加HRP-标记羊抗鼠IgG(1:250), 室温作用1 h, DAB显色, 显微镜观察.
融合细胞2次, 融合率平均约为90%. 以间接ELISA法筛选阳性克隆细胞, 每株阳性克隆细胞连续亚克隆3-4次, 共获得29株抗H. pylori杂交瘤细胞株. 杂交瘤细胞经过多次传代、冻存和复苏后, 生长良好, 并持续稳定的分泌抗体.
应用间接ELISA法, 以重组NAP蛋白作为包被抗原, 与29株单抗反应后, 筛选出3株与NAP蛋白反应的单抗, 编号分别为E006, E019, E023.
应用鼠mAb亚类检测试剂盒, 对3株抗NAP蛋白单抗的细胞上清进行检测, 结果表明抗体亚类为IgG1, 轻链为κ型. mAb细胞培养液的抗体效价为1:16-1:32, 腹水的抗体效价是1:32 000-1:64 000(图1).
间接ELISA法分析表明, 3株mAb与其他肠道细菌无交叉反应.
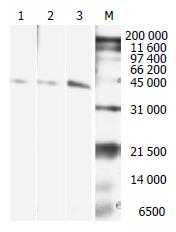
将重组NAP蛋白作SDS-PAGE电泳, 转印PVDF膜, 以3株mAb为一抗, HRP-标记的羊抗鼠IgG为二抗, 化学发光显色后, 在分子质量约44 kDa处出现一条阳性条带, 表明抗NAP单抗仅针对NAP蛋白, 具有高度的特异性(图2).
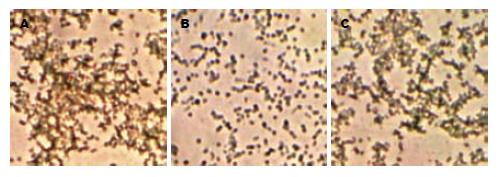
3株NAP mAb能与H. pylori临床菌株发生反应, 菌体呈深棕色(图3).
本研究应用H. pylori全菌蛋白作为抗原制备mAb, 并用重组NAP蛋白筛选抗NAP的mAb, 从29株mAb中, 得到3株抗NAP蛋白的mAb, 在Western blot实验中, 能与相应的重组蛋白发生反应. 抗NAP mAb与其他肠道杆菌无交叉反应. 免疫组化鉴定发现, 3株NAP mAb能与H. pylori临床菌株发生反应, 将菌体染为深棕色. 实验表明: 已获得3株特异性针对NAP蛋白的mAb.
幽门螺杆菌NAP蛋白是一重要的毒力因子, 能诱导中性粒细胞在胃黏膜中的浸润, 造成胃黏膜的损伤和炎症; 由于H. pylori-NAP能激活中性粒细胞产生活性氧中间产物ROI, ROI能直接攻击DNA而具致突变作用, 提示ROI可能是致突变因子, 与H. pylori相关性胃癌的发生有关[2,9]. 因此, 我们希望通过制备NAP单抗, 建立更加特异和简便的诊断方法, 用于H. pylori感染的诊断和预后的判断.
疫苗接种是预防甚至治疗H. pylori感染的理想方法. 但目前尚无有效的疫苗用于H. pylori感染的控制. H. pylori抗原成分很多, 但单一抗原的保护率低, 联合应用多种抗原将极大提高保护效果[12-15]. H. pylori-NAP抗原性强, 大部分H. pylori感染患者产生NAP抗体, 用H. pylori-NAP免疫小鼠能保护机体抵抗H. pylori的感染, 保护率80%, 表明H. pylori-NAP可作为H. pylori疫苗的候选抗原[8-9,16]. 我们正在应用鉴定出的NAPmAb作为靶分子, 利用噬菌体肽库技术筛选NAP具有免疫原性的抗原表位, 用于H. pylori多表位疫苗的研制.
幽门螺杆菌是慢性胃炎和消化性溃疡的重要致病因子, 并与胃腺癌和胃B细胞淋巴瘤的发生密切相关. H. pylori在世界人口中的感染率高达50%, 发展中国家感染率更高. 怎样有效控制H. pylori感染, 是国内外学者关注的一大难题. 目前广泛应用的抗生素疗法存在患者耐受性差、抗生素耐药性和感染复发率高等问题, 迫切需要寻找新的方法有效控制H. pylori感染. 公认疫苗是有效预防甚至治疗H. pylori感染的最佳途径, 但至今尚无成功的疫苗应用于临床.
近年来, 一些学者对H. pylori-NAP的免疫保护作用和机制进行了深入的研究. 例如: Satin et al发现H. pylori-NAP是保护性抗原; Vagdy et al研究发现, 以 H. pylori-NAP和CagA作为抗原, 采用肌注联合口服或滴鼻途径免疫小鼠, 可明显增强局部黏膜免疫和全身免疫反应; Amedei et al报道, H. pylori-NAP 通过诱导中性粒细胞和单核细胞IL-12、IL-23的表达, 促进Th1免疫反应.
本研究以天然的H. pylori全菌蛋白作为抗原, 应用杂交瘤技术制备单克隆抗体, 再用表达的重组蛋白筛选相应的单抗, 省去了每一种重组蛋白分别免疫小鼠制备单抗的繁琐步骤, 而且获得的抗体是针对天然菌体蛋白的.
该研究建立的鉴定单抗与H. pylori临床株特异性结合反应的免疫组化方法, 可进一步用于临床胃黏膜标本的检测.
电编: 郭海丽 编辑:张焕兰
| 1. | Amedei A, Cappon A, Codolo G, Cabrelle A, Polenghi A, Benagiano M, Tasca E, Azzurri A, D'Elios MM, Del Prete G. The neutrophil-activating protein of Helicobacter pylori promotes Th1 immune responses. J Clin Invest. 2006;116:1092-1101. [PubMed] [DOI] |
| 2. | Brisslert M, Enarsson K, Lundin S, Karlsson A, Kusters JG, Svennerholm AM, Backert S, Quiding-Jarbrink M. Helicobacter pylori induce neutrophil transendothelial migration: role of the bacterial HP-NAP. FEMS Microbiol Lett. 2005;249:95-103. [PubMed] [DOI] |
| 3. | Montecucco C, de Bernard M. Molecular and cellular mechanisms of action of the vacuolating cytotoxin(VacA)and neutrophil-activating protein (HP-NAP)virulence factors of Helicobacter pylori. Microbes Infect. 2003;5:715-721. [PubMed] [DOI] |
| 4. | Nishioka H, Baesso I, Semenzato G, Trentin L, Rappuoli R, Del Giudice G, Montecucco C. The neutrophil-activating protein of Helicobacter pylori (HP-NAP)activates the MAPK pathway in human neutrophils. Eur J Immunol. 2003;33:840-849. [PubMed] [DOI] |
| 5. | Allen LA. The role of the neutrophil and phagocytosis in infection caused by Helicobacter pylori. Curr Opin Infect Dis. 2001;14:273-277. [PubMed] [DOI] |
| 6. | Shimoyama T, Fukuda S, Liu Q, Nakaji S, Fukuda Y, Sugawara K. Helicobacter pylori water soluble surface proteins prime human neutrophils for enhanced production of reactive oxygen species and stimulate chemokine production. J Clin Pathol. 2003;56:348-351. [PubMed] [DOI] |
| 7. | Dundon WG, Nishioka H, Polenghi A, Papinutto E, Zanotti G, Montemurro P, Del GG, Rappuoli R, Montecucco C. The neutrophil-activating protein of Helicobacter pylori. Int J Med Microbiol. 2002;291:545-550. [PubMed] [DOI] |
| 8. | Satin B, Del Giudice G, Della Bianca V, Dusi S, Laudanna C, Tonello F, Kelleher D, Rappuoli R, Montecucco C, Rossi F. The neutrophil-activating protein(HP-NAP)of Helicobacter pylori is a protective antigen and a major virulence factor. J Exp Med. 2000;191:1467-1476. [PubMed] [DOI] |
| 11. | Kang QZ, Duan GC, Fan QT, Xi YL. Fusion expression of Helicobacter pylori neutrophil-activating protein in E.coli. World J Gastroenterol. 2005;11:454-456. [PubMed] [DOI] |
| 12. | Vajdy M, Singh M, Ugozzoli M, Briones M, Soenawan E, Cuadra L, Kazzaz J, Ruggiero P, Peppoloni S, Norelli F. Enhanced mucosal and systemic immune responses to Helicobacter pylori antigens through mucosal priming followed by systemic boosting immunizations. Immunology. 2003;110:86-94. [PubMed] [DOI] |
| 13. | Rossi G, Ruggiero P, Peppoloni S, Pancotto L, Fortuna D, Lauretti L, Volpini G, Mancianti S, Corazza M, Taccini E. Therapeutic vaccination against Helicobacter pylori in the beagle dog experimental model: safety, immunogenicity, and efficacy. Infect Immun. 2004;72:3252-3259. [PubMed] [DOI] |
| 14. | 王 媛, 严 杰, 毛 亚飞. 幽门螺杆菌napA基因原核表达系统构建及其表达产物的免疫性和致炎作用. 中华微生物学和免疫学杂志. 2005;25:98-102. |
| 15. | Del Giudice G, Covacci A, Telford JL, Montecucco C, Rappuoli R. The design of vaccines against Helicobacter pylori and their development. Annu Rev Immunol. 2001;19:523-563. [PubMed] [DOI] |
| 16. | Gozes I. Activity-dependent neuroprotective protein: From gene to drug candidate. Pharmacol Ther. 2007;114:146-154. [PubMed] [DOI] |