修回日期: 2007-02-10
接受日期: 2007-02-13
在线出版日期: 2007-04-28
目的: 研究白花蛇舌草总黄酮(FHD)对人肝癌细胞SMMC-7721, BEL-7402的体外抑制作用, 对小鼠移植性肝癌H22的体内抑制作用和对其增殖周期、凋亡、免疫功能的影响.
方法: MTT法评价FHD在0, 5, 10, 50, 100 mg/L浓度下, 于24, 48, 72 h对人肝癌细胞SMMC-7721, BEL-7402的抑制率变化. 昆明♂小鼠60只, 随机取10只为正常对照组, 余接种H22瘤株, 随机分为模型对照组、5-FU阳性对照组(30 mg/kg)和高中低剂量FHD给药组(剂量分别为25, 50, 100 mg/kg), 腹腔给药10 d后, 比较各组瘤质量抑制率、H22细胞周期分布及凋亡率, 比较各组荷瘤小鼠的胸腺指数(×10-3)、脾脏指数(×10-3)、脾淋巴细胞转化率和血清TNF-α、IFN-g水平(ng/L).
结果: FHD对SMMC-7721、BEL-7402细胞具有体外抑制作用, 且呈剂量依赖性和时间依赖性(P<0.05). 与模型对照组相比, 25, 50, 100 mg/kg FHD显著抑制小鼠移植性H22肿瘤(P<0.01), 使G0/G1期H22细胞比例逐渐增加(30.36%±5.72%, 32.83%±6.67%, 39.67%±8.01% vs 25.62%±4.36%, P<0.05或P<0.01), G2/M期细胞比例逐渐下降(7.65%±2.32%, 6.33%±3.43%, 2.22%±0.98% vs 11.13%±2.77%, P<0.05或P<0.01), 促进肿瘤细胞凋亡(2.41%±0.42%, 2.22%±0.33%, 2.07%±0.40% vs 1.47%±0.66%, P<0.01), 降低荷瘤小鼠脾脏指数(51.43±8.31, 47.43±7.89, 48.64±9.35 vs 67.63±7.44, P<0.01), 升高胸腺指数(33.36±4.09, 40.35±5.79, 34.57±6.56 vs 22.43±4.52, P<0.01)和脾淋巴细胞转化率(10.83%±3.75%, 11.33%±5.04%, 13.58%±4.62% vs 9.35%±2.02%, P<0.05), 并提高血清TNF-α(257.56±42.29, 386.36±25.97, 364.52±23.62 vs 101.43±24.72, P<0.01)、IFN-g水平(355.83±35.74, 392.31±25.17, 357.38±34.82 vs 172.35±29.02, P<0.01).
结论: FHD在体外、体内均具有抑制肝癌细胞的作用, 此作用与阻滞肿瘤细胞增殖周期、促进肿瘤细胞凋亡、调节机体免疫环境有关.
引文著录: 张硕, 宋衍芹, 周三, 杨志宏, 刘占涛, 倪同尚, 岳旺. 白花蛇舌草总黄酮对肝癌的体内外抑制作用及对小鼠移植性肝癌H22细胞增殖周期、凋亡、免疫环境的影响. 世界华人消化杂志 2007; 15(12): 1347-1352
Revised: February 10, 2007
Accepted: February 13, 2007
Published online: April 28, 2007
AIM: To investigate the inhibitory effect of favonoids from Hedyotis diffusa willd. (FHD) on human hepatoma cell line SMMC-7721 and BEL-7402 in vitro, the antitumor effect on transplanted H22 tumor cells in vivo and its influence on the proliferation cycle, apoptosis of tumor cells and immune circumstances.
METHODS: MTT assay was used to measure the inhibition of SMMC-7721 and BEL-7402 cells exposing to 0, 5, 10, 50 and 100 mg/L FHD for 24, 48 and 72 hours. Sixty Kunming mice were randomly and averagely divided into 6 groups. Except those in normal control group, the other mice received inoculation of H22 tumor cells, and then treated with normal saline, 5-fluorouracil (30 mg/kg), and FHD (25, 50, 100 mg/kg), respectively, for 10 days. The following indicators were compared among the 6 groups, including the inhibitory rates of tumor weights, the distribution of H22 cell cycle, the apoptosis of H22 cells, the thymus index (× 10-3) and splenic index (× 10-3) in mice bearing H22 tumors, the splenic lymphocyte transformation efficiency, and the serum levels (ng/L) of tumor necrosis factor (TNF-α) and interferon-g (IFN-g).
RESULTS: FHD inhibited the proliferation of SMMC-7721 and BEL-7402 cells in vitro in a dose- and time-dependent manner. In comparison with those in the model control mice, when FHD was used at the concentrations of 25, 50 and 100 mg/kg, the growth of H22 tumors was obviously restrained (P < 0.01); the proportion of G0/G1-phase cells was increased (30.36% ± 5.72%, 32.83% ± 6.67%, 39.67% ± 8.01% vs 25.62% ± 4.36%, P < 0.05 or P < 0.01), while that of G2/M-phase cells was decreased (7.65% ± 2.32%, 6.33% ± 3.43%, 2.22% ± 0.98% vs 11.13% ± 2.77%, P < 0.05 or P < 0.01); the apoptosis of tumor cells was significantly promoted (2.41% ± 0.42%, 2.22% ± 0.33%, 2.07% ± 0.40% vs 1.47% ± 0.66%, P < 0.01); the splenic index was down-regulated (51.43 ± 8.31, 47.43 ± 7.89, 48.64 ± 9.35 vs 67.63 ± 7.44, P < 0.01), but the thymus index (33.36 ± 4.09, 40.35 ± 5.79, 34.57 ± 6.56 vs 22.43 ± 4.52, P < 0.01), the splenic lymphocyte transformation rate (10.83% ± 3.75%, 11.33% ± 5.04%, 13.58% ± 4.62% vs 9.35% ± 2.02%, P < 0.05), and the serum levels of TNF-α (257.56 ± 42.29, 386.36 ± 25.97, 364.52 ± 23.62 vs 101.43 ± 24.72, P < 0.01) and IFN-g (355.83 ± 35.74, 392.31 ± 25.17, 357.38 ± 34.82 vs 172.35 ± 29.02, P < 0.01) were markedly elevated.
CONCLUSION: FHD has inhibitory effect on hepatoma cells both in vivo and in vitro, which is related to the blocking of tumor cell proliferation cycle, promotion of tumor cell apoptosis and regulation of immune circumstances.
- Citation: Zhang S, Song YQ, Zhou S, Yang ZH, Liu ZT, Ni TS, Yue W. Inhibitory effect of favonoids from Hedyotis diffusa willd. on hepatoma cells in vitro & vivo and its influence on transplanted H22 tumor cells' proliferation cycle, apoptosis and immune circumstances in mice. Shijie Huaren Xiaohua Zazhi 2007; 15(12): 1347-1352
- URL: https://www.wjgnet.com/1009-3079/full/v15/i12/1347.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i12.1347
白花蛇舌草(Hedyotis diffusa willd.)是茜草科耳草属植物, 在中国云南、广西、广东、福建、浙江、江苏等地均有生长[1]. 近年来, 关于其抗肿瘤作用日益成为研究热点. 然而, 对其黄酮类(flavonoids)成分的抗癌作用及机制研究鲜见报道[2-3]. 我们通过体内、体外实验, 研究了白花蛇舌草总黄酮(flavonoids from Hedyotis diffusa willd., FHD)对肝癌的抑制作用, 并从细胞周期调控、凋亡、免疫角度展开了机制探讨.
18-22 g昆明种小鼠, ♂, 清洁级, 购自成都中医药大学实验动物中心. 小鼠HepA22肝癌细胞株(H22), 人肝癌细胞株SMMC-7721, BEL-7402, 购自四川大学华西医学中心肿瘤研究所. FHD: 白花蛇舌草经成都中医药大学中药鉴定教研室鉴定后, 由药物化学教研室提取(经检测, 其纯度为85.63%); 经500 mL/L乙醇溶解, 生理盐水稀释, 0.22 μm滤膜过滤除菌, 用于体内实验; 经500 mL/L乙醇溶解, RPMI1640稀释, 0.22 μm滤膜过滤除菌, 用于体外实验. 氟尿嘧啶(5-FU)注射液(天津金耀氨基酸有限公司), RPMI1640、胎牛血清、胰蛋白酶(Gibco公司), MTT, PI(Sigma公司), DMSO(成都科龙化工试剂厂), 伴刀豆蛋白A(ConA, Sigma公司), 小鼠TNF-α, IFN-g ELISA试剂盒(晶美生物工程有限公司).
1.2.1 对培养人肝癌细胞的体外抑制作用: 复苏人肝癌细胞株SMMC-7721, BEL-7402, 用含100 mL/L胎牛血清、50 U/L青霉素和50 mg/L链霉素的RPMI1640培养液在37 ℃恒温、50 mL/L CO2密闭环境中培养. 将对数生长期的SMMC-7721, BEL-7402细胞按5×103/孔接种于96孔培养板, 孵育24 h待贴壁后加入FHD. FHD取5个浓度组, 终浓度分别为0, 5, 10, 50, 100 mg/L, 每个实验组重复6孔. 每个浓度组选取24, 48, 72 h 3个作用时间点进行MTT检测, 观测FHD对两种细胞株的生长抑制情况. 以490 nm波长测定吸光度(A)值. 抑制率 = (对照孔A490-实验孔A490)/对照孔A490×100%.
1.2.2 对小鼠皮下移植性肝癌H22的抑制作用: 随机取10只小鼠为正常对照组. H22细胞复苏后培养传代, 收集对数生长期细胞, 以生理盐水调整细胞浓度至1×109/L, 将0.5 mL细胞悬液接种于小鼠腹腔中, 7 d后抽取小鼠腹水, 用生理盐水稀释成1:4的细胞悬液, 以0.2 mL/只接种于余下的50只小鼠右前肢腋窝皮下. 24 h后将已经接种的小鼠随机分为5组, 每组10只, 即: 模型对照组(生理盐水)、5-FU阳性对照组(5-FU, 30 mg/kg)、FHD高中低剂量组(25, 50, 100 mg/kg). 各组每天称质量, 腹腔注射给药, 连续给药10 d, 末次给药24 h后颈椎脱臼处死, 剥取瘤块称质量, 计算抑瘤率. 抑瘤率(%) = (阴性对照组平均瘤质量-治疗组平均瘤质量)/阴性对照组平均瘤质量×100%.
1.2.3 对小鼠移植性肝癌H22细胞增殖周期及凋亡的影响: 从每组所取出的瘤块中各取1-2 mm3研磨制成细胞悬液, 用PBS洗3次, 用700 mL/L的4 ℃冰乙醇固定, PI染色, 用流式细胞仪(FCM)分析细胞周期各期细胞分布情况及细胞凋亡率.
1.2.4 对H22荷瘤小鼠免疫功能的影响: 胸腺、脾脏指数测定: 取各组小鼠胸腺、脾脏称质量, 除以相应的体质量乘以100%, 分别得出胸腺指数和脾脏指数.
脾脏淋巴细胞转换实验: 将从各组小鼠中无菌分离出的脾脏剪碎, 过200目不锈钢滤网, 用37 ℃预温的D-Hank's液反复冲洗悬浮, 1000 r/min下离心2次, 每次10 min, 破红细胞后, 再经D-Hank's液离心清洗, 以RPMI1640+100 mL/L小牛血清配成浓度为2×108/L细胞悬液, 接种于96孔培养板内, 每孔200 μL. 设无ConA组和加ConA组. 无ConA组取正常对照组标本, 6个复孔; 其余各组均加ConA, 并且ConA终浓度均为10 mg/L, 也分别设6个复孔. 培养72 h后, 行MTT检测, 以570 nm波长测定吸光度(A)值. 计算刺激指数(SI = ConA组孔A570/无ConA组孔A570)和淋巴细胞转化率[transfer rate = (模型组标本孔加ConA后SI/剂量组标本孔加ConA后SI)×100%].
H22荷瘤小鼠血清TNF-α, IFN-g水平的检测: 按照试剂盒要求采用ELISA检测H22荷瘤小鼠血清TNF-α, IFN-g的含量. 根据标准品的浓度和其相应的吸光度(A)值作出标准曲线求得曲线方程, 再根据样品的A值求得样品内细胞因子的浓度.
统计学处理 所有实验数据均采用mean±SD表示, 数据处理采用单因素方差分析, 均数间两两比较采用q检验.
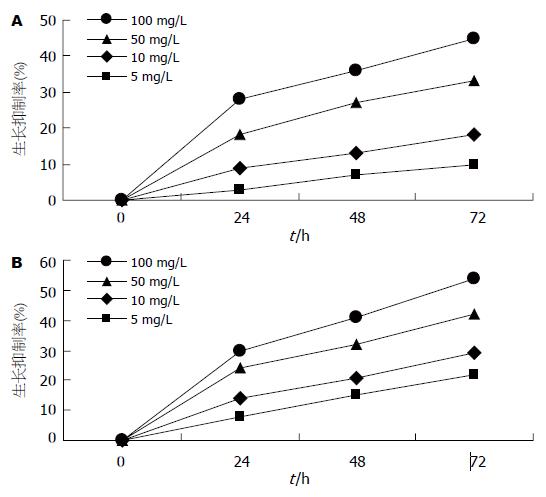
FHD对SMMC-7721, BEL-7402细胞均具有明显的抑制作用(P<0.05), 并且呈剂量依赖性和时间依赖性(图1).
各FHD组瘤质量均显著低于模型对照组(P<0.01), 低中高剂量组的抑瘤率分别为36.4%, 48.6%, 59.9%, 但各组抑瘤率仍低于5-FU对照组的67.5%. 5-FU对照组的终末体质量显著低于模型对照组(P<0.01); 各FHD组的终末体质量与模型对照组无显著差异(P>0.05), 且显著高于5-FU对照组(P<0.01)(表1).
FHD可浓度依赖性地引起H22细胞G0/G1期比例逐渐增加, 相应G2/M期细胞比例逐渐下降, 各浓度组与模型对照组相比均有显著性差异(P<0.05), 而S期细胞所占的比例不变(P>0.05). 各FHD组、5-FU组的H22细胞凋亡率显著高于模型对照组(P<0.01)(表2).
本研究的体外实验表明, FHD对人肝癌细胞SMMC-7721, BEL-7402的生长有显著抑制作用, 且呈剂量和时间依赖性. 体内实验表明, FHD显著抑制小鼠移植性肝癌H22的生长, 且亦呈剂量依赖性. 体内、体外实验的结果均表明, FHD对肝癌具有确切的抑制作用.
细胞增殖是细胞生命活动的基本表现之一, 是一种受到严格调控的精确有序过程. 肿瘤细胞则表现为调控失常, 不受节制地无限繁殖. 通过影响或调节细胞周期可以抑制肿瘤细胞的增殖, 诱导细胞分化或导致细胞死亡. 现有的一些抗肿瘤药物正是通过影响细胞周期而发挥作用的[4-7]. 本研究发现, FHD可浓度依赖性地提高G0/G1期细胞比例, 降低G2/M期细胞数目. 由此推测, FHD作用于G0/G1期, 使细胞更多地停滞于静止期, 减少其进入分裂期. 我们在FHD抑制肝癌细胞生长的靶基因调控研究中, 发现FHD可将蛋白激酶MAP2K6的表达上调至正常水平[21], 而细胞周期阻滞往往需要MAP2K6的参与[8-9]. 这些结果说明, 促进肿瘤细胞周期阻滞可能是FHD抑制肝癌细胞生长的机制之一.
肿瘤的发生不仅与肿瘤细胞增殖加快有关, 也与肿瘤细胞死亡受抑制密切相关. 随着对凋亡的深入认识, 人们发现细胞凋亡抑制是肿瘤形成的一个共同的重要事件, 而诱导肿瘤细胞凋亡是一条有效的肿瘤治疗途径. 我们发现, FHD可显著增加小鼠种植性H22细胞的凋亡率. 我们在FHD抑制肝癌细胞生长的靶基因调控研究中还发现, FHD可下调肝癌细胞中bcl-2基因的表达[21]. bcl-2基因是一种典型的细胞凋亡抑制基因[10-12]. 这为揭示FHD通过诱导肝癌细胞凋亡产生抗癌作用的机制提示了重要的研究方向.
越来越多的学者认为, 机体整体的免疫功能状态, 对于抗肿瘤具有重要价值. 降低对免疫系统的破坏性, 在抗肿瘤方案中已被摆到了十分突出的位置. 本研究考察了FHD对荷瘤小鼠免疫器官的影响, 发现FHD可降低小鼠荷瘤后升高的脾脏指数, 并升高胸腺指数. 与化疗药5-FU降低机体免疫功能的作用相比, FHD维护免疫功能的作用具有显著优势. ConA是一种丝裂原, 他可以刺激淋巴细胞发生增殖和分化, 这一过程与体内淋巴细胞的活化过程相似, 因此, ConA诱导的淋巴细胞转化被用作评价淋巴细胞功能的指标. 我们发现, 模型对照组小鼠淋巴细胞增殖能力较正常小鼠降低, FHD使荷瘤小鼠淋巴细胞转化能力明显增高. 这表明, FHD体内给药可促进荷瘤小鼠的淋巴细胞增殖. 我们推测: FHD促淋巴细胞增殖的作用是其抗肿瘤的免疫基础之一.
细胞因子是由免疫细胞产生的一类小分子免疫调节物质, 他们在中药抗肿瘤免疫中发挥重要作用[13]. 干扰素(interferon, IFN)是一族糖蛋白, 具有抗病毒、调节免疫、抗增殖等一系列生物学特性, 是重要的免疫细胞因子. IFN-g主要是由活化的T细胞和NK细胞产生的, 可以直接抑制肿瘤细胞的增殖, 且具有广泛的免疫调节作用, 能激活和促进单核巨噬细胞以及NK细胞的吞噬作用, 促进T细胞和B细胞的分化和成熟, 刺激B细胞产生抗体, 增强杀伤性T细胞(CTL)介导的细胞毒作用, 还可以诱导肿瘤细胞表达MHC-1类抗原, 从而增强免疫细胞对肿瘤细胞的识别, 具有正向调控细胞免疫功能的作用[14], 并诱导肿瘤细胞的凋亡[15-16]. 因此, IFN-g对于增强机体的抗肿瘤免疫起到至关重要的作用. 尽管这样, IFN-g对于肿瘤生长的影响是双向的, 即在低剂量下会诱发肿瘤的免疫耐受, 促进肿瘤的发展, 而只有在高剂量下, 才会明显抑制肿瘤细胞[17]. 本研究发现, FHD可以大幅度提高荷瘤小鼠血清中IFN-g的水平, 这对抑制肿瘤细胞是有利的. 肿瘤坏死因子(tumor necrosis factor, TNF)是一类能直接造成肿瘤细胞坏死的细胞因子. 近年来, 随着基础和临床研究的不断深入, TNF在肝癌病理生理治疗中的作用越来越突出. TNF-α在体内是淋巴细胞和NK细胞产生的一种多功能细胞因子, 在参与机体的炎症和免疫调节中具有重要作用, 是一种可以直接造成肿瘤细胞死亡的细胞因子[18-20]. 本研究发现, FHD可以显著提高荷瘤小鼠血清中TNF-α水平, 这表明, FHD可以通过促进TNF-α的分泌达到间接抑制肿瘤的效果.
总之, FHD在体外、体内均具有抑制肝癌的作用, 此作用与阻滞肿瘤细胞增殖周期、促进肿瘤细胞凋亡、调节机体免疫环境密切相关.
白花蛇舌草是一种具有突出抗癌作用的中药, 但对其抗癌有效成分及作用机制, 目前仍缺乏清楚的认识. 本文从体外、体内实验的药效学角度讨论了总黄酮成分的抗肝癌作用, 并从细胞周期调控、凋亡、免疫等多角度, 探讨了其抗癌机制.
许多报道表明, 中药的抗肿瘤作用有赖于多个环节, 其中, 细胞周期阻滞是造成抗肿瘤效应的重要基础之一; 通过免疫调控机制发挥抗肿瘤作用, 对于多数具有抗肿瘤效果的中药来说, 是不可忽视的途径; 而细胞凋亡, 是几乎所有干预手段的最终结局, 以上机制均能在肿瘤相关基因表达上找到答案.
目前, 多数对白花蛇舌草抗癌作用的研究停留在粗提物的水平, 缺乏对确切成分的深入研究. 许多研究或偏重于体外实验, 或偏重于体内实验, 而没有回答体内、体外实验的结果是否一致的问题. 本研究提出了体外与体内实验相结合的抗癌作用评价思路, 并在此基础上从细胞周期调控、细胞凋亡、免疫调节及分子靶点等多角度, 展开多层次的探讨, 使得中药成分抗癌作用的研究更加系统、全面.
本研究发现, 白花蛇舌草总黄酮对人肝癌SMMC- 7721, BEL-7402细胞具有体外抑制作用, 且呈剂量依赖性和时间依赖性, 通过增加G0-G1期细胞比例, 降低G2/M期细胞比例, 实现细胞周期阻滞, 促进肿瘤细胞凋亡, 维护机体正常免疫功能, 并提高TNF-α, IFN-g水平. 这为将白花蛇舌草总黄酮开发为安全有效的抗肝癌新药提供了实验依据.
本文主要从药理学角度研究了白花蛇舌草总黄酮对肝癌的体外、体内抑制作用, 从细胞周期调控、细胞凋亡、免疫调节等角度, 探讨其抗癌机制, 有利于帮助读者更全面地认识白花蛇舌草总黄酮的抗肝癌作用及机制, 是一篇典型的中药药理实验论文, 有一定实际应用价值.
电编: 张敏 编辑:张焕兰
| 4. | Sausville EA. Cyclin-dependent kinase modulators studied at the NCI: pre-clinical and clinical studies. Curr Med Chem Anticancer Agents. 2003;3:47-56. [PubMed] [DOI] |
| 5. | Grant S, Roberts JD. The use of cyclin-dependent kinase inhibitors alone or in combination with established cytotoxic drugs in cancer chemotherapy. Drug Resist Updat. 2003;6:15-26. [PubMed] [DOI] |
| 6. | Senderowicz AM. Novel direct and indirect cyclin-dependent kinase modulators for the prevention and treatment of human neoplasms. Cancer Chemother Pharmacol. 2003;52 Suppl 1:S61-73. [PubMed] [DOI] |
| 7. | Senderowicz AM. Novel small molecule cyclin-dependent kinases modulators in human clinical trials. Cancer Biol Ther. 2003;2:S84-95. [PubMed] [DOI] |
| 8. | Wang X, McGowan CH, Zhao M, He L, Downey JS, Fearns C, Wang Y, Huang S, Han J. Involvement of the MKK6-p38gamma cascade in gamma-radiation-induced cell cycle arrest. Mol Cell Biol. 2000;20:4543-4552. [PubMed] [DOI] |
| 9. | Goebeler M, Kilian K, Gillitzer R, Kunz M, Yoshimura T, Brocker EB, Rapp UR, Ludwig S. The MKK6/p38 stress kinase cascade is critical for tumor necrosis factor-alpha-induced expression of monocyte-chemoattractant protein-1 in endothelial cells. Blood. 1999;93:857-865. [PubMed] |
| 10. | Bold RJ, Virudachalam S, McConkey DJ. BCL2 expression correlates with metastatic potential in pancreatic cancer cell lines. Cancer. 2001;92:1122-1129. [PubMed] [DOI] |
| 11. | Shimizu S, Kanaseki T, Mizushima N, Mizuta T, Arakawa-Kobayashi S, Thompson CB, Tsujimoto Y. Role of Bcl-2 family proteins in a non-apoptotic programmed cell death dependent on autophagy genes. Nat Cell Biol. 2004;6:1221-1228. [PubMed] [DOI] |
| 12. | Shimizu S, Narita M, Tsujimoto Y. Bcl-2 family proteins regulate the release of apoptogenic cytochrome c by the mitochondrial channel VDAC. Nature. 1999;399:483-487. [PubMed] [DOI] |
| 15. | 韩 丽辉, 孙 汶生, 贾 晓青, 马 春红, 高 立芬, 刘 素侠, 王 晓燕. g-干扰素对HBV相关性肝癌细胞凋亡的免疫调节效应研究. 中国现代普通外科进展. 2005;8:269-271. |
| 16. | 韩 丽辉, 孙 汶生, 马 春红, 刘 素侠, 王 晓燕, 于 建国, 张 利宁, 陈 有海. IFN-g对TRAIL诱导HBV相关性肝癌细胞凋亡的调节作用. 中华微生物学和免疫学杂志. 2003;23:34-37. |
| 17. | 贺 宇飞, 张 桂梅, 张 慧, 陈 洪涛, 冯 作化. 不同剂量IFN-g体内对小鼠H22肝癌发生发展的作用研究. 中华微生物学和免疫学杂志. 2005;25:292-296. |
| 19. | Horie T, Dobashi K, Iizuka K, Yoshii A, Shimizu Y, Nakazawa T, Mori M. Interferon-gamma rescues TNF-alpha-induced apoptosis mediated by up-regulation of TNFR2 on EoL-1 cells. Exp Hematol. 1999;27:512-519. [PubMed] [DOI] |
| 20. | Dudich E, Semenkova L, Dudich I, Gorbatova E, Tochtamisheva N, Tatulov E, Nikolaeva M, Sukhikh G. alpha-fetoprotein causes apoptosis in tumor cells via a pathway independent of CD95, TNFR1 and TNFR2 through activation of caspase-3-like proteases. Eur J Biochem. 1999;266:750-761. [PubMed] [DOI] |