修回日期: 2007-02-10
接受日期: 2007-02-13
在线出版日期: 2007-04-28
目的: 通过体内连续传代获得幽门螺杆菌(H. pylori)的BALB/c小鼠适应性定植菌株并建立稳定的感染模型.
方法: 以H. pylori蒙古沙鼠适应株GS10连续传代感染BALB/c小鼠, 每次感染20只, 感染后4 wk进行微生物学检查(分离培养、直接涂片染色镜检、快速尿素酶试验、PCR鉴定), 观察H. pylori的定植情况, 计算每批动物的感染率, 直至感染率稳定在80%以上, 然后对已稳定感染的小鼠胃黏膜组织进行H. pylori定量培养及病理学检查.
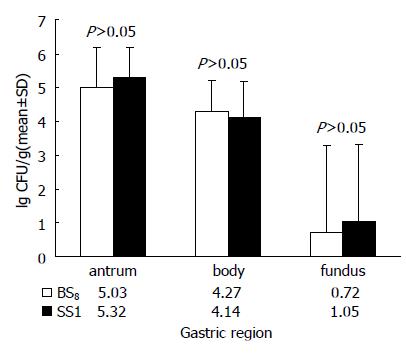
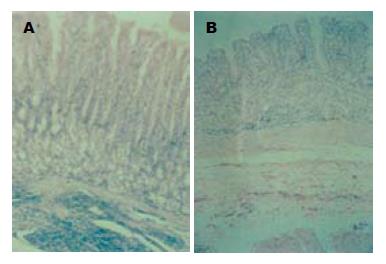
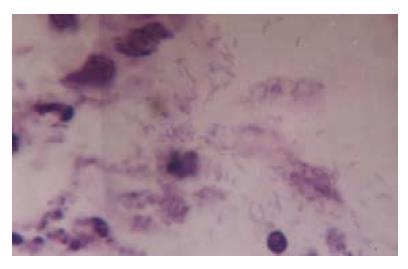
结果: 随着H. pylori菌株GS10在BALB/c小鼠内的连续传代, 感染率逐渐升高. GS10株初次感染率仅为11.1%, 传代至第6代(BS6株)以后, 感染率稳定在80%以上; BALB/c小鼠适应株BS8感染小鼠后4 wk在胃窦、胃体和胃底的定植密度(CFU/g组织)的常数对数均值分别为5.32±0.88, 4.14±1.05和1.05±2.25, 与SS1的定植密度相比, 相差不显著(P>0.05). 感染鼠病理学检查在胃窦黏膜上皮细胞间及固有层中发现大量炎症细胞浸润; 在胃窦及幽门部上皮细胞表层黏液、胃腺窝中见到大量H. pylori存在.
结论: 经过连续传代感染, 驯化出一株高定植力和感染率的H. pylori BALB/c小鼠适应株, 并成功建立稳定的H. pylori小鼠感染模型.
引文著录: 郭刚, 刘开云, 解庆华, 张卫军, 邹全明. 幽门螺杆菌BALB/c小鼠适应性菌株的驯化及模型建立. 世界华人消化杂志 2007; 15(12): 1338-1341
Revised: February 10, 2007
Accepted: February 13, 2007
Published online: April 28, 2007
AIM: To increase the colonization ability of H. pylori and establish a BALB/c mouse model infected steadily with H. pylori.
METHODS: Mongolian gerbils-adaptive strain GS10 of H. pylori were inoculated into BALB/c mice and acclimated through serial passages in vivo for procuring an adaptive colonization of H. pylori strain. After being infected for 4 weeks, all the animals were treated for microbiological examination, including culturing, smearing, urease test and polymerase chain reaction (PCR). The infectious rate of each group was calculated till the rate rose to 80%. Then, the gastric mucosal tissues were collected from the infected mice for quantitative analysis of H. pylori and histological examination.
RESULTS: The proportion of BALB/c mice infected by H. pylori increased gradually from about 11.1% at the first infection to 80% after 6 passages in vivo. At the 4th week after BALB/c mice were infected with the adaptive strain BS8 (strains after 8 passages), the colonization density in the gastric antrum, body and fundus of the infected mice, expressed by the common logarithm of colony forming unit per gram of tissue, was 5.03 ± 1.16, 4.27 ± 0.93 and 0.72 ± 2.57, respectively, which were similar to the colonization density (5.32 ± 0.88, 4.14 ± 1.05 and 1.05 ± 2.25) in the mice infected with H. pylori strain SS1 (P > 0.05). Infiltrations of polymorphonuclear leucocytes and monomuclear cells were observed in the lamina propria and submucosa of the stomach from the H. pylori-infected mice. A great number of H. pylori were also observed in the gastric mucus through microscopy.
CONCLUSION: H. pylori with high colonization ability and infection rates are obtained, and a BALB/c mouse model infected steadily with H. pylori is established successfully.
- Citation: Guo G, Liu KY, Xie QH, Zhang WJ, Zou QM. Establishment of a BALB/c mouse model infected steadily with H. pylori through serial passages in vivo. Shijie Huaren Xiaohua Zazhi 2007; 15(12): 1338-1341
- URL: https://www.wjgnet.com/1009-3079/full/v15/i12/1338.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i12.1338
自1982年Marshall和Warren[1]首次发现幽门螺杆菌(H. pylori)以来, 建立稳定而实用的动物模型一直是H. pylori研究者的目标. H. pylori沙鼠模型由于其可产生与人相似的病理变化, 在H. pylori致病机制和疫苗研究方面现示出极大的应用价值[2-5]. 然而, 由于缺少针对沙鼠的免疫检测试剂, 该沙鼠模型在H. pylori感染及免疫应答机制研究方面的应用受到了极大的限制. 国内外虽有报道建立了小鼠感染模型[6-9], 但必须采用特定的H. pylori菌株, 如Sydney Strain1(SS1). 我们在已建立的沙鼠模型基础上[10-11], 将H. pylori沙鼠适应株通过小鼠体内的连续传代, 驯育BALB/c小鼠的H. pylori适应性定植菌株并建立稳定的BALB/c小鼠模型, 为进一步研究H. pylori感染与免疫应答机制奠定基础.
♂BALB/c小鼠180只, 体质量22-25 g, 由第三军医大学试验动物中心提供. H. pylori沙鼠适应性菌株GS10由本室驯化所得, 该菌株对沙鼠的感染率>90%. H. pylori BALB/c小鼠适应株SS1由澳大利亚University of New South Wales的Lee A教授惠赠, 本室保存.
1.2.1 H. pylori的培养和灌喂:H. pylori菌株GS10采用本室改良的液体培养方法[12]培养, 调整菌液浓度约为1012 CFU/L, 用f 0.9 mm×L 70 mm可曲导管灌喂断食水24 h的BALB/c小鼠, 0.5 mL菌液/只, 上、下午各1次, 末次后2 h供食供水.
1.2.2 H. pylori小鼠体内的传代: 用GS10株感染20只BALB/c小鼠, 4 wk后处死, 采集胃黏膜组织, 一半胃黏膜组织涂布脑心浸液血琼脂平板, 微需氧培养3-5 d, 观察有无H. pylori生长; 一半胃黏膜作直接涂片镜检、PCR鉴定和快速尿素酶试验. 其中分离培养阳性或后三项中任两项阳性判断为感染成功. 计算感染率(感染鼠数量/存活鼠数量). 选择平板上H. pylori菌落数最多的分离菌株作为第一代适应株BS1; 采用相同方法用BS1再去感染下一批20只BALB/c小鼠, 获得第二代适应株BS2; 如此重复进行, 直至H. pylori在小鼠体内感染率稳定在80%以上.
1.2.3 定量培养及病理学检查: SS1感染及BS株感染稳定后各取10只感染小鼠处死, 取一半胃组织, 在胃窦、胃体和胃底部各剪取3块黏膜组织, 约50 mg/块, 称量后, 匀浆, 然后取匀浆液作10倍系列稀释, 每个稀释度取50 μL均匀涂布于H. pylori平板培养, 计算每克胃组织中的活菌数(CFU), 定植密度以lg CFU/g组织表示; 另一半黏膜组织经福尔马林常规固定, 石蜡包埋, 连续垂直切片, 作HE染色镜检.
H. pylori沙鼠适应性菌株GS10初次感染BALB/c小鼠20只, 最终检测的18只小鼠中只有2只成功定植, 从2只感染BALB/c小鼠胃内分离培养出H. pylori菌, 我们将其中克隆数较多的一株确定为适应株1, 命名为BS1, 随着BS1在沙鼠体内的连续传代, 感染率逐渐升高, 传代至第6代(BS6)以后, 感染率稳定在80%以上, 与标准菌株SS1感染率接近(表1).
| 菌株 | 试验小鼠(n) | 培养阳性(n) | 镜检阳性(n) | 脲酶阳性(n) | PCR阳性(n) | 感染率(%)(感染数/存活数) |
| BS1 | 18 | 2 | 1 | 2 | 1 | 11.1 (2/18) |
| BS2 | 19 | 7 | 6 | 9 | 5 | 42.1 ( 8/19) |
| BS3 | 19 | 7 | 4 | 9 | 6 | 36.8 (7/19) |
| BS4 | 20 | 10 | 6 | 11 | 9 | 55.0 (11/20) |
| BS5 | 20 | 14 | 10 | 15 | 13 | 70.0 (14/20) |
| BS6 | 20 | 15 | 12 | 14 | 16 | 80.0 (16/20) |
| BS7 | 18 | 14 | 13 | 15 | 13 | 88.9 (16/18) |
| BS8 | 19 | 14 | 14 | 19 | 15 | 84.2 (16/19) |
| SS1 | 19 | 15 | 12 | 16 | 17 | 89.5 (17/19) |
H. pylori BALB/c小鼠适应株BS8感染小鼠后4 wk在胃窦、胃体和胃底的定植密度对数均值分别为5.03±1.16, 4.27±0.93和0.72±2.57, 与SS1的定植密度相比, 相差不显著(P>0.05, 图1). 结果表明, 此H. pylori菌株在胃内定植稳定, 且主要定植于胃窦和胃体部, 胃底部定植较少.
对于感染性疾病来说, 建立一个相适应的动物模型是研究该疾病病原致病力、发病机制和研究开发抗菌药物与疫苗的重要手段. 自1996年Hirayama et al[13]报道了H. pylori感染沙鼠致胃炎、胃溃疡的动物实验以来, 人们发现采用人源性H. pylori分离株感染沙鼠较感染其他动物更易成功, 是目前研究H. pylori致病因子与致病机制最佳的的动物模型[14-16]. 我室在前期经过摸索已成功建立起该感染模型. 然而, 由于缺少针对该动物的检测试剂, 蒙古沙鼠模型在研究H. pylori免疫应答机制方面受到较大限制. 作为较通用的一种实验动物, BALB/c小鼠一直是H. pylori研究者希望攻克的感染模型[17-19]. 考虑到国内外建立比较稳定的H. pylori感染模型均是通过长期体内驯化适应菌株来完成, 如Lee建立BALB/c小鼠模型, 通过传代获得SS1适应株[6], Akopyants et al[20]在悉生乳猪体内连续感染12代, 才获得100%的感染率和>107 CFU/g组织的定植力, Bleich et al[21]通过连续感染蒙古沙鼠使H. pylori定植力提高, 因此, 本课题也对H. pylori沙鼠适应株进行了BALB/c小鼠体内的连续传代感染, 以获得稳定的沙鼠模型和高感染力的适应性菌株. 从试验结果看, 我们经过6代的连续感染后, 感染率可稳定在80%以上, 虽然引起的病理学改变不及感染沙鼠的病理学变化, 但仍然可见到明显的炎症细胞浸润及血管扩张、充血等病理改变, 说明采用驯化的H. pylori适应菌株可建立起稳定的BALB/c小鼠感染模型.
随着弱定植力菌株在BALB/c小鼠体内传代的进行, 感染力呈稳步上升, 那么H. pylori菌株在从不适应到逐渐产生适应性这一过程中是否发生了某种变化? 是基因还是蛋白水平的变化? 对这些变化的研究也许会有助于阐明H. pylori的生理适应性机制及定植机制.
幽门螺杆菌作为一种新发现的病原菌, 其致病性尚未完全阐明, 建立一个实用而稳定的动物感染模型将有助于对其开展深入研究. 前期研究者在蒙古沙鼠模型中取得了较大突破, 但对于在免疫学研究中更有价值的小鼠模型因受到菌株的限制, 还不能有效推广, 需要进一步探索完善该模型.
由于抗生素治疗幽门螺杆菌感染尚存在较多问题, 针对该菌的疫苗研究愈来愈受到关注, 而稳定的小鼠感染模型是一个技术瓶颈, 除了采用特定的BALB/c小鼠适应菌株SS1, 更多研究者通过筛选临床菌株和体内传代对幽门螺杆菌进行适应性驯化, 从而建立稳定的BALB/c小鼠模型.
国内外建立比较稳定的H. pylori感染模型均是通过长期体内驯化适应菌株来完成, 如Lee建立BALB/c小鼠模型, 通过传代获得SS1适应株; Akopyants在悉生乳猪体内连续感染12代, 获得了100%的感染率; Bleich通过连续感染使原本较低感染力的H. pylori菌株定植力提高.
本研究首次采用一株幽门螺杆菌的蒙古沙鼠适应性菌株在BALB/c小鼠体内进行连续传代感染, 使其适应性定植于BALB/c小鼠, 不仅具有稳定的感染率, 而且与SS1株相比, 在小鼠胃内的定植力也无差异.
此模型的成功建立, 对于研究幽门螺杆菌疫苗以及黏膜免疫应答机制将提供较好的技术支持, 对于研究该菌的适应性变异也具有一定的理论价值.
适应性菌株: 即为通过理化或生物学诱导方式使细菌为适应生存环境而发生某种基因组或蛋白质层面的适应性改变. 本文中即指通过体内传代, 逐渐适应性定植于小鼠胃内的幽门螺杆菌菌株.
本文研究了幽门螺杆菌BALB/c小鼠适应性菌株的驯化及模型建立, 选题明确, 设计合理, 数据准确, 对研究幽门螺杆菌的动物模型的建立有一定的理论意义.
电编: 张敏 编辑:王晓瑜
| 1. | Marshall BJ, Warren JR. Unidentified curved bacilli in the stomach of patients with gastritis and peptic ulceration. Lancet. 1984;1:1311-1315. [PubMed] [DOI] |
| 3. | Kodama M, Murakami K, Sato R, Okimoto T, Nishizono A, Fujioka T. Helicobacter pylori-infected animal models are extremely suitable for the investigation of gastric carcinogenesis. World J Gastroenterol. 2005;11:7063-7071. [PubMed] [DOI] |
| 4. | Sun YQ, Petersson F, Monstein HJ, Soderholm JD, Rehfeld JF, Borch K. Long-term morpho-functional development of Helicobacter pylori-induced gastritis in Mongolian gerbils. Scand J Gastroenterol. 2005;40:1157-1167. [PubMed] [DOI] |
| 5. | Konturek PC, Konturek SJ, Brzozowski T. Gastric cancer and Helicobacter pylori infection. J Physiol Pharmacol. 2006;57 Suppl 3:51-65. [PubMed] |
| 6. | Lee A, O'Rourke J, De Ungria MC, Robertson B, Daskalopoulos G, Dixon MF. A standardized mouse model of Helicobacter pylori infection: introducing the Sydney strain. Gastroenterology. 1997;112:1386-1397. [PubMed] [DOI] |
| 8. | Thompson LJ, Danon SJ, Wilson JE, O'Rourke JL, Salama NR, Falkow S, Mitchell H, Lee A. Chronic Helicobacter pylori infection with Sydney strain 1 and a newly identified mouse-adapted strain (Sydney strain 2000) in C57BL/6 and BALB/c mice. Infect Immun. 2004;72:4668-4679. [PubMed] [DOI] |
| 9. | Panthel K, Faller G, Haas R. Colonization of C57BL/6J and BALB/c wild-type and knockout mice with Helicobacter pylori: effect of vaccination and implications for innate and acquired immunity. Infect Immun. 2003;71:794-800. [PubMed] [DOI] |
| 11. | 郭 刚, 王 毅超, 邹 全明, 刘 开云, 解 庆华, 张 卫军. 幽门螺杆菌长期感染蒙古沙鼠模型的建立. 中华微生物学和免疫学杂志. 2001;21:683-684. |
| 13. | Hirayama F, Takagi S, Kusuhara H, Iwao E, Yokoyama Y, Ikeda Y. Induction of gastric ulcer and intestinal metaplasia in mongolian gerbils infected with Helicobacter pylori. J Gastroenterol. 1996;31:755-757. [PubMed] [DOI] |
| 14. | Tatematsu M, Tsukamoto T, Toyoda T. Effects of eradication of Helicobacter pylori on gastric carcinogenesis in experimental models. J Gastroenterol. 2007;42 Suppl 17:7-9. [PubMed] [DOI] |
| 15. | Otaka M, Konishi N, Odashima M, Jin M, Wada I, Matsuhashi T, Horikawa Y, Ohba R, Watanabe S. Is Mongolian gerbil really adequate host animal for study of Helicobacter pylori infection-induced gastritis and cancer? Biochem Biophys Res Commun. 2006;347:297-300. [PubMed] [DOI] |
| 16. | Elfvin A, Bolin I, Von Bothmer C, Stolte M, Watanabe H, Fandriks L, Vieth M. Helicobacter pylori induces gastritis and intestinal metaplasia but no gastric adenocarcinoma in Mongolian gerbils. Scand J Gastroenterol. 2005;40:1313-1320. [PubMed] [DOI] |
| 17. | Zavala-Spinetti L, Breslin MB, Correa H, Begue RE. Development and evaluation of a DNA vaccine based on Helicobacter pylori urease B: failure to prevent experimental infection in the mouse model. Helicobacter. 2006;11:517-522. [PubMed] [DOI] |
| 18. | Wang X, Willen R, Svensson M, Ljungh A, Wadstrom T. Two-year follow-up of Helicobacter pylori infection in C57BL/6 and Balb/cA mice. APMIS. 2003;111:514-522. [PubMed] [DOI] |
| 19. | Rabelo-Goncalves EM, Nishimura NF, Zeitune JM. Development of a BALB/c mouse model of Helicobacter pylori infection with fresh and frozen bacteria. Biol Res. 2005;38:101-109. [PubMed] [DOI] |
| 20. | Akopyants NS, Eaton KA, Berg DE. Adaptive mutation and cocolonization during Helicobacter pylori infection of gnotobiotic piglets. Infect Immun. 1995;63:116-121. [PubMed] |