修回日期: 2007-04-08
接受日期: 2007-04-13
在线出版日期: 2007-04-18
目的: 研究恩替卡韦(ETV)对慢性乙型肝炎(CHB)患者外周血树突状细胞(dendritic cell, DC)功能的影响.
方法: 体外常规分离CHB患者及健康人外周血单个核细胞, 诱导扩增后常规培养. 第4天将其与一定浓度的恩替卡韦共培养, 第8天收获DC进行细胞表型、同种异体混合淋巴细胞反应等相关检测.
结果: 细胞培养8 d时DC形态分化健康对照组优于CHB ETV处理组, CHB ETV处理组优于CHB组; CHB组CD1a (35.73±3.12 vs 62.31±5.22, P<0.01), CD80(28.19±1.64 vs 45.38±3.10, P<0.01), CD83 (22.24±2.14 vs 40.63±7.21, P<0.01)及HLA-DR (36.74±0.98 vs 56.05±3.89, P<0.01)表达明显低于健康对照组, 而ETV处理组与CHB组相比CD83 (27.41±9.23 vs 22.24±2.14, P<0.05), CD80 (32.67±7.82 vs 28.19±1.64, P<0.05)及HLA-DR (40.84±5.57 vs 36.74±0.98, P<0.01)显著高表达; 淋巴细胞增殖能力测定ETV处理组DC刺激同种异体T淋巴细胞增殖能力较CHB组增强(1.53±0.09 vs 1.45±0.12, P<0.05).
结论: 恩替卡韦作为治疗CHB的新一代核苷类药物, 除了直接抑制乙肝病毒DNA合成外, 也能够增强CHB患者外周血DC的功能, 通过调节机体的免疫系统发挥间接抗病毒作用.
引文著录: 卢高峰, 唐芙爱, 郑鹏远, 马军, 白经修. 恩替卡韦对慢性乙型肝炎患者树突状细胞功能的体外影响. 世界华人消化杂志 2007; 15(11): 1292-1296
Revised: April 8, 2007
Accepted: April 13, 2007
Published online: April 18, 2007
AIM: To investigate the effect of entecavir (ETV) on the function of dendritic cells (DC) derived from patients with chronic hepatitis B (CHB) in vitro.
METHODS: Peripheral blood mononuclear cells were isolated from CHB patients and healthy controls. After proliferation under induction, the cells were cultured by routine method. Then ETV was added to co-incubate with the cells on the 4th day. On day 8, DC were collected for the detection of phenotypes and mixed lymphocytic reactions.
RESULTS: After 8 d of cultivation, the differentiation of DC in the healthy controls was better than that in ETV-treated group, while ETV-treated group had a better differentiation than CHB group. In comparison with those in the healthy controls, the levels of CD1a (35.73 ± 3.12 vs 62.31 ± 5.22), CD80 (28.19 ± 1.64 vs 45.38 ± 3.10), CD83 (22.24 ± 2.14 vs 40.63 ± 7.21) and HLA-DR (36.74 ± 0.98 vs 56.05 ± 3.89) expression were significantly decreased in CHB group (all P < 0.01). However, the levels of CD83 (27.41 ± 9.23 vs 22.24 ± 2.14, P < 0.05), CD80 (32.67 ± 7.82 vs 28.19 ± 1.64, P < 0.05) and HLA-DR (40.84 ± 5.57 vs 36.74 ± 0.98, P < 0.01) expression were markedly increased in ETV-treated group as compared with those in CHB group. The capacity to stimulate proliferation of the allogeneic lymphocytes in ETV-treated group was higher than that in CHB group (1.53 ± 0.09 vs 1.45 ± 0.12, P < 0.05).
CONCLUSION: Entecavir can enhance the biological activity of DC derived from CHB patients and play an indirect antivirus function by regulating the host's immune system.
- Citation: Lu GF, Tang FA, Zheng PY, Ma J, Bai JX. In vitro effect of entecavir on the function of dendritic cells derived from chronic hepatitis B patients. Shijie Huaren Xiaohua Zazhi 2007; 15(11): 1292-1296
- URL: https://www.wjgnet.com/1009-3079/full/v15/i11/1292.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i11.1292
树突状细胞(dendritic cell, DC)是人体内抗原递呈能力最强的细胞, 也是唯一能激活初始化T淋巴细胞的抗原递呈细胞(antigen presenting cell, APC), 在抗病毒的细胞免疫中起重要作用[1]. 慢性乙肝(chronic hepatitis B, CHB)形成的重要原因之一是患者自身DC功能低下[2-3]; 恩替卡韦(entecavir, ETV)为一新型口服核苷类药物, 在细胞内经磷酸化后, 与脱氧胞嘧啶核苷(dCTP)竞争进入病毒合成中的DNA链, 终止病毒DNA的复制[4]. 本研究通过检测ETV对CHB患者外周血DC功能的影响, 进一步探讨ETV治疗CHB的机制.
按"慢性乙型肝炎防治指南"[5]为标准, 选择郑州大学第二附属医院消化科门诊和住院患者25例, 年龄18-42(中位29)岁, 男23例, 女2例. 血清学检查乙肝标记皆为HBsAg, HBeAg, HBcAb三项阳性, HBV-DNA>108 copies/L(PCR方法), ALT 1550-7001 nkat/L. 所有患者在实验抽血前3 mo内未接受干扰素、胸腺肽、拉米夫定等抗病毒或免疫调节药物治疗, 未应用过糖皮质激素等免疫抑制剂, 排除合并HCV, HIV等病毒感染, 排除自身免疫相关的其他疾病. 10名健康志愿者作为健康对照, 年龄中位数26岁. RPMI1640培养基为美国Gibco BRL公司产品; 淋巴细胞分离液为天津市津脉基因测绘技术有限公司产品; 重组人白细胞介素4(rhIL-4)、重组人粒细胞-巨噬细胞集落刺激因子(rhGM-CSF)、荧光标记鼠抗人HLA-DR-FITC, CD80-PE, CD83-PE, CDla-PE mAb, 对照抗体IgG-FITC, IgG-PE为美国R&D公司产品; 胎牛血清(FCS)为杭州四季青公司产品; ETV(商品名: 博路定)由中美上海施贵宝制药有限公司提供, 完全培养基成分含: 100 mL/L FBS的RPMI1640培养基, 加入细胞因子rhGM-CSF和rhIL-4, 终浓度均为10 μg/L.
1.2.1 标本采集与DC培养: 参考相关文献[6,7]分别采集CHB患者和健康志愿者抗凝外周静脉血20 mL, 用淋巴细胞分离液分离外周血单个核细胞(PBMC), 生理盐水洗涤(1000 r/min×10 min), 共2次; 以无血清RPMI1640培养基悬浮沉淀细胞, 调整细胞浓度至1×109/L-2×109/L; 按每孔1 mL加入24孔细胞培养板中, 37 ℃, 50 mL/L CO2培养箱中温育3 h后, 以37 ℃预热的RPMI1640培养基轻轻洗去悬浮细胞, 所得贴壁细胞大部分即为单核细胞. 每孔加入2 mL完全培养基, 置于37 ℃, 50 mL/L CO2恒温培养箱中培养, 隔天半量换液, 培养第4天, 按以下分组: (1)健康人对照; (2)CHB阴性对照; (3)CHB患者DC+ETV(0.05 mg/L). 继续培养.
1.2.2 DC形态观察及表型检测: 通过倒置显微镜进行细胞形态学观察; 第8天收集细胞(以下简称DC8). 用流式细胞仪进行细胞表型分析.
1.2.3 同种异体混合淋巴细胞反应: 取健康人外周血, 如前法获得单个核细胞后置入24孔细胞培养板, 37 ℃培养2 h, 取非贴壁细胞即为淋巴细胞作为反应细胞; 上述收获的部分DC8用丝裂霉素C(50 mg/L)孵育30 min后, 分别以1×104/孔加入96孔平底培养板, 每组各3个复孔, 每组再加入同种T淋巴细胞2×105, 终体积为200 μL, 培养72 h, 于培养结束前4 h每孔加入MTT 20 μL, 终止培养, 离心弃去孔内培养液, 每孔加入150 μL DMSO, 振荡10 min, 使结晶物充分溶解. 自动酶联检测仪检测570 nm波长的A值, 结果用3孔均值表示. 设单独DC, T细胞和培养基空白对照孔. 并计算刺激指数(SI)表示增殖情况. SI = 实验组A值/(反应细胞对照组A值+刺激细胞对照组A值).
统计学处理 数据采用均数±标准差表示, 采用SPSS10.0统计软件包进行方差检验处理分析, 组间两两比较采用LSD-t检验. 以α = 0.05为检验水准.
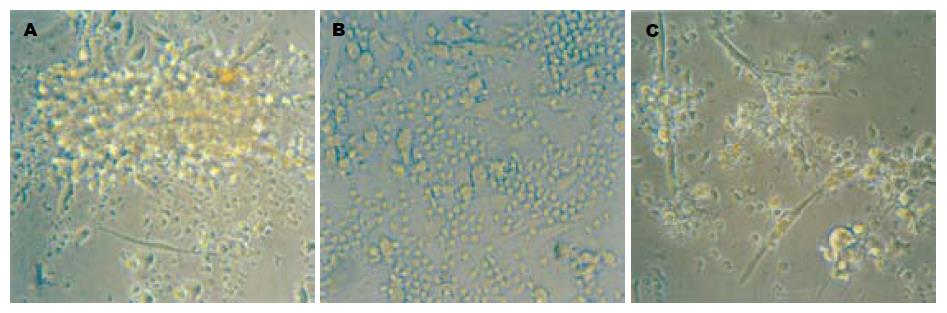
倒置显微镜下, 培养24 h后可见细胞呈集落生长, 3 d后细胞数目明显增多, 体积开始逐渐增大, 胞体拉长; 8 d时健康对照组可见培养液中漂浮着颜色较深、云雾状的细胞团; ETV处理组细胞多方向长突起, 呈不规则状; CHB阴性对照组变形细胞较少(图1).
收集培养第8天DC, 用FITC标记的鼠抗人HLA-DR, CD80和用PE标记的CD83和CD1a抗体, 用流式细胞仪分析显示, DC表型分子CD1a, CD83, CD80和HLA-DR的表达水平, 健康对照组最高, CHB阴性对照组最低, 三组间差异具有统计学意义(P<0.01); 与CHB阴性对照组相比ETV处理组DC高表达CD83, CD80和HLA-DR(表1).
淋巴细胞增殖能力的高低反映了DC的功能状态. 健康对照组DC刺激同种异体T淋巴细胞增殖能力最强(1.79±0.10), ETV组其次(1.53±0.09), CHB对照组最弱(1.45±0.12), 三组间比较差异有统计学意义(P<0.01), 两两比较组间差异也具有统计学意义(P<0.05).
乙型病毒性肝炎慢性化的重要机制之一是免疫耐受, 感染乙肝病毒后首先启动一系列非特异性早期应答, 包括干扰素, NK细胞及枯否氏细胞的活化; 彻底清除病毒则有赖于HBV特异性T细胞[8]. 体内CTL的激活需要未致敏的T淋巴细胞同时接受两个信号, 一个信号是外源性抗原肽经APC加工处理后与MHC I类分子结合并递呈在APC表面, 被T淋巴细胞的T细胞受体所识别; 另一个信号是APC表面表达的协同刺激分子, 即B7分子(如CD80), 被T淋巴细胞的CD28分子所识别. 只有T淋巴细胞同时接受APC所提供的这样两个信号时, 才能被激活[9]. 正常情况下HBV分泌的各种抗原可刺激机体产生多克隆的、HBV抗原特异性的CTL应答, 杀伤携带HBV的靶细胞. 慢性肝炎患者体内树突状细胞抗原递呈功能缺陷, 不能把病毒抗原的信号传递给机体的免疫系统, 患者仅产生弱的或检测不到的针对HBV特异的CTL反应, 所以不能清除体内的病毒, 造成感染的慢性化, 诱导机体内HBV抗原特异性的CD8+ T细胞大幅度下降, 导致机体内抗原特异性T细胞免疫耐受, 造成CHB的发生[10]. 因此, 如果能增强APC的功能, 则可能有助于慢性乙型肝炎的治疗, 我们应用树突状细胞免疫治疗CHB已取得初步成效[11-12].
机体内的APC, 尤其是DC是特异性免疫应答的关键细胞, 启动和介导特异性T细胞免疫应答[13-14]. DC广泛分布于血液、肝、脾、淋巴结以及其他非免疫组织器官中, 数量极微, 仅占所在器官全部细胞的1%以下, 但却是机体内最重要的、功能最强的抗原递呈细胞, 能诱导免疫应答的产生, 同时在诱导免疫耐受和参与免疫应答的调节中也起着重要作用[15-16]. 一般来讲, 外周血来源的DC前体细胞在GM-CSF/IL-4的刺激下培养3-5 d后主要分化为未成熟DC, 摄取、加工抗原或接受某些刺激因素后随之分化为成熟DC[17]. 后者加工、处理抗原能力弱, 递呈抗原能力强[18]. DC摄取抗原并将其处理成具有免疫原性的多肽, 通过交叉递呈, 与MHC I类分子结合后, 以MHC-抗原肽复合物的形式表达于细胞膜表面, 其膜表面的协同刺激分子与T细胞表面相应配体结合, 激活CD8+ T淋巴细胞, 进而激活CTL, 产生免疫应答[19-20]. 若DC膜表面协同刺激分子表达缺陷, 则影响其与T细胞表面相应配体结合, 从而影响机体产生正常免疫应答; 本实验结果表明, CHB患者DC表面低表达CD80、CD83和HLA-DR等共刺激分子, 从免疫应答方面阐明了乙肝病毒感染慢性化的部分机制.
核苷(酸)类似物是目前公认的治疗CHB的药物之一, 能够在细胞内经磷酸化后, 与脱氧胞嘧啶核苷(dCTP)竞争进入病毒合成中的DNA链, 终止病毒DNA的复制, 拉米夫定是该类药物的代表, 张冬云et al[21]曾通过实验发现拉米夫定具有促进CHB患者外周血DC分化成熟的功能; 恩替卡韦作为治疗CHB的新一代核苷类药物, 能够较快抑制乙肝病毒的复制, 降低患者外周血中HBV DNA载量[22], 但其对于慢性乙肝患者机体免疫功能的影响尚不太清楚. 我们通过研究CHB患者的外周血DC发现ETV与DC共孵育后提高了DC表面CD80、CD83、HLA-DR的表达, 在本实验中, 为避免促成熟细胞因子如肿瘤坏死因子α等对DC的成熟的影响, 我们未加任何此类因子; DC表型分子表达上调可能与T淋巴细胞形成共刺激通路而传递抗原信息, 继而激活体内HBV特异性免疫反应; 而与适当浓度恩替卡韦共孵育的DC刺激淋巴细胞增殖能力增强, 也可部分证明这一点, 这初步提示ETV除了直接抑制乙肝病毒DNA合成外, 也能够通过调节机体的免疫系统发挥间接抗病毒作用. 为开展DC免疫治疗和临床应用ETV治疗CHB提供了更多理论依据.
DC与CHB的发生、发展关系很密切, 通过上调DC介导的特异性免疫反应来清除体内的病毒从理论上来说是可行的. ETV作为目前临床上最强的CHB抗病毒药之一, 对于机体免疫系统的影响未见报道, 研究ETV对于CHB患者DC影响有助于更深入的探讨核苷类似物的抗病毒机制.
本文进行了恩替卡韦对慢性乙型肝炎患者树突状细胞功能影响的体外研究, 文章立意具有一定的新颖性, 实验设计比较合理, 采用方法较为成熟, 有一定的临床指导意义.
编辑: 张焕兰 电编:何基才
| 1. | Akbar SM, Inaba K, Onji M. Upregulation of MHC class II antigen on dendritic cells from hepatitis B virus transgenic mice by interferon-gamma: abrogation of immune response defect to a T-cell-dependent antigen. Immunology. 1996;87:519-527. [PubMed] [DOI] |
| 2. | Hilleman MR. Critical overview and outlook: pathogenesis, prevention, and treatment of hepatitis and hepatocarcinoma caused by hepatitis B virus. Vaccine. 2003;21:4626-4649. [PubMed] [DOI] |
| 3. | Beckebaum S, Cicinnati VR, Zhang X, Ferencik S, Frilling A, Grosse-Wilde H, Broelsch CE, Gerken G. Hepatitis B virus-induced defect of monocyte-derived dendritic cells leads to impaired T helper type 1 response in vitro: mechanisms for viral immune escape. Immunology. 2003;109:487-495. [PubMed] [DOI] |
| 4. | Sims KA, Woodland AM. Entecavir: a new nucleoside analog for the treatment of chronic hepatitis B infection. Pharmacotherapy. 2006;26:1745-1757. [PubMed] [DOI] |
| 6. | Duperrier K, Eljaafari A, Dezutter-Dambuyant C, Bardin C, Jacquet C, Yoneda K, Schmitt D, Gebuhrer L, Rigal D. Distinct subsets of dendritic cells resembling dermal DCs can be generated in vitro from monocytes, in the presence of different serum supplements. J Immunol Methods. 2000;238:119-131. [PubMed] [DOI] |
| 7. | Hashimoto S, Suzuki T, Dong HY, Nagai S, Yamazaki N, Matsushima K. Serial analysis of gene expression in human monocyte-derived dendritic cells. Blood. 1999;94:845-852. [PubMed] |
| 8. | Furukawa S, Akbar SM, Hasebe A, Horiike N, Onji M. Production of hepatitis B surface antigen-pulsed dendritic cells from immunosuppressed murine hepatitis B virus carrier: evaluation of immunogenicity of antigen-pulsed dendritic cells in vivo. Immunobiology. 2004;209:551-557. [PubMed] [DOI] |
| 10. | Hasebe A, Akbar SM, Furukawa S, Horiike N, Onji M. Impaired functional capacities of liver dendritic cells from murine hepatitis B virus (HBV) carriers: relevance to low HBV-specific immune responses. Clin Exp Immunol. 2005;139:35-42. [PubMed] [DOI] |
| 11. | 郑 鹏远, 白 蓉, 娄 海山, 唐 芙爱, 白 经修, 司 方明, 琚 新, 徐 建强. HBsAg疫苗冲击树突状细胞联合乙肝免疫球蛋白对慢性乙型肝炎及HBV携带者的疗效. 世界华人消化杂志. 2006;14:1735-1738. [DOI] |
| 12. | 郑 鹏远, 娄 海山, 王 永红, 唐 芙爱, 白 蓉, 司 方明, 白 经修, 琚 新. 特异性免疫治疗母婴传播所致慢性乙型肝炎23例. 世界华人消化杂志. 2006;14:1824-1827. [DOI] |
| 13. | Chinen J, Shearer WT. Basic and clinical immunology. J Allergy Clin Immunol. 2005;116:411-418. [PubMed] [DOI] |
| 14. | Kunitani H, Shimizu Y, Murata H, Higuchi K, Watanabe A. Phenotypic analysis of circulating and intrahepatic dendritic cell subsets in patients with chronic liver diseases. J Hepatol. 2002;36:734-741. [PubMed] [DOI] |
| 15. | Banchereau J, Briere F, Caux C, Davoust J, Lebecque S, Liu YJ, Pulendran B, Palucka K. Immunobiology of dendritic cells. Annu Rev Immunol. 2000;18:767-811. [PubMed] [DOI] |
| 16. | Steinman RM, Hawiger D, Liu K, Bonifaz L, Bonnyay D, Mahnke K, Iyoda T, Ravetch J, Dhodapkar M, Inaba K. Dendritic cell function in vivo during the steady state: a role in peripheral tolerance. Ann N Y Acad Sci. 2003;987:15-25. [PubMed] [DOI] |
| 17. | De Vleeschouwer S, Arredouani M, Adé M, Cadot P, Vermassen E, Ceuppens JL, Van Gool SW. Uptake and presentation of malignant glioma tumor cell lysates by monocyte-derived dendritic cells. Cancer Immunol Immunother. 2005;54:372-382. [PubMed] [DOI] |
| 18. | Rouard H, Léon A, Klonjkowski B, Marquet J, Tennezé L, Plonquet A, Agrawal SG, Abastado JP, Eloit M, Farcet JP. Adenoviral transduction of human 'clinical grade' immature dendritic cells enhances costimulatory molecule expression and T-cell stimulatory capacity. J Immunol Methods. 2000;241:69-81. [PubMed] [DOI] |
| 19. | Neijssen J, Herberts C, Drijfhout JW, Reits E, Janssen L, Neefjes J. Cross-presentation by intercellular peptide transfer through gap junctions. Nature. 2005;434:83-88. [PubMed] [DOI] |
| 20. | Seager Danciger J, Lutz M, Hama S, Cruz D, Castrillo A, Lazaro J, Phillips R, Premack B, Berliner J. Method for large scale isolation, culture and cryopreservation of human monocytes suitable for chemotaxis, cellular adhesion assays, macrophage and dendritic cell differentiation. J Immunol Methods. 2004;288:123-134. [PubMed] [DOI] |