修回日期: 2007-03-20
接受日期: 2007-03-31
在线出版日期: 2007-04-18
目的: 探讨卡巴胆碱对大鼠肠上皮细胞(intes-tinal epithelia cell, IEC)过氧化损伤的影响.
方法: 将H2O2加入IEC培养液中制成IEC过氧化损伤模型. 实验设对照组、H2O2组(2.5 mmol/L)、卡巴胆碱组(卡巴胆碱100 μmol/L). 用四甲基偶氮唑盐(MTT)实验检测IEC的存活率, 测定培养液中测乳酸脱氢酶(LDH)和细胞中丙二醛(MDA)含量.
结果: 与对照组相比, H2O2组LDH (7.40±2.10 vs 0.81±0.12, P<0.01)、MDA水平显著增高(P<0.01), 细胞活力明显降低(37.25%±0.80% vs 100%±0.13%, P<0.01). 卡巴胆碱组与H2O2组相比, LDH漏出MDA形成明显减少(4.64±1.31 vs 7.40±2.10, P<0.01), 细胞的细胞活力显著增加(78.70%±2.80% vs 37.25%±0.80%, P<0.01).
结论: 卡巴胆碱对大鼠IEC过氧化损伤具有保护作用.
引文著录: 邹晓防, 胡森, 吕艺, 孙娜, 石新慧, 李泽峰, 盛志勇. 卡巴胆碱对肠上皮细胞氧化损伤的保护作用. 世界华人消化杂志 2007; 15(11): 1273-1275
Revised: March 20, 2007
Accepted: March 31, 2007
Published online: April 18, 2007
AIM: To study the effects of carbachol on the H2O2-oxidative injury of intestinal epithelial cells (IEC).
METHODS: IEC were cultured with the presence of H2O2in vitro to induce the oxidative injury. IEC were divided into 3 groups: control group, H2O2 (2.5 mmol/L) group and carbachol (100 μmol/L) group. The viability of IEC was measured by MTT assay. The level of lactate dehydrogenase (LDH) in culture media and the malondialdehyde (MDA) content in IEC were measured.
RESULTS: In compared with those in control group, LDH level (7.40 ± 2.10 vs 0.81 ± 0.12, P < 0.01) and MDA content in H2O2 group were significantly elevated, and the viability of IEC was obviously decreased (37.25% ± 0.80% vs 100% ± 0.13%, P < 0.01). However, in carbachol group, LDH level (4.64 ± 1.31 vs 7.40 ± 2.10, P < 0.01) and MDA content were lower while IEC viability was obviously higher than those in H2O2 group (78.70% ± 2.80% vs 37.25% ± 0.80%, P < 0.01).
CONCLUSION: Carbachol can protect rat IEC from the oxidative injury.
- Citation: Zou XF, Hu S, Lv Y, Sun N, Shi XH, Li ZF, Sheng ZY. Protective effects of carbachol on intestinal epithelial cells against oxidative injury. Shijie Huaren Xiaohua Zazhi 2007; 15(11): 1273-1275
- URL: https://www.wjgnet.com/1009-3079/full/v15/i11/1273.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i11.1273
细菌和内毒素的移位是严重烧(创)伤后常见的的过程, 也是引起严重严重烧(创)伤后多器官功能障碍的重要原因之一, 而肠黏膜屏障功能损害是其发生的关键[1,3]. IEC是肠黏膜屏障的重要组成部分. 因此, 减轻IEC结构和功能损伤对严重烧(创)伤的治疗具有重要意义. 前期研究表明, 卡巴胆碱能显著减轻肠缺血再灌流损伤黏膜炎症和病理损害[4,6], 但卡巴胆碱在体外对IEC是否具有保护作用尚无研究. 故本实验H2O2产生·OH攻击损伤正常IEC基础上, 观察卡巴胆碱对IEC的氧化损伤有否具有保护作用, 为卡巴胆碱开发应用提供实验依据.
正常IEC株由协和细胞学中心提供. 卡巴胆碱美国Sigma公司; MTT、DMEM(高糖)均为天津天润善达生物科技有限责任公司产品; 胎牛血清美国Gibico公司; 2.5 g/L胰蛋白酶美国Hyclone公司; 中性短效胰岛素浙江万邦药业股份有限公司; DMSO北京亚太精细化工公司; MDA检测试剂盒南京建成公司; 其他试剂均为分析纯. 二氧化碳恒温孵育箱, 美国Queue System Company公司; 超净工作台中国上海半导体设备一厂; 倒置生物显微镜日本Olympus公司; 日立7170型全自动生化分析仪日本日立公司; 全波长多功能酶标仪美国Dynex Technoloes, Inc公司.
1.2.1 细胞培养和处理方法: 细胞培养在含50 mL/L胎牛血清和10 g/L胰岛素DMEM(高糖)培养液中, 置37 ℃、饱和湿度含50 mL/L CO2和950 mL/L空气的培养箱中无菌培养. 细胞培养至对数生长期. H2O2组加入2.5 mmol/L H2O2(溶于无血清培养基中), 卡巴胆碱组预先30 min给予卡巴胆碱(卡巴胆碱100 μmol/L)然后加入2.5 mmol/L H2O2, 对照组只给无血清培养液. 于处理后4 h收集细胞.
1.2.2 细胞LDH漏出量的检测: 取对数生长期肠上皮细胞调整至108/L, 接种于24孔板上, 每孔0.3 mL. 置37 ℃, 50 mL/L CO2培养24 h后, 弃原培养液, 按上述方法处理各组, 每组设6个复孔. 到达反应时间后, 留取上层培养液, 用生化分析仪测LDH, 取6孔平均值.
1.2.3 MTT检测: 取对数生长期肠上皮细胞调整至107/L, 接种于96孔板上, 每孔200 μL. 置37 ℃, 50 mL/L CO2培养24 h后, 弃原培养液, 按上述方法处理各组, 每组设6个复孔. 处理4 h后, 每孔加入无血清培养基200 μL和MTT溶液20 μL(5 g/L)37 ℃继续培养4 h, 小心吸去上清, 每孔加入DMSO 150 μL, 振荡10 min后, 使结晶物充分溶解, 空白对照调零, 用酶标仪测定各孔波长在490 nm(A490)的吸光值(A). 细胞生存率计算公式+: 细胞的生存率 = 处理组A490/正常组A490×100%.
1.2.4 MDA检测: 硫代巴比妥酸法检测细胞中MDA含量.
统计学处理 所的数据用SPSS11.0软件进行分析, 数据均以均数±标准差(mean±SD)表示, 以数据不同进行方差分析和卡方检验.
H2O2组细胞LDH漏出量显著高于对照组(P<0.01), 卡巴胆碱组细胞LDH漏出量显低于H2O2组(P<0.01). 通过MTT实验检测各组的OD值间接反映细胞的生存率. H2O2组IEC生存率明显低于对照组(P<0.01), 卡巴胆碱组IEC生存率明显高于H2O2组(P<0.01)(表1).
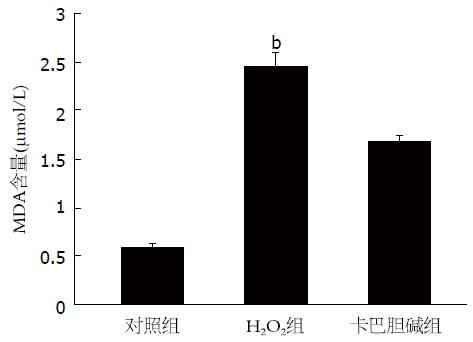
H2O2组细胞MDA含量显著高于对照组和卡巴胆碱组(P均<0.01)(图1).
IEC的主要功能包括吸收营养物质、构成肠黏膜屏障以及递呈抗原和分泌细胞因子等. IEC位于肠机械屏障的最外层, 处于机体与外界抗原和毒素接触的第一线, 时刻与外界抗原和毒素接触. IEC损伤后必然导致黏膜屏障功能破坏[7-8], 引起细菌和内毒素的移位, 同时启动肠道局部和全身炎症及免疫反应, 而这一过程在烧(创)伤后全身炎症反应和MODS的过程中起重要作用. 因此, 减轻IEC的损害, 维持IEC的正常结构和功能是临床上治疗烧(创)伤后全身炎症反应和MODS的重要措施之一.
胆碱能抗炎通路是最近提出的一条新的神经-内分泌抗炎途径. Borovikova et al[9]研究发现, 副交感神经主要递质乙酰胆碱在体外能有效地抑制LPS刺激外周巨噬细胞释放致炎介质TNF-α. 与常规炎症反应的速度(数小时到数天)相比, 神经信号极其迅速, 这种调节特性对于维持炎症反应早期关键阶段的免疫激活是有益的. 神经系统对生理功能的控制是短暂的, 短期内如果没有进一步的神经传入信号, 反应细胞将恢复功能. 短暂抑制后免疫功能的恢复有助于在严重威胁或感染时产生必要且有效的免疫反应. 研究表明, 刺激迷走神经传出支可抑制大鼠内毒素血症时的全身炎症反应[10]. 卡巴胆碱是一种胆碱能激动剂, 作用于M和N胆碱受体, 在体内不易被水解. 本实验室前期研究发现卡巴胆碱在体内对肠组织具有保护作用. 研究表明, 卡巴胆碱能抑制肠缺血再灌流损伤模型血浆TNF-α水平, 全身炎症反应, 同时对肠上皮细胞具有保护作用[11-12], 但体外氧化应激时卡巴胆碱对IEC是否具有保护作用尚不清楚. 本实验设想卡巴胆碱对IEC氧化应激损伤具有一定的影响.
氧化应激是机体活性氧的产生过多和或机体抗氧化能力下降, 活性氧清除不足, 导致体内活性氧增多并引起细胞氧化损伤的病理过程. 在氧化应激过程中, 自由基所形成的氧化过度具有重要影响, 且羟自由基对这种损伤起主要作用[13]. 本实验中以H2O2处理体外培养的IEC, 模拟体内氧化应激损伤IEC情况. LDH是细胞受损时的敏感指标, 细胞受损时, 在细胞形态还没有发生改变之前就出现明显的改变. MDA反映细胞受氧化应激时脂质过氧化程度从而间接的反映细胞损伤的程度. 结果显示H2O2可对IEC损害作用, MDA含量升高并导致细胞生存率下降, 预先给予卡巴胆碱可减轻H2O2对IEC损害作用, 抑制MDA的形成, 减轻氧化损伤, 提高细胞生存率, 从细胞水平证明体外氧化应激时卡巴胆碱对IEC具有保护作用, 但卡巴胆碱抗氧化损伤的机制有待进一步研究.
实验结果表明, 卡巴胆碱能减轻IEC氧化应激损伤. 本研究为临床治疗严重烧(创)后常见的肠屏障功能损害提供了新的有效途径, 对于防治严重烧(创)后全身炎症反应和MODS具有一定的意义.
肠上皮细胞和细胞间紧密连接是构成肠黏膜机械屏障的重要组成部分, 与外界细菌及毒素直接接触. 严重应激状态下, 肠上皮细胞的损害使肠黏膜的通透性增加, 造成细菌及内毒素的移位, 引起肠源性内毒素血症和脓毒症, 这与脓毒症和MODS的发生有密切关系. 为此, 减轻肠上皮细胞损害一直是临床研究热点之一.
本实验以往研究表明, 体内卡巴胆碱肠缺血再灌流引起的肠上皮细胞具有保护作用, 但体外氧化应激时, 卡巴胆碱是否对肠上皮细胞具有保护作用尚无报道, 本文着重研究了体外氧化应激时卡巴胆碱对肠上皮细胞的作用.
乙酰胆碱在体内容易被胆碱酯酶水解而失去其作用, 难以应用临床上. 卡巴胆碱是一种胆碱能激动剂, 作用于M和N胆碱受体, 且N样作用强于乙酰胆碱, 在体内不易被水解, 可应用临床, 发挥其抗炎作用.
胆碱能抗炎通路: 胆碱能抗炎通路是最近提出的一条新抗炎途径, 是指中枢神经系统通过胆碱能神经及其递质乙酰胆碱(Ach)调节或对抗局部及全身炎症反应的通路. 胆碱能抗炎通路与常规炎症反应的速度(数小时到数天)相比, 神经信号极其迅速, 且定位准确.
本研究的重点是卡巴胆碱在体外对肠上皮细胞是否具有保护作用. 该科研课题的设计比较严谨, 实验对照的设计也较合理, 结果可信, 具有一定的临床指导意义.
编辑: 王晓瑜 电编:何基才
| 1. | Fang WH, Yao YM, Shi ZG, Yu Y, Wu Y, Lu LR, Sheng ZY. Effect of recombinant bactericidal/permeability-increasing protein on endotoxin translocation and lipopolysaccharide-binding protein/CD14 expression in rats after thermal injury. Crit Care Med. 2001;29:1452-1459. [PubMed] [DOI] |
| 3. | Mole DJ, Taylor MA, McFerran NV, Diamond T. The isolated perfused liver response to a 'second hit' of portal endotoxin during severe acute pancreatitis. Pancreatology. 2005;5:475-485. [PubMed] [DOI] |
| 6. | Cinel I, Buyukafsar K, Cinel L, Polat A, Atici S, Tamer L, Oral U. The role of poly(ADP-ribose) synthetase inhibition in preventing endotoxemia-induced intestinal epithelial apoptosis. Pharmacol Res. 2002;46:119-127. [PubMed] [DOI] |
| 7. | Aranow JS, Fink MP. Determinants of intestinal barrier failure in critical illness. Br J Anaesth. 1996;77:71-81. [PubMed] [DOI] |
| 8. | Berkes J, Viswanathan VK, Savkovic SD, Hecht G. Intestinal epithelial responses to enteric pathogens: effects on the tight junction barrier, ion transport, and inflammation. Gut. 2003;52:439-451. [PubMed] [DOI] |
| 9. | Borovikova LV, Ivanova S, Zhang M, Yang H, Botchkina GI, Watkins LR, Wang H, Abumrad N, Eaton JW, Tracey KJ. Vagus nerve stimulation attenuates the systemic inflammatory response to endotoxin. Nature. 2000;405:458-462. [PubMed] [DOI] |
| 11. | 邹 晓防, 林 凯, 吕 艺, 黎 君友, 陆 江阳, 胡 森, 盛 志勇. 缺血-再灌流时卡巴胆碱对大鼠肠上皮细胞的保护作用. 世界华人消化杂志. 2007;15:625-628. [DOI] |