修回日期: 2007-02-01
接受日期: 2007-02-08
在线出版日期: 2007-04-18
目的: 观察受体骨髓间质干细胞(BM-MSCs) 在大鼠原位肝移植后体内的分布与作用.
方法: 以Wistar大鼠为供体, SD大鼠为受体采用双袖套法制作原位肝移植模型, 密度梯度离心法分离与贴壁法富集受体BM-MSCs. CFSE标记术后经门静脉注入, 荧光显微镜分别观测术后1 wk, 2 wk, 1 mo肝脾肺肾组织中BM-MSCs的分布及各时间点检测肝功能及肝组织免疫排斥情况.
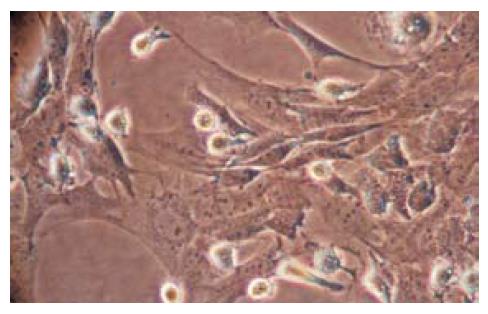
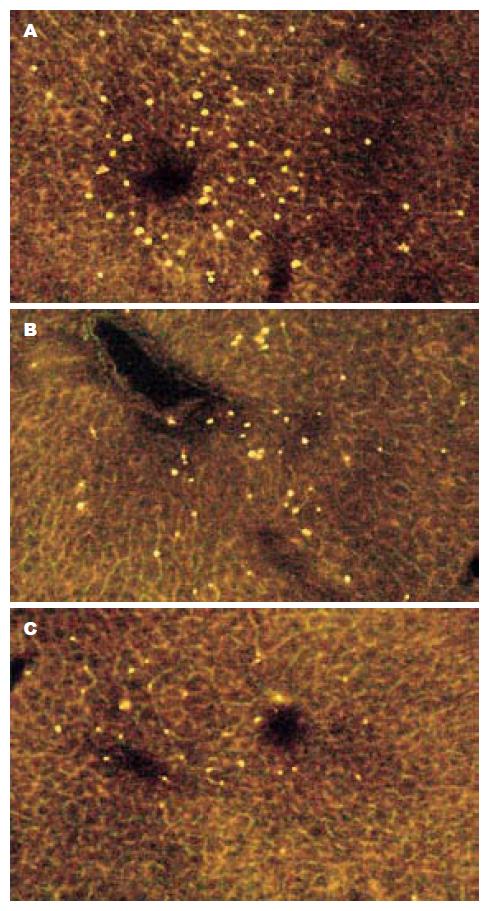
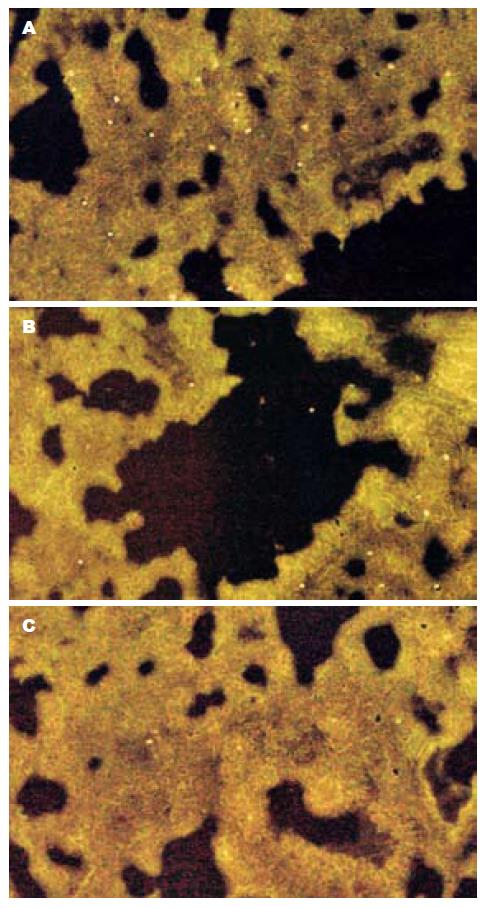
结果: 密度梯度离心所得到的BM-MSCs为比较一致的球形单个核细胞, 台盼蓝染色细胞活力达98%左右, 其他细胞少见. BM-MSCs体外分离培养扩增至第3代后较为纯化. 应用CFSE可快速高效的标记贴壁BM-MSCs. 移植的BM-MSCs主要在受体肝脏中聚集, 1 mo后略有减少, 而脾肺肾组织内BM-MSCs在1 mo后仅有极少分布. B组无BM-MSCs输入与C组有BM-MSCs输入肝功能比较, C组肝功能有明显好转, B, C组间差异有显著意义(F = 63.179, P<0.01), B, C组各时段肝功能差异有显著性意义(F = 221.026, P<0.01). C组肝组织免疫排斥反应明显减轻.
结论: 原位肝移植术后输注受体BM-MSCs可有效缓解免疫排斥反应.
引文著录: 谭浩翔, 高毅, 张会迎, 王琼. 受体骨髓间质干细胞在大鼠原位肝移植中对免疫排斥的影响. 世界华人消化杂志 2007; 15(11): 1191-1197
Revised: February 1, 2007
Accepted: February 8, 2007
Published online: April 18, 2007
AIM: To investigate the distribution and effect of recipient-derived bone marrow mesenchymal stem cells (BM-MSCs) after orthotopic liver transplantation.
METHODS: The model of orthotopic liver transplantation was established using two-cuff method. Wistar rats were used as donors while Sprague Dawley rats were selected as recipients. The BM-MSCs were isolated by the combination of gradient density centrifugation and adhesion separation. The collected BM-MSCs were labeled with 5, 6-carboxyfluorescein diacetate succinimidyl ester (CFSE) and then infused into livers via portal vein after the operation. The distributions of BM-MSCs in liver, spleen, lung, and kidney were detected by fluorescence microscope 1、2 wk and 1 mo after the operation. Hepatic functions and immunological rejection in liver tissues were also detected.
RESULTS: BM-MSCs collected by gradient density centrifugation grew in an adhesion mode on the wall and had a ball-like appearance. The cells viability detected by trypanblau staining was about 98%. BM-MSCs were purified at the 3th generation. The method of labeling BM-MSCs with CFSE had high efficiency. After infusion, most BM-MSCs congregated in liver and reduced a little after one month. However, only few of them existed in spleen, lung and kidney. Liver function of group C, which received BM-MSCs infusion, was remarkably improved as compared with that of group B, which didn't received BM-MSCs infusion (F = 63.179, P < 0.01). The liver function was also statistically different between B and C group at various time points (F = 221.026, P < 0.01). Immunohistochemistry showed that the acute immunological rejection was dramatically alleviated in group C.
CONCLUSION: Infusion of recipient-derived BM-MSCs can alleviate acute immunological rejection after orthotopic liver transplantation.
- Citation: Tan HX, Gao Y, Zhang HY, Wang Q. Effect on immunological rejection by recipient-derived bone marrow mesenchymal stem cells after orthotopic liver transplantation. Shijie Huaren Xiaohua Zazhi 2007; 15(11): 1191-1197
- URL: https://www.wjgnet.com/1009-3079/full/v15/i11/1191.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i11.1191
肝移植是治疗中末期肝病的主要方法, 但移植后的免疫排斥反应大大影响了疗效与预后. 骨髓间充质干细胞(BM-MSCs)属于多功能干细胞, 体外实验发现, BM-MSCs与淋巴细胞关系密切, 为了解BM-MSCs在原位肝移植后对机体的影响, 本实验将受体BM-MSCs标记后移植入受体大鼠体内, 观测他的分布与作用.
SPF级SD大鼠与Wistar大鼠各60只, 雌雄不拘, 体质量150-250 g, 购自南方医科大学动物中心, Percoll细胞分离液购自美国Pharmacia公司、L-DMEM购自美国Gibco公司, 胎牛血清购自杭州四季青生物公司、CFSE染色剂购自美国Molecular Probes Invitrogen公司.
1.2.1 BM-MSCs的获取: 取SD大鼠股骨内骨髓, 密度梯度离心法分离与贴壁法分离培养BM-MSCs. 第3天换液, 第10天传代.
1.2.2 动物分组: 随机分为3组, 每组SD与Wistar大鼠各10只, A组: 假手术+BM-MSCs; B组: 原位肝移植术; C组: 原位肝移植术+BM-MSCs. Kamada双袖套法制作原位肝移植模型[1].
1.2.3 CFSE标记BM-MSCs体内示踪: 取第3代BM-MSCs约1×107个, 用浓度为5 μmol/L的CFSE标记10 s, 100 mL/L胎牛血清终止, DMEM约1 mL重悬, 荧光显微镜观测确认染色, 于原位肝移植术后经门静脉注入各组, 于术后1 wk, 2 wk, 1 mo取肝脾肺肾组织, 冰冻切片5 μm, 荧光显微镜下观测分布情况.
1.2.4 肝功能检测: 各组于术后1 wk, 2 wk, 1 mo取尾静脉血1 mL测谷丙转氨酶(ALT), 总胆红素(TBiL)值.
1.2.5 肝组织免疫排斥反应检测: 各组于术后1 wk, 2 wk, 1 mo取肝组织, 石蜡包埋, 免疫组化采用sABC法, 行HE染色. 按照Williams et al[2]的方法, 根据移植肝的组织病变情况, 将急性排斥反应的程度分为4级.
BM-MSCs密度梯度离心所得到的细胞为比较一致的球形单个核细胞, 苔盼蓝染色细胞活力达98%左右, 其他细胞少见. 应用CFSE可快速高效的标记贴壁BM-MSCs(图1-2).
A组: 术后1 wk肝脾肺肾组织内未见BM-MSCs分布; B组未输注BM-MSCs; C组术后1 wk, 2 wk, 1 mo肝脾肺肾组织内BM-MSCs分布如图3-6所示: 肝脏为其主要分布部位且有较长的聚集期, 脾肺肾组织有少量分布, 聚集时间短暂.
各组术后各时间点肝功能比较, C组有BM-MSCs注入肝功能损害轻微, 恢复较为迅速(表1).
| 分组 | ALT(nkat/L) | TBiL(μmol/L) | ||||
| 术后1 wk | 术后2 wk | 术后1 mo | 术后1 wk | 术后2 wk | 术后1 mo | |
| A | 655.29±5.84 | 604.94±2.84 | 664.9±1.67 | 6.52±1.31 | 7.22±1.15 | 6.48±2.09 |
| B | 4750.77±4.51 | 2993.25±8.85 | 2501.75±1.85 | 32.06±1.62 | 28.06±2.98 | 23.06±1.13 |
| C | 3246.97±1.84 | 2169.85±3.32 | 1045.33±5.29 | 23.43±2.91 | 17.15±3.44 | 12.66±1.74 |
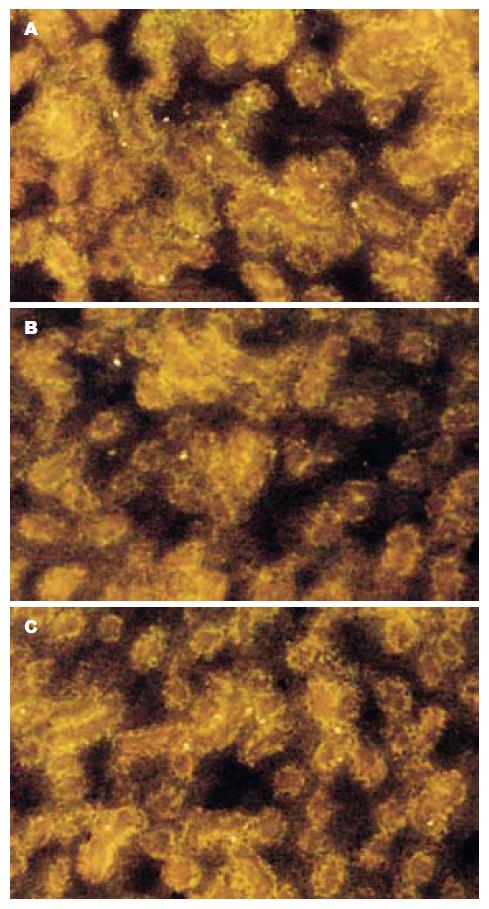
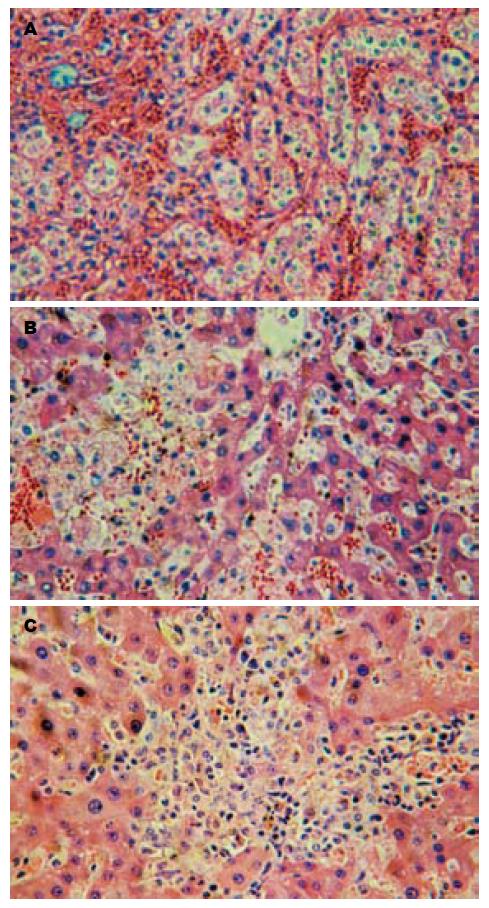
B组呈重度急性排斥反应, 表现为肝细胞索状排列紊乱, 可见气球样变, 汇管区大量炎性细胞浸润, 血管内膜损伤, 有明显出血, 可见肝细胞坏死, 术后1 mo恢复缓慢. C组呈轻度急性排斥反, 术后1 wk可见汇管区中等量单核细胞浸润, 肝细胞轻度浊肿、气球样变, 血管轻度扩张充血; 术后2 wk细胞浸润减少; 术后1 mo肝细胞索状排列整齐, 小叶结构清晰, 基本恢复正常(图7, 图8).
间充质干细胞(mesenchymal stem cells, MSCs)是由Gao et al[3]参考Friedenstein et al[4]在骨髓基质中通过Percoll密度离心后得到的一类贴壁纺锤形SH2, SH3抗体阳性细胞而正式命名. MSCs体内分布比较广泛, 有关研究发现MSCs可以存在于脐带[5]、骨髓[6]、肌肉皮肤[7]、脂肪[8]、关节软骨[9]、血管[10]、胰脏[11]等组织内. Tuli et al[12]认为骨髓(bone marrow, BM)是MSCs含量最丰富与最易于获取的组织, 此后MSCs被视为体内无组织特异性的修复性细胞库. 机体受损后可以通过多种信号途径直接激活MSCs增殖分化为相应组织细胞, 最终使损伤得到修复. 这些信号途径包括外伤、炎症、肿瘤、趋化因子与微环境等[13-15]. MSCs通过这些途径激活后可向多种细胞分化, 如可以向软骨细胞[16]、成骨细胞、脂肪细胞[6]、神经细胞[17]和心肌细胞[18]等细胞分化. 新近研究认为BM-MSCs还可以向肝细胞分化, 如周一鸣et al[19]在体外利用肝细胞生长因子诱导小鼠BM-MSCs向肝细胞分化, 汤志华et al[20]利用人BM-MSCs也得到了同样的结论. 而王韫芳et al[21]、吴雄志et al[22]进一步将BM-MSCs植入肝损伤鼠体内后, 发现BM-MSCs在第3天即有卵圆细胞的标记物出现, 第5天即有AFP的表达.
此外由于BM-MSCs还可以分泌白介素-6、-7、-8、-11、干细胞生长因子、粒细胞-巨噬细胞集落刺激因子、转化生长因子等多种细胞因子及黏附分子, 细胞表面还存在多种相关细胞因子受体等特性[23,24], 使得BM-MSCs还具有免疫调节效应. 目前有关BM-MSCs的免疫抑制作用已有不少研究. Di Nicola et al[25]的实验发现, BM-MSCs可以抑制协同刺激分子CD80对同种异体T淋巴细胞增殖效应, Rasmusson et al[26]的实验也显示, BM-MSCs能够抑制T细胞增殖, 同时认为BM-MSCs的免疫抑制具有可逆性, 将BM-MSCs去除T细胞增殖应答又可恢复, 其程度与BM-MSCs数量呈正相关. 在体内实验中Zhou et al[27]证实, 异体BM-MSCs可减轻Fisher344大鼠心脏移植过程中的T细胞反应并可能诱导免疫耐受, Bartholomew et al[28]在狒狒异体皮肤移植中使用1×107-2×107/kg个BM-MSCs, 认为疗效与使用环孢素相当.
肝移植作为治疗肝病的新方法逐渐得到广泛运用, 但免疫排斥是影响术后疗效的主要原因, 免疫排斥导致移植肝脏结构与功能的破坏. 因此利用BM-MSCs可以向肝细胞分化潜能, 将受体BM-MSCs输注入术后移植供肝内, 将可能在这一特定微环境中对损伤供体肝细胞发挥替代效应, 使被破坏的供肝细胞数量得以恢复、肝功能缓解. 同样也可利用受体BM-MSCs的免疫抑制效应减少供体肝术后的移植物抗宿主反应.
我们首先应用CFSE标记BM-MSCs观测其在原位肝移植术后的体内分布. CFSE是一种良好的细胞标记物, 定位于细胞膜、细胞质和细胞核, 以细胞核的荧光染色最强. CFSE不影响细胞的增殖能力, 当细胞分裂时, CFSE标记荧光可平均分配至两个子代细胞中, 从而使荧光强度逐渐减弱[29]. 而以SD大鼠为受体, Wistar大鼠为供体的双袖套法原位肝移植则为目前通用的肝移植排斥模型. 实验发现, 当BM-MSCs经门静脉注入后绝大部分长时期聚集于供体肝脏. 在术后1 wk, 2 wk, 1 mo停留在肝脏内的BM-MSCs数量变化不大, 而相对于脾肺肾组织BM-MSCs的分布较少, 停留时间也较短. 提示供体肝脏为受体BM-MSCs提供了定居微环境, 在该模型1-2 wk期间, 为免疫排斥较为严重的时期, 此时应有大量供肝细胞的坏死与受体淋巴细胞的浸润, 但由于受体BM-MSCs在1 wk, 2 wk, 1 mo 3个时间段持续聚集于肝脏, 此时各时间点相应肝功能均有不同程度缓解, 相应镜下表现为供肝细胞的坏死与受体淋巴细胞的浸润减少, 提示免疫排斥反应有明显减轻, 肝功能恢复迅速.
我们初步证实了原位肝移植术后输注受体BM-MSCs主要分布部位与作用, 对其替代学与免疫学变化将在下一步进行探讨.
肝移植术是治疗中末期肝病的重要方法, 免疫排斥反应是术后主要并发症, 骨髓间充质干细胞的多向分化能力与免疫特性可以为肝移植术后治疗提供新途径.
骨髓间充质干细胞的分化方向与其所处微环境有关, 体外实验已经证实骨髓间充质干细胞可以向肝细胞分化, 供体移植肝环境是否诱导受体骨髓间充质干细胞向肝细胞分化并发挥作用是目前该领域的研究热点.
BM-MSCs的定向分化与免疫特性目前均有研究. 王韫芳et al将BM-MSCs植入肝损伤鼠体内后, 发现BM-MSCs可以向肝细胞分化, Zhou et al证实异体BM-MSCs可减轻Fisher344大鼠心脏移植过程中的T细胞反应并可能诱导免疫耐受.
本实验应用CFSE将受体骨髓间充质干细胞标记后体内示踪, 发现了受体骨髓间充质干细胞在原位肝移植术后的分布规律与可能治疗效果.
利用骨髓间充质干细胞的多分化潜能, 加之受体骨髓间充质干细胞具有取材方便、可重复及不受自身免疫攻击等优势, 骨髓间充质干细胞可能会在移植领域得到广泛应用.
本文研究了受体骨髓间质干细胞在大鼠原位肝移植中对免疫排斥的作用, 提示原位肝移植术后输注受体MSCs可缓解免疫排斥反应, 方法可靠, 结论可信, 具有一定的理论与实践意义.
编辑: 王晓瑜 电编:张敏
| 1. | Kamada N, Calne RY. A surgical experience with five hundred thirty liver transplants in the rat. Surgery. 1983;93:64-69. [PubMed] |
| 2. | Williams JW, Peters TG, Vera SR, Britt LG, van Voorst SJ, Haggitt RC. Biopsy-directed immunosuppression following hepatic transplantation in man. Transplantation. 1985;39:589-596. [PubMed] [DOI] |
| 3. | Gao J, Dennis JE, Muzic RF, Lundberg M, Caplan AI. The dynamic in vivo distribution of bone marrow-derived mesenchymal stem cells after infusion. Cells Tissues Organs. 2001;169:12-20. [PubMed] [DOI] |
| 4. | Friedenstein AJ, Chailakhjan RK, Lalykina KS. The development of fibroblast colonies in monolayer cultures of guinea-pig bone marrow and spleen cells. Cell Tissue Kinet. 1970;3:393-403. [PubMed] [DOI] |
| 5. | Romanov YA, Svintsitskaya VA, Smirnov VN. Searching for alternative sources of postnatal human mesenchymal stem cells: candidate MSC-like cells from umbilical cord. Stem Cells. 2003;21:105-110. [PubMed] [DOI] |
| 6. | Jones EA, Kinsey SE, English A, Jones RA, Straszynski L, Meredith DM, Markham AF, Jack A, Emery P, McGonagle D. Isolation and characterization of bone marrow multipotential mesenchymal progenitor cells. Arthritis Rheum. 2002;46:3349-3360. [PubMed] [DOI] |
| 7. | Young HE, Steele TA, Bray RA, Hudson J, Floyd JA, Hawkins K, Thomas K, Austin T, Edwards C, Cuzzourt J. Human reserve pluripotent mesenchymal stem cells are present in the connective tissues of skeletal muscle and dermis derived from fetal, adult, and geriatric donors. Anat Rec. 2001;264:51-62. [PubMed] [DOI] |
| 8. | De Bari C, Dell'Accio F, Vandenabeele F, Vermeesch JR, Raymackers JM, Luyten FP. Skeletal muscle repair by adult human mesenchymal stem cells from synovial membrane. J Cell Biol. 2003;160:909-918. [PubMed] [DOI] |
| 9. | Alsalameh S, Amin R, Gemba T, Lotz M. Identification of mesenchymal progenitor cells in normal and osteoarthritic human articular cartilage. Arthritis Rheum. 2004;50:1522-1532. [PubMed] [DOI] |
| 10. | Abedin M, Tintut Y, Demer LL. Mesenchymal stem cells and the artery wall. Circ Res. 2004;95:671-676. [PubMed] [DOI] |
| 11. | Hu Y, Liao L, Wang Q, Ma L, Ma G, Jiang X, Zhao RC. Isolation and identification of mesenchymal stem cells from human fetal pancreas. J Lab Clin Med. 2003;141:342-349. [PubMed] [DOI] |
| 12. | Tuli R, Seghatoleslami MR, Tuli S, Wang ML, Hozack WJ, Manner PA, Danielson KG, Tuan RS. A simple, high-yield method for obtaining multipotential mesenchymal progenitor cells from trabecular bone. Mol Biotechnol. 2003;23:37-49. [PubMed] [DOI] |
| 13. | Metheny-Barlow LJ, Tian S, Hayes AJ, Li LY. Direct chemotactic action of angiopoietin-1 on mesenchymal cells in the presence of VEGF. Microvasc Res. 2004;68:221-230. [PubMed] [DOI] |
| 14. | Palermo AT, Labarge MA, Doyonnas R, Pomerantz J, Blau HM. Bone marrow contribution to skeletal muscle: a physiological response to stress. Dev Biol. 2005;279:336-344. [PubMed] [DOI] |
| 15. | Otto WR, Rao J. Tomorrow's skeleton staff: mesenchymal stem cells and the repair of bone and cartilage. Cell Prolif. 2004;37:97-110. [PubMed] [DOI] |
| 16. | Yoo JU, Barthel TS, Nishimura K, Solchaga L, Caplan AI, Goldberg VM, Johnstone B. The chondrogenic potential of human bone-marrow-derived mesenchymal progenitor cells. J Bone Joint Surg Am. 1998;80:1745-1757. [PubMed] |
| 17. | Black IB, Woodbury D. Adult rat and human bone marrow stromal stem cells differentiate into neurons. Blood Cells Mol Dis. 2001;27:632-636. [PubMed] [DOI] |
| 18. | Makino S, Fukuda K, Miyoshi S, Konishi F, Kodama H, Pan J, Sano M, Takahashi T, Hori S, Abe H. Cardiomyocytes can be generated from marrow stromal cells in vitro. J Clin Invest. 1999;103:697-705. [PubMed] [DOI] |
| 21. | 王 韫芳, 南 雪, 尉 承泽, 李 艳华, 张 锐, 管 立东, 岳 文, 裴 雪涛. 丙烯醇致肝损伤微环境定向诱导骨髓干细胞向肝细胞分化. 中华肝脏病杂志. 2005;13:274-277. |
| 23. | Deans RJ, Moseley AB. Mesenchymal stem cells: biology and potential clinical uses. Exp Hematol. 2000;28:875-884. [PubMed] [DOI] |
| 24. | Le Blanc K, Tammik C, Rosendahl K, Zetterberg E, Ringdén O. HLA expression and immunologic properties of differentiated and undifferentiated mesenchymal stem cells. Exp Hematol. 2003;31:890-896. [PubMed] [DOI] |
| 25. | Di Nicola M, Carlo-Stella C, Magni M, Milanesi M, Longoni PD, Matteucci P, Grisanti S, Gianni AM. Human bone marrow stromal cells suppress T-lymphocyte proliferation induced by cellular or nonspecific mitogenic stimuli. Blood. 2002;99:3838-3843. [PubMed] [DOI] |
| 26. | Rasmusson I, Ringdén O, Sundberg B, Le Blanc K. Mesenchymal stem cells inhibit lymphocyte proliferation by mitogens and alloantigens by different mechanisms. Exp Cell Res. 2005;305:33-41. [PubMed] [DOI] |
| 27. | Zhou HP, Yi DH, Yu SQ, Sun GC, Cui Q, Zhu HL, Liu JC, Zhang JZ, Wu TJ. Administration of donor-derived mesenchymal stem cells can prolong the survival of rat cardiac allograft. Transplant Proc. 2006;38:3046-3051. [PubMed] [DOI] |
| 28. | Bartholomew A, Sturgeon C, Siatskas M, Ferrer K, McIntosh K, Patil S, Hardy W, Devine S, Ucker D, Deans R. Mesenchymal stem cells suppress lymphocyte proliferation in vitro and prolong skin graft survival in vivo. Exp Hematol. 2002;30:42-48. [PubMed] [DOI] |
| 29. | 陈 蕾蕾, 陈 军浩, 孙 雪梅, 施 广飞. 荧光染料CFSE作为细胞标记的特性研究. 细胞与分子免疫学杂志. 2004;20:140-141. |