修回日期: 2006-12-10
接受日期: 2006-12-18
在线出版日期: 2007-04-18
目的: 探讨P2X受体激动剂α, β-methylene ATP (α, β-MeATP)对豚鼠胃窦环行肌运动的影响及其离子通道机制.
方法: 采用EWG/B豚鼠, 制备去黏膜胃窦环行肌条(10×1.5 mm), 并将其固定于恒温灌流槽内(37 ℃), 用碳酸氢钠缓冲液连续灌流并通氧(950 mL/L O2, 50 mL/L CO2). 利用SMUP-E生物信号处理系统记录胃窦平滑肌自发性收缩活动, Ⅱ型胶原酶消化法分离豚鼠胃窦环行肌单细胞, 传统全细胞膜片钳技术记录急性分离的胃窦平滑肌细胞膜电位和离子电流, 包括钙激活钾电流、延迟整流型钾电流及电压依赖性钙电流.
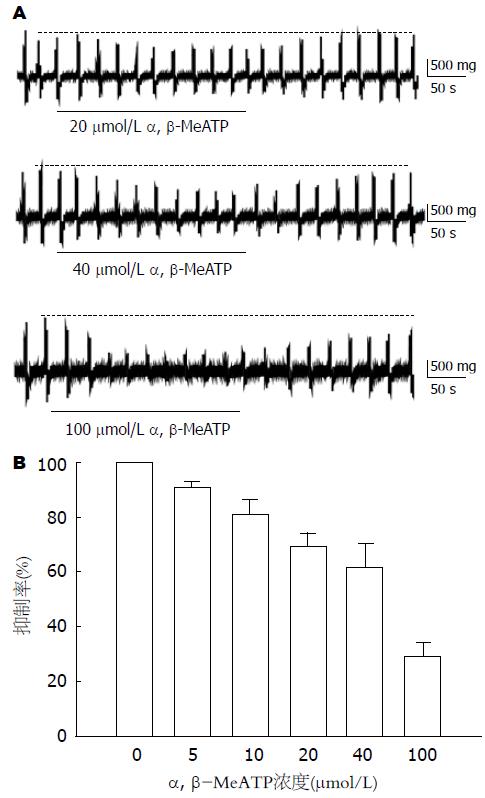
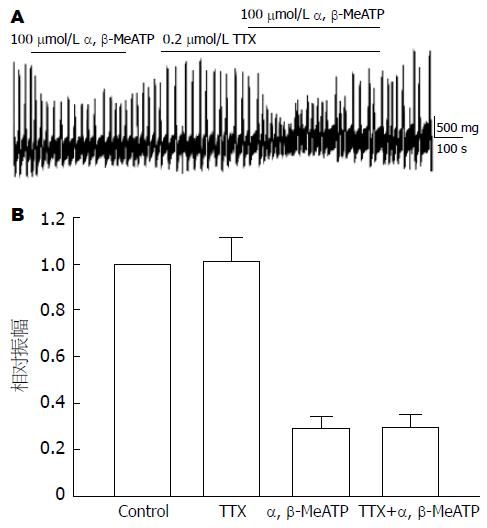
结果: 嘌呤能P2X受体激动剂α, β-MeATP明显抑制豚鼠胃窦环行肌自发性收缩, 并有明显的量效倚赖关系; 5, 10, 20, 40, 100 μmol/L α, β-MeATP作用下, 环行肌收缩幅度分别由对照组的100%下降到90%±2%, 81%±4%, 68%±4%, 59%±7%和29%±4%(P<0.05). 用神经阻断剂Tetrodotoxin (TTX)预处理后, α, β-MeATP对胃窦环行肌自发性收缩的抑制作用仍不受影响; 在传统全细胞膜片钳电流钳模式下, 500 μmol/L α, β-MeATP不影响细胞膜电位, 也对两种外向钾电流, 即延迟整流型钾电流和钙激活钾电流没有影响; 不同浓度的α, β-MeATP对电压依赖性钙电流没有影响.
结论: P2X受体激动剂抑制豚鼠胃窦环行肌自发性收缩, 其作用机制不依赖内在神经, 也不依赖细胞膜离子通道以及膜电位改变.
引文著录: 黄旭, 张扬, 高玲, 赵鹏, 韩燕飞, 许文燮. P2X受体对豚鼠胃窦环行肌自发性收缩运动的影响. 世界华人消化杂志 2007; 15(11): 1185-1190
Revised: December 10, 2006
Accepted: December 18, 2006
Published online: April 18, 2007
AIM: To investigate the effect of alpha, beta-methylene ATP (α, β-MeATP) on gastric smooth muscle motility and its ionic channel mechanism in guinea pigs.
METHODS: EWG/B guinea pig was used in this study. Gastric antral smooth muscle strips (10 × 1.5 mm) were prepared and then fixed in the organ bath system (37 ℃) which were perfused with sodium bicarbonate buffer solution and aerated (950 mL/L O2, 50 mL/L CO2). The spontaneous contraction of gastric antral circular muscle was recorded by SMUP-E bio-electric signal-processing system. The single gastric myocyte was dispersed with type Ⅱ collagenase, and the ionic current and membrane potential were recorded using whole-cell patch clamp technique in freshly dispersed smooth muscle cells, including calcium-activated potassium current, delayed rectifier potassium current, and voltage-dependent calcium current.
RESULTS: α, β-MeATP, a P2X receptor agonist, significantly inhibited the spontaneous contraction of gastric antral circular muscle in a dose-dependent manner, and the contraction extent were decreased from 100% to 90% ± 2%, 81% ± 4%, 68% ± 4%, 59% ± 7% and 29% ± 4% when α, β-MeATP was used at the concentrations of 5, 10, 20, 40 and 100 μmol/L (P < 0.05). Tetrodotoxin, a blocker of neural transduction, did not affect α, β-MeATP-induced inhibition of the spontaneous contraction. Under conventional whole-cell patch clamp configuration, 500 μmol/L α, β-MeATP did not change membrane potential and affect either delayed rectifier or calcium-activated potassium currents. 500 μmol/L and 1 mmol/L α, β-MeATP did not influence voltage-dependent calcium currents either.
CONCLUSION: α, β-MeATP, a P2X receptor agonist, induces relaxation of gastric antral circular muscle and this effect depend on neither the enteric nerve nor hyperpolarizing membrane potential as well as changing ionic channel activity in guinea pig.
- Citation: Huang X, Zhang Y, Gao L, Zhao P, Han YF, Xu WX. Effect of P2X receptor on the spontaneous contraction of gastric antral circular muscle in guinea pigs. Shijie Huaren Xiaohua Zazhi 2007; 15(11): 1185-1190
- URL: https://www.wjgnet.com/1009-3079/full/v15/i11/1185.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i11.1185
非肾上腺能非胆碱能(non-adrenergic non-cholinergic, NANC)神经广泛分布在胃肠道, 他们在胃肠道平滑肌运动的调节中起着重要作用[1]. 1970年, Burnstock et al[2]首次提出ATP为非肾上腺能非胆碱能(NANC)神经递质, 自此, 许多证据支持这一假设[3-4]. 用阿的平染色技术[5]已经在很多物种小肠肌间神经丛几种神经元中定位了ATP, 并且已经证实了神经刺激引起肌间神经丛释放ATP[6]. 在体内, ATP主要通过激活G蛋白偶联的P2Y受体及配体门控的P2X受体起作用[7-9]. 因为P2X受体为配体门控的非选择性阳离子通道[10-13], 而这种通道的激活通常会导致内向电流和去极化[13-15], 所以, P2X通常介导兴奋性反应. 但是, 在胃肠道, 不同物种, 不同部位的P2X受体, 其作用不同. 在小鼠胃及豚鼠回肠平滑肌[16-17], P2X嘌呤受体激动剂α, β-MeATP通过位于突触前的P2X受体介导肌肉收缩, 而在小鼠和犬类结肠平滑肌[18-19], 嘌呤激动剂直接激活位于平滑肌上的P2X受体, 使平滑肌收缩. 但是, 在大鼠胃平滑肌[20]、大鼠回肠[21]P2X受体介导平滑肌舒张. 可见, 在胃肠道, P2X受体的作用比较复杂并且P2X受体介导平滑肌舒张的机制还不清楚. 为此, 我们主要观察了P2X受体激动剂α, β-MeATP对豚鼠胃窦环行肌自发性收缩的影响并其离子通道机制进行初步探讨.
EWG/B豚鼠, 雌雄不拘, 体质量250 g±50 g, 由上海中国科学院实验动物中心提供.
1.2.1 离体胃平滑肌条的制备及自发性收缩的观察: 将豚鼠击头致昏, 颈静脉放血后, 平铺于实验台上, 沿腹中线开腹取出胃窦部, 放入PSS缓冲液中清洗后, 移入氧饱和的PSS缓冲液中, 去除黏膜层, 露出环行肌层, 沿环行肌走向剪取1.5 mm宽, 10 mm长的肌条, 置于含有氧饱和重碳酸盐缓冲台氏液的垂直灌流槽内, 肌条一端固定于玻璃小钩上, 另一端与和SMUP-E生物信号处理系统连接的张力换能器相连. 灌流槽内的液体通过恒温装置(WC/09-05)使温度保持在(37.0±0.5) ℃. 每次实验时, 肌条先在上述情况下孵育约1 h左右, 当出现稳定的自发性收缩后开始实验. 收缩活动用SMUP-E生物信号处理系统记录及分析.
1.2.2 单细胞制备及电生理实验: 仍然将豚鼠击头致昏, 颈静脉放血后取胃窦部放入氧饱和无钙PSS缓冲液中, 同上述方法分离得到1 mm×4 mm左右的环行肌条. 将其放入K-B液中保存约15 min, 然后在由5 mg Ⅱ型胶原酶, 2 mg胰蛋白酶抑制剂, 1.4 mg Na+-ATP及12 mg牛血清白蛋白溶于4 mL无钙PSS缓冲液中制成的消化液中, 于36-37 ℃水浴箱中消化25-35 min后取出, 用无钙PSS溶液冲洗后, 移入K-B液中, 用管口圆滑的滴管反复吹打, 制成细胞悬浮液后放入4 ℃冰箱保存. 实验时, 取一滴细胞悬浮液(约0.1 mL), 平铺于倒置显微镜(Ⅸ-70 Olympus, Japan)镜台上的灌流槽底部, 待10-15 min细胞贴壁后, 用PSS溶液灌流(2-3 mL/min), 然后用电阻为2-5 MΩ的玻璃电极进行5-10 GΩ的千兆封接. 膜电位根据所记录的电流不同钳制在所需水平, 全细胞电流是通过膜片钳放大器EPC-10型膜片钳放大器记录, 用IGOR Pro软件(version5.0, USA)分析处理.
统计学处理 所有统计数据用均数±标准误来表示. 实验结果采用同体对照的t检验, 具有显著性差异的标准为P<0.05.
在豚鼠离体胃窦环行肌平滑肌上观察了嘌呤能P2X激动剂α, β-MeATP对平滑肌自发性收缩的影响. 在肌条出现稳定的自发性收缩后, 分别给予5, 10, 20, 40, 100 μmol/L α, β-MeATP均可抑制肌条收缩幅度(图1A), 其收缩幅度分别由对照组的100%下降到90%±2%, 81%±4%, 68%±4%, 59%±7%和29%±4%(图1B, n = 6, P<0.05)具有明显的量效关系.
在用0.2 μmol/L TTX预处理后再给予100 μmol/L α, β-MeATP, 仍然可以抑制胃窦平滑肌自发性收缩(图2A), 在TTX预处理后α, β-MeATP可以使胃窦平滑肌收缩幅度下降到29%±5%, 与单独给予α, β-MeATP的降低收缩幅度29%±4%相比, 没有显著性差异(图2B, n = 5, P>0.05).
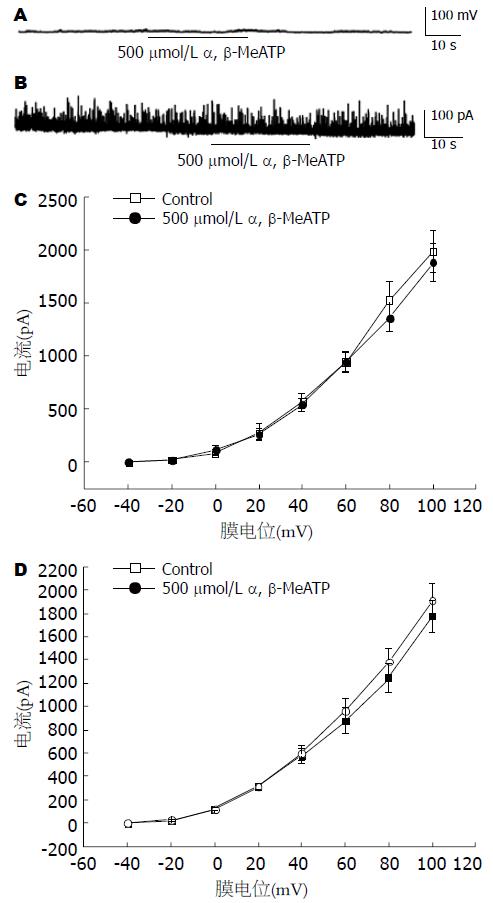
采用全细胞膜片钳技术的电流钳模式下, 用含EGTA 0.1 mmol/L电极内液的电极记录膜电位, 并将膜电位调到-60 mV使其接近平滑肌静息电位. 当给予500 mmol/L α, β-MeATP时, 给药前后膜电位水平没有明显变化(图3A, n = 6).
2.5.1 α, β-MeATP对钙激活钾离子电流的影响: 在全细胞电压钳模式下, 使用电极内液含EGTA 0.1 mmol/L的电极, 将膜电位钳制在-20 mV, 可以记录到胞内游离钙激活的自发瞬间外向钾电流(spontaneous transient outward currents, STOCs)[22]. 如图3B所示, 在给予500 μmol/L α, β-MeATP前后, STOC的频率和振幅几乎没有发生改变(n = 6).
为了进一步观察α, β-MeATP对钙敏感钾电流(calcium-activated potassium current, IKCa)的影响, 把膜电位钳制在-60 mV, 从-40 mV开始, 用时间间隔10 s、阶跃增幅20 mV持续400 ms的阶跃电压刺激依次去极化到+100 mV, 得到了胃窦平滑肌细胞IKCa的电压-电流曲线. 如图3C所示, 在每个膜电位水平α, β-MeATP不影响IKCa幅度, 当去极化到+60 mV时, 给药前后电流大小分别为944.9 pA±88.3 pA和946.2 pA±101.3 pA, 两者之间没有显著性差异(n = 6, P>0.05).
2.5.2 α, β-MeATP对电压依赖性钾电流的影响: 当电极内液中含有10 mmol/L EGTA使细胞内游离钙充分被螯合的情况下, 将膜电位钳制在-60 mV, 采用同记录IKCa相同的刺激模式可以记录到延迟整流性钾电流(delayed rectifying potassium currents, IKV). I-V曲线如图3D所示, 在各膜电位水平500 μmol/L α, β-MeATP对IKV没有明显的影响, 当去极化到+60 mV的电流大小为876.2 pA±108.5 pA, 与对照组962.5 pA±109.6 pA比较, 没有显著性差异(n = 6, P>0.05).
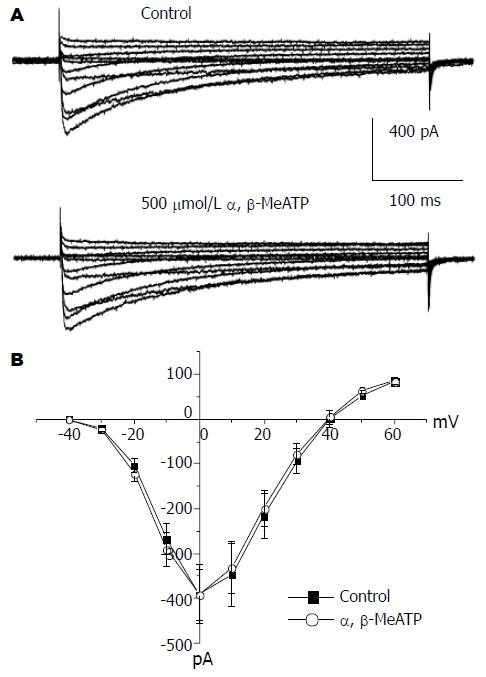
将膜电位钳制在-80 mV, 从-40 mV开始, 用时间间隔10 s、阶跃增幅10 mV持续400 ms的阶跃电压刺激依次去极化到+60 mV, 记录了L-型钙电流(图4A). 在给予500 μmol/L α, β-MeATP前后, 根据所记录的电流大小, 制成I-V曲线如图4B所示. 结果表明, 在每个电压水平α, β-MeATP不改变电流大小, 当去极化到0 mV时, 对照组和给药组电流大小分别为-390.6 pA±64.7 pA和-391.4 pA±57.7 pA, 两者之间没有显著性差异(n = 6, P>0.05).
嘌呤能P2受体根据其对受体激动剂反应的强弱顺序可分为P2X及P2Y受体, 其中, 2-MeSATP是P2Y受体的强激动剂, 而α, β-MeATP是P2X受体的强激动剂[23-25]. 在不同物种, 胃肠道不同部位, P2X受体介导的反应不同, 例如, 在小鼠胃及豚鼠回肠平滑肌[16-17], 嘌呤能激动剂通过位于突触前的P2X受体介导平滑肌收缩, 而在小鼠和犬类结肠平滑肌[18-19], 则是通过直接激活位于平滑肌上的P2X受体介导收缩. 然而, 本实验结果显示, 在豚鼠胃平滑肌P2X受体激动剂α, β-MeATP起舒张平滑肌的作用.
在本实验中, P2X受体激动剂α, β-MeATP对豚鼠胃窦环行肌具有舒张作用, 而这种作用不被神经阻断剂TTX所阻断. 这一结果说明, 在豚鼠的胃平滑肌P2X受体介导平滑肌的舒张反应, 而这种舒张反应不是通过肠神经实现的. 在大鼠胃平滑肌, P2X受体介导平滑肌舒张, 并且, 这种作用可能通过激活小电导Ca2+敏感K+通道实现[20]. 既然在平滑肌的运动中细胞膜电位的改变直接控制平滑肌的舒缩状态, 在本实验中, 为了进一步探讨P2X受体激动剂对豚鼠胃窦环行肌的舒张作用, 在新鲜分离的单细胞上观察了α, β-MeATP对平滑肌细胞膜电位的影响以及主要影响细胞膜电位的两种外向钾电流的影响. 实验结果表明, α, β-MeATP不仅低或高浓度都不影响豚鼠胃平滑肌膜电位水平也不影响钙敏感钾电流和延迟整流性钾电流. 我们也在组织水平观察到高浓度的非特异性钾离子通道阻断剂四乙基胺不能阻断α, β-MeATP的舒张作用(结果没有显示). 这些结果说明, α, β-MeATP对豚鼠胃平滑肌的舒张作用并不是通过增加外向钾电流使膜电位超极化实现的. 在平滑肌收缩过程中起重要作用的另一个可以考虑的因素是细胞内游离钙水平, 而影响细胞内游离钙浓度变化的重要因素是电压依赖性L-型钙通道. 因此, 在本实验中观察了α, β-MeATP对L-型钙电流的影响, 结果表明, α, β-MeATP并不改变钙电流. 这一结果说明, α, β-MeATP对胃平滑肌的舒张作用并不是通过抑制L-型钙电流来实现.
平滑肌收缩是由细胞内游离钙浓度及胞内收缩装置对钙离子的敏感度两方面来调节的[26]. 在平滑肌收缩过程中细胞内的游离钙首先与钙调蛋白结合, 激活肌球蛋白轻链激酶, 使肌球蛋白轻链磷酸化, ATP酶活性增加, 横桥和肌动蛋白结合, 最终导致肌丝滑行即平滑肌收缩. 既然α, β-MeATP对胃平滑肌的舒张作用并不是通过改变细胞膜离子通道活性最终引起膜电位超极化来实现, 就可以推测α, β-MeATP可能通过P2X受体降低钙离子对钙调蛋白的敏感性即降低其亲和力或抑制肌球蛋白磷酸化过程有关. 总之, α, β-MeATP对胃平滑肌的舒张作用的详细机制还不清楚, 有待于进一步研究.
功能性消化不良是在临床常见的征侯群, 常表现为胃排空障碍[27-28], 但其发病机制还不清楚. 既然是功能性疾病, 胃肠道内分泌激素和局部体液因素以及自主神经和肠神经功能的紊乱肯定与之有关. 嘌呤能神经在胃肠功能调节中即有兴奋作用也有抑制性作用, 而且在不同的动物和胃肠道不同部位的作用有着明显的差异. 因此, 阐明嘌呤能神经递质及其受体在胃肠功能调节中的作用及其机制具有消化生理学理论意义也有潜在临床意义.
ATP是非肾上腺能非胆碱能神经递质之一, 在胃肠道中主要通过P2X及P2Y受体在平滑肌运动中起重要作用. 但是, 很多研究表明, 不同物种, 在胃肠道不同部位, ATP所起的作用差异非常大. 本文主要研究了P2X受体激动剂α, β-MeATP对豚鼠胃窦环行肌运动的影响及其离子通道机制.
胃肠动力障碍性疾病在临床上非常常见, 其原因还不甚明了, 而嘌呤递质在胃肠道也有广泛的分布, 且对胃肠道平滑肌的运动亦有影响. 因此, 了解和掌握嘌呤递质在胃肠运动中的作用规律, 对研究胃肠动力学以及临床防治胃动力障碍性疾病是一项重要的课题之一.
嘌呤能受体在胃肠平滑肌功能调节方面, 在不同动物、不同部位平滑肌差异很大. 本文研究证实, 豚鼠胃窦P2X受体激动剂抑制自发性收缩, 其机制不依赖内在神经, 也不依赖细胞膜离子通道以及膜电位改变.
嘌呤能P2X受体一般认为是促离子性受体, 但本研究结果表明, P2X受体并不影响豚鼠胃窦环行肌细胞膜电位, 说明P2X受体的舒张作用不依赖离子通道. 这对今后研究P2X受体作用机制有一定的理论意义.
本文研究了P2X受体对豚鼠胃窦环行肌自发性收缩运动的影响, 方法可信, 结果准确, 但讨论中推论的内容似乎不够严谨, 总体水平较高.
编辑: 张焕兰 电编:张敏
| 1. | Bennett MR. Non-adrenergic non-cholinergic (NANC) transmission to smooth muscle: 35 years on. Prog Neurobiol. 1997;52:159-195. [PubMed] [DOI] |
| 2. | Burnstock G, Campbell G, Satchell D, Smythe A. Evidence that adenosine triphosphate or a related nucleotide is the transmitter substance released by non-adrenergic inhibitory nerves in the gut. Br J Pharmacol. 1970;40:668-688. [PubMed] [DOI] |
| 3. | Xue L, Farrugia G, Sarr MG, Szurszewski JH. ATP is a mediator of the fast inhibitory junction potential in human jejunal circular smooth muscle. Am J Physiol. 1999;276:G1373-G1379. [PubMed] |
| 4. | Crist JR, He XD, Goyal RK. Both ATP and the peptide VIP are inhibitory neurotransmitters in guinea-pig ileum circular muscle. J Physiol. 1992;447:119-131. [PubMed] [DOI] |
| 5. | Crowe R, Burnstock G. Comparative studies of quinacrine-positive neurones in the myenteric plexus of stomach and intestine of guinea-pig, rabbit and rat. Cell Tissue Res. 1981;221:93-107. [PubMed] [DOI] |
| 6. | Su C, Bevan JA, Burnstock G. [3H]adenosine triphosphate: release during stimulation of enteric nerves. Science. 1971;173:336-338. [PubMed] [DOI] |
| 7. | Ralevic V, Burnstock G. Receptors for purines and pyrimidines. Pharmacol Rev. 1998;50:413-492. [PubMed] |
| 8. | North RA. Molecular physiology of P2X receptors. Physiol Rev. 2002;82:1013-1067. [PubMed] [DOI] |
| 9. | Barnard EA, Burnstock G, Webb TE. G protein-coupled receptors for ATP and other nucleotides: a new receptor family. Trends Pharmacol Sci. 1994;15:67-70. [PubMed] [DOI] |
| 10. | Benham CD, Tsien RW. A novel receptor-operated Ca2+-permeable channel activated by ATP in smooth muscle. Nature. 1987;328:275-278. [PubMed] [DOI] |
| 11. | Friel DD. An ATP-sensitive conductance in single smooth muscle cells from the rat vas deferens. J Physiol. 1988;401:361-380. [PubMed] [DOI] |
| 12. | von Kügelgen I, Starke K. Noradrenaline-ATP co-transmission in the sympathetic nervous system. Trends Pharmacol Sci. 1991;12:319-324. [PubMed] [DOI] |
| 13. | Koh SD, Dick GM, Sanders KM. Small-conductance Ca(2+)-dependent K+ channels activated by ATP in murine colonic smooth muscle. Am J Physiol. 1997;273:C2010-C2021. [PubMed] |
| 14. | Droogmans G, Callewaert G, Declerck I, Casteels R. ATP-induced Ca2+ release and Cl- current in cultured smooth muscle cells from pig aorta. J Physiol. 1991;440:623-634. [PubMed] [DOI] |
| 15. | Molleman A, Nelemans A, Den Hertog A. P2-purinoceptor-mediated membrane currents in DDT1 MF-2 smooth muscle cells. Eur J Pharmacol. 1989;169:167-174. [PubMed] [DOI] |
| 16. | Mulè F, Naccari D, Serio R. Evidence for the presence of P2y and P2x receptors with different functions in mouse stomach. Eur J Pharmacol. 2005;513:135-140. [PubMed] [DOI] |
| 17. | Matsuo K, Katsuragi T, Fujiki S, Sato C, Furukawa T. ATP release and contraction mediated by different P2-receptor subtypes in guinea-pig ileal smooth muscle. Br J Pharmacol. 1997;121:1744-1748. [PubMed] [DOI] |
| 18. | Giaroni C, Knight GE, Ruan HZ, Glass R, Bardini M, Lecchini S, Frigo G, Burnstock G. P2 receptors in the murine gastrointestinal tract. Neuropharmacology. 2002;43:1313-1323. [PubMed] [DOI] |
| 19. | Lee HK, Ro S, Keef KD, Kim YH, Kim HW, Horowitz B, Sanders KM. Differential expression of P2X-purinoceptor subtypes in circular and longitudinal muscle of canine colon. Neurogastroenterol Motil. 2005;17:575-584. [PubMed] [DOI] |
| 20. | Lefebvre RA, de Beurme FA, Sas S. Effect of apamin on the responses to VIP, ATP and NANC neurone stimulation in the rat and cat gastric fundus. J Auton Pharmacol. 1991;11:73-83. [PubMed] [DOI] |
| 21. | Storr M, Franck H, Saur D, Schusdziarra V, Allescher HD. Mechanisms of alpha,beta-methylene atp-induced inhibition in rat ileal smooth muscle: involvement of intracellular Ca2+ stores in purinergic inhibition. Clin Exp Pharmacol Physiol. 2000;27:771-779. [PubMed] [DOI] |
| 22. | Zhuge R, Fogarty KE, Tuft RA, Walsh JV. Spontaneous transient outward currents arise from microdomains where BK channels are exposed to a mean Ca(2+) concentration on the order of 10 microM during a Ca(2+) spark. J Gen Physiol. 2002;120:15-27. [PubMed] [DOI] |
| 23. | Burnstock G, Kennedy C. Is there a basis for distinguishing two types of P2-purinoceptor? Gen Pharmacol. 1985;16:433-440. [PubMed] [DOI] |
| 24. | Webb TE, Simon J, Krishek BJ, Bateson AN, Smart TG, King BF, Burnstock G, Barnard EA. Cloning and functional expression of a brain G-protein-coupled ATP receptor. FEBS Lett. 1993;324:219-225. [PubMed] [DOI] |
| 25. | Jury J, Jager LP, Daniel EE. Unusual potassium channels mediate nonadrenergic noncholinergic nerve-mediated inhibition in opossum esophagus. Can J Physiol Pharmacol. 1985;63:107-112. [PubMed] [DOI] |
| 26. | Karaki H, Ozaki H, Hori M, Mitsui-Saito M, Amano K, Harada K, Miyamoto S, Nakazawa H, Won KJ, Sato K. Calcium movements, distribution, and functions in smooth muscle. Pharmacol Rev. 1997;49:157-230. [PubMed] |