修回日期: 2007-01-10
接受日期: 2007-02-08
在线出版日期: 2007-04-08
目的: 探讨分析中国人散发性结直肠癌微卫星不稳定的变异及其与临床病理生物学特征的关系.
方法: 应用荧光多重PCR方法检测105例散发性结直肠癌初诊患者微卫星状态, 分析MSI结直肠癌潜在的相关临床病理生物学特征.
结果: 105结直肠癌中, MSI检出率24.7%, 其中MSI-H 14例(13.3%), MSI-L 12例(11.4%); 队列中各位点突变率分别是D5S346(5.7%), BAT26(8.6%), BAT25(10.5%), D17S250(8.6%), D2S123(10.5%); MSI结直肠癌的组织分化程度与淋巴结转移情况与MSS结直肠癌有显著的统计学差异(P = 0.047, P = 0.029), 但在患者年龄、肿瘤位置、病理性质无显著临床意义(P>0.05).
结论: MSI结直肠癌具有低分化癌多见, 淋巴结转移少等特点, 淋巴结转移少可能是MSI结直肠癌具有生存优势的原因之一.
引文著录: 杨柏林, 谷云飞, 赖仁胜, 谢玲, 金黑鹰. 散发性结直肠癌微卫星不稳定性及其与临床病理生物学的关系. 世界华人消化杂志 2007; 15(10): 1160-1164
Revised: January 10, 2007
Accepted: February 8, 2007
Published online: April 8, 2007
AIM: To analyze the relationship between microsatellite instability (MSI) and clinicopatho-logical features in sporadic colorectal cancer and its clinical significance.
METHODS: Fluorescence multiplex polymerase chain reaction was used to detect the microsatellite instability with five microsatellite loci in 105 patients with sporadic colorectal cancer. The clinicopathological features characterized by microsatellite instability and microsatellite stability were compared statistically.
RESULTS: We found microsatellite instability in 24.7% of sporadic colorectal cancer patients, including 14 (13.3%) cases with MSI-high, 12 (11.4%) cases with MSI-low, and 79 (75.3%) cases with MS-stable (MSS). The instability of D5S346 was found in 6 cases (5.6%), BAT-26 in 9 (8.6%) cases, BAT-25 in 11 (10.5%) cases, D17S250 in 9 (8.6%) cases, and D2S123 in 11 cases (10.5%). The differentiation and lymph node metastasis status between MSI- and MSS-positive colorectal cancer was statistically different (P = 0.047, P = 0.029), but not the remaining variables (P > 0.05).
CONCLUSION: Low differentiation and metastasis are found in MSI-positive sporadic colorectal cancer, which may be one cause of a favorable survival.
- Citation: Yang BL, Gu YF, Lai RS, Xie L, Jin HY. Microsatellite instability in sporadic colorectal cancer and its relationship with clinicopathological features. Shijie Huaren Xiaohua Zazhi 2007; 15(10): 1160-1164
- URL: https://www.wjgnet.com/1009-3079/full/v15/i10/1160.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i10.1160
全世界每年大约有100万人患结直肠癌并导致52.8万人死亡[1]. 目前认为结直肠癌发生主要有染色体不稳定(chromosomal Instability, CIN)和微卫星不稳定(microsatellite instability, MSI)两条途径. MSI结直肠癌和CIN结直肠癌发生的分子机制不同, 肿瘤的生物学特性、治疗和预后均存在一定差异. MSI检测作为结直肠癌基因诊断和遗传分析已广泛应用. 国内对MSI结直肠癌的研究起步较晚, 主要集中在遗传性非息肉病性结直肠癌(hereditary nonopolyposis colorectal cancer, HNPCC)肿瘤研究, 对于散发性结直肠癌MSI的系统性研究报道较少. 本研究应用多重荧光PCR结合GeneMapper分析软件检测方法研究中国人散发性结直肠癌患者MSI变异情况, 并探讨其临床病理生物学特征.
2004-08/2006-03在南京中医药大学附属医院和南京中医药大学第三附属医院的经病理证实的散发性结直肠癌初诊患者105例. 每例在手术后立即同时取新鲜的肿瘤组织和正常黏膜组织, -80 ℃保存备用. 男66例(62.9%), 女39例(37.1%). 年龄13-94(平均60.5)岁. 参照Ajay推荐的结直肠癌年龄分组[2], 本组结直肠癌患者分为低年组(<50岁)22例(21.0%)、中位年龄组(50-65岁)30例(28.6%)和高年组(>65岁)53例(50.4%). 其中直肠癌67例(63.8%)、结肠癌38例(36.2%). 肿瘤术后病理分型: 腺癌84例(80.0%)、黏液腺癌21例(20.0%); 高分化20例(19.0%)、中分化55例(52.4%)、低分化30例(28.6%). 无淋巴结转移78例(74.2%)、1-3个淋巴结转移19例(18.1%)、>4个淋巴结转移8例(7.7%).
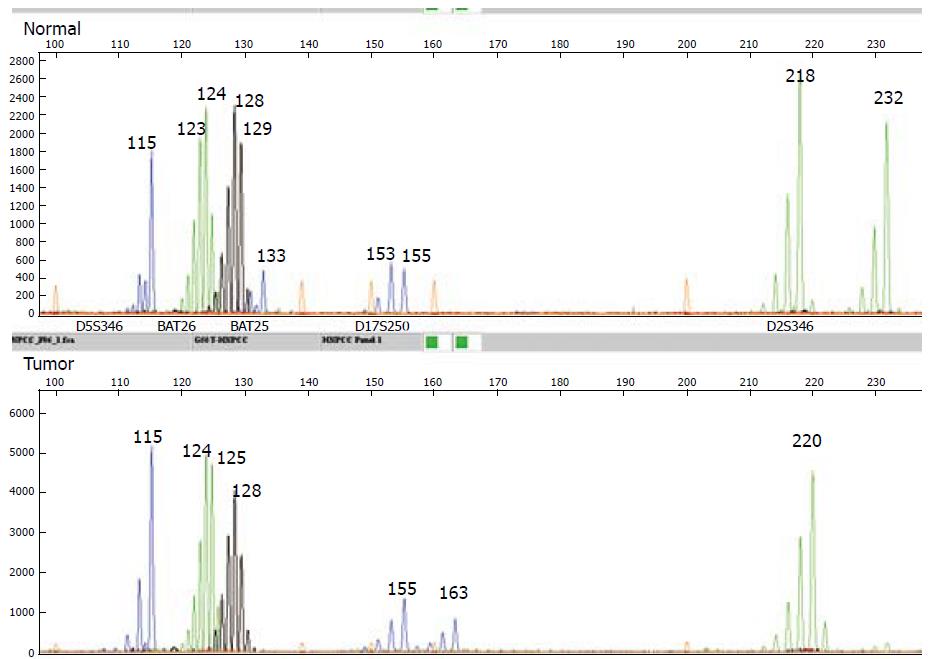
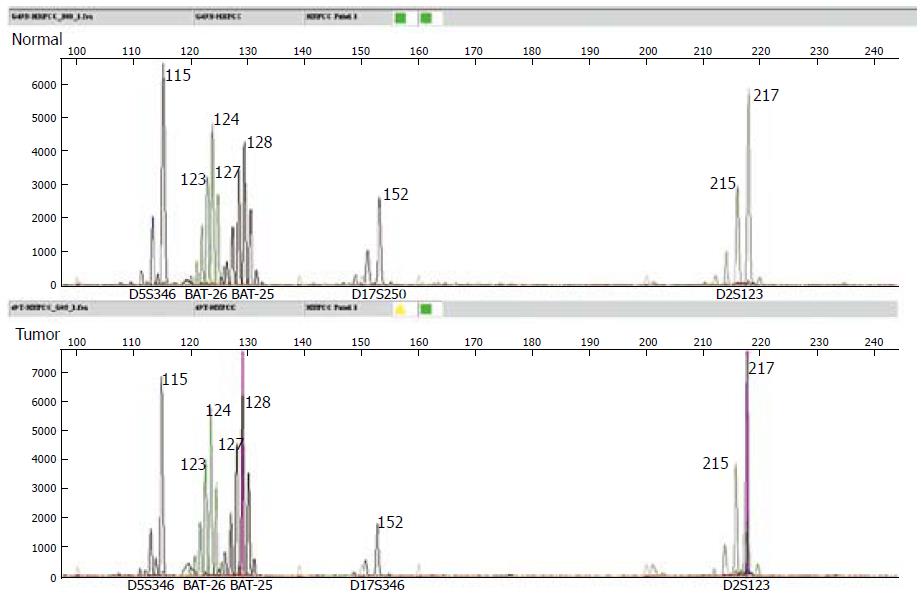
1.2.1 寡核苷酸引物: 采用BAT-26, BAT-25, D2S123, D5S346和D17S250作为检测引物[3], 5对引物来自NCBI基因库, 由美国ABI生物有限公司合成, 上游引物3'端分别标记FAM(蓝色)、VIC(绿色)、NED(黑色), 同色引物长度有别, LIZ内标(橙色); 下游引物3'端带7个bp的不同源尾巴(表1).
| 微卫星位点 | 引物序列 | 长度 | 位置 |
| D2S123(VIC) | Forward: 5'-AAACAGGATGCCTGCCTTTA-3' | 197-227 | 2P16/hMSH2. |
| Reverse: 5'-GGACTTTCCACCTATGGGAC-3' | |||
| D17S250(FAM) | Forward: 5'-GGAAGAATCAAATAGACAAT-3' | 151-169 | 17q11.2-q12/BRCA1 |
| Reverse: 5'-GCTGGCCATATATATATTTAAACC-3' | |||
| D5S346(FAM) | Forward: 5'-ACTCACTCTAGTGATAAATCGGG-3' | 96-122 | 5q21-22/APC |
| Reverse: 5'-AGCAGATAAGACAGTATTACTAGTT-3' | |||
| Bat-25(NED) | Forward: 5'-TCGCCTCCAAGAATGTAAGT-3' | 120 | 4q12/C-kit |
| Reverse: 5'-TCTGCATTTTAACTATGGCTC-3' | |||
| Bat-26(VIC) | Forward: 5'-TGACTACTTTTGACTTCAGCC-3' | 116 | 2P16.3/hMSH2 |
| Reverse: 5'-AACCATTCAACATTTTTAACCC-3' |
1.2.2 荧光多重PCR反应: 以Berg et al[4]介绍的方法扩增上述微卫星序列. 根据组织DNA抽提试剂盒(北京莱博生物实验材料研究所)说明抽提肿瘤组织和黏膜组织基因组DNA. 荧光多重PCR反应体系为20 μL, 5种引物同管扩增, 其中模板DNA 1 μL、混合引物(Primer Mix) 4 μL、ABI Prism True Allele PCR Premix (含AmpliTaq Gold DNA Polymerase, buffer, magnesium chloride and dNTPs) 15 μL. PCR反应程式: 95 ℃预变性15 min, 94 ℃变性1 min, 56 ℃退火1 min, 72 ℃延伸1 min, 72 ℃充分延伸25 min. 共30个循环. 取 1 μL PCR反应产物与0.4 μL LIZ(内标)和9 μL甲酰胺混合, 95 ℃加热变性5 min, 4 ℃ 5 min. 变性后产物经ABI3100测序仪毛细管电泳45 min. Datacollection软件自动进行数据收集和处理, 并生成原始的样品数据文件. GeneMapper分析软件对配对产物数据自动分析.
1.2.3 MSI判断: 肿瘤组织与正常组织相对照, 出现条带的迁移、缺失或电泳图的形状改变判为MSI. 5个微卫星DNA位点中, 2个或2个以上位点不同, 标志为高度微卫星不稳定(microsatellite instability-high, MSI-H); 仅一个位点不同时, 判定为低度微卫星不稳定(microsatellite instability-low, MSI-L); 如果肿瘤组织和正常组织相同则为微卫星稳定(microsatellite stability, MSS)[3](图1, 图2).
统计学处理 以SPSS11.0统计软件进行数据处理. MSI检测状况与潜在的相关临床病理生物学参数之间采用Logistic回归分析统计方法.
105例结直肠癌患者全部应用多重PCR方法扩增出所有的5个微卫星序列. 26例(24.7%)表现出MSI, 其中MSI-H 14例(13.3%), MSI-L 12例(11.4%), MSS 79例(75.3%). 整个队列中各微卫星位点突变率分别是D5S346(5.7%), BAT26(8.6%), BAT25(10.5%), D17S250(8.6%), D2S123(10.5%).
| 分组 | n | MSS | MSI | P值 | |
| MSI-L | MSI-H | ||||
| 年龄(岁) | P = 0.388 | ||||
| <50 | 22 | 15 | 2 | 5 | |
| 50-65 | 41 | 33 | 5 | 3 | |
| >65 | 42 | 31 | 5 | 6 | |
| 位置 | P = 0.106 | ||||
| 直肠 | 67 | 54 | 7 | 6 | |
| 结肠 | 38 | 25 | 5 | 8 | |
| 病理性质 | P = 0.417 | ||||
| 腺癌 | 84 | 65 | 9 | 10 | |
| 黏液腺癌 | 21 | 14 | 3 | 4 | |
| 分化程度 | P = 0.047 | ||||
| 低分化 | 34 | 21 | 6 | 7 | |
| 中分化 | 55 | 45 | 4 | 6 | |
| 高分化 | 16 | 13 | 2 | 1 | |
| 淋巴结(个) | P = 0.029 | ||||
| 0 | 78 | 56 | 11 | 11 | |
| 1-3 | 19 | 16 | 1 | 2 | |
| >4 | 8 | 7 | 0 | 1 | |
105例结直肠癌患者中, MSI检出率在低年组、中位年龄组和高年组分别为31.8%, 26.2%, 19.5%, 三者间无统计学差异(P = 0.388); 结肠癌患者MSI检出率(34.2%)高于直肠癌患者(19.4%), 统计学无差异(P = 0.106); 黏液腺癌组(33.3%) MSI检出率高于腺癌组(22.6%), 统计学无差异(P = 0.417); 低分化组(38.2%)中MSI检出频率明显高于中分化组(18.2%)与高分化组(18.8%), 有显著统计学差异(P = 0.047); MSI结直肠癌中淋巴结转移为15.3%, MSS结直肠癌淋巴结转移为29.15%, 有显著统计学差异(P = 0.029).
错配修复基因(MMR)在DNA复制过程中修复错配的碱基从而使DNA能精确地复制, 保证人类遗传的保守性和稳定性. 错配修复基因功能丧失导致细胞在增殖过程中的错误掺入和缺失不能修复, 表现出广泛的MSI. MSI是错配修复基因的突变表型, 80%以上的HNPCC肿瘤和10%-15%的散发性结直肠癌表现为MSI[5]. MSI结直肠癌的临床病理生物学行为与MSS肿瘤存在明显的区别. MSI结直肠癌具有发病早、近段结肠多见、对放疗和以5-FU为基础的化疗不敏感、但对CPT-11为主的化疗方案敏感的特点[6-8]. 研究表明, 体细胞hMLH1启动子甲基化导致hMLH1转录沉默是散发性结直肠癌发生MSI的主要原因. 散发性MSI结直肠癌中hMLH1突变的发生率低于10%, 而该基因启动子区域的甲基化发生率大于90%, 散发性MSI结直肠癌主要由于hMLH1启动子区甲基化导致的表遗传性疾病[9].
本组对105例结直肠癌患者MSI检测, 26例(24.7%)表现出MSI, 其中MSI-H 14例(13.3%), MSI-L 12例(11.4%), MSS为75.3%, 与Nash et al[10]研究结果基本一致. 研究认为HNPCC中单碱基重复序列(BAT-26, BAT-25)不稳定发生率较高, 散发性MSI结直肠癌中双碱基重复序列不稳定发生率较高, 本组26例发生MSI的患者中BAT-26变异9例(34.6%)、BAT-25变异11例(42.3%)、D2S123变异11例(42.3%)、D5S346变异6例(23.1%)、D17S250变异9例(34.6%), 5个标志之间无显著差异. 部分学者认为BAT-26在HNPCC肿瘤中阳性率为100%, 单纯检测BAT-26可以判断家系成员是否为MSI[11-12], 本组资料显示BAT-26阳性率为34.6%, 明显低于在HNPCC肿瘤中的检出率, 为什么在HNPCC中单碱基重复序列不稳定发生率高, 而在散发性MSI结直肠癌中双碱基重复序列不稳定发生率高, 目前尚无定论.
Benatti et al[13]对1263例散发性结直肠癌MSI检测中发现, MSI结直肠癌具有分化程度低、右半结肠多见、黏液癌多见、生存率较高的特点. 本组研究显示MSI在低年患者、黏液腺癌多见, 但无统计学意义; 低分化结直肠癌中MSI发生率明显高于中、高分化的结直肠癌, 统计学有显著差异. 由于本研究组病例纳入按患者就诊时间形成队列, 样本中右半结肠癌病例过少, 因此, 分析时仅将研究样本分为结肠癌和直肠癌进行比较. 结果显示结肠癌中MSI+检出率明显高于直肠癌. 散发性MSI结直肠癌主要由于hMLH1启动子区甲基化导致的表遗传性疾病, Hawkins et al[14]检测426例散发性大肠癌hMLH1基因CpG岛甲基化状态, 发现CpG岛甲基化与右侧大肠癌、老年患者、黏液性肿瘤、MSI有关, 预后较好. 本组患者中, 低年组MSI发生率为31.8%, 高年组为26.1%, 两者明显高于中位年龄组患者(19.5%), 提示应适当扩大Bestesda标准[15]中年龄检测范围可使一部分老年患者在治疗和预后上获益. Gryfe et al[16]研究认为MSI结直肠癌有明显的生存优势, 淋巴结转移明显低于MSS结直肠癌, 是独立的预后指标. 本组研究结果显示在MSI组中淋巴结转移15.3%, 明显低于MSS组29.1%, 两者之间有显著的统计学意义, 这可能是MSI+肿瘤具有生存优势原因之一, 但尚须进一步扩大样本量来证实. 由于本组患者均为近2年来手术的患者, 因此没有进行生存率和化疗关系的比较.
结直肠癌MSI检测不仅是筛选HNPCC肿瘤的重要指标, 而且可以使10%-15%的MSI性散发性结直肠癌的治疗和预后策略发生改变, 对提高结直肠癌的预防、诊断和治疗水平, 对降低结直肠癌的发病率和死亡率有着重要的意义.
结直肠癌的发生是一个涉及多基因、多途径的过程, 被认为是多个控制生长和分化位点基因突变累积的结果. 目前认为结直肠癌形成的主要途径有两条: 一是染色体不稳定(CIN), 即由癌基因的异常激活、抑癌基因的失活引起的杂活缺失(LOH), 导致腺瘤-癌发生, 与之有关的基因如APC、p53基因、K-ras基因等, 约80%的结直肠癌形成与之有关; 另一是微卫星不稳定(MSl), 由于错配修复基因(MMR)的突变, 引起的DNA错配修复系统功能降低或缺失, 从而引起遗传物质不稳定, 主要表现为微卫星不稳定性, 10%-15%散发性结直肠癌和遗传性非息肉病性结直肠癌与MSI有关.
随着分子遗传学研究的发展, 寻找和利用有效的早期诊断、分期、分型以及预后的分子生物学标志物, 提高结直肠癌的预防、诊断和治疗水平, 对降低结直肠癌的发病率和死亡率有着重要的意义. 不同国家和地区的不同人种的MSI结直肠癌临床特征以及MMR基因种系突变特点的研究成为结直肠癌研究热点之一.
国外研究显示, MSI结直肠癌多位于结肠脾曲近端, 分化程度较低, 黏液腺癌多见, 同时多原发癌和异时多原发癌多见, 与CIN结直肠癌患者相比有较高的生存率. 体外研究表明, MSI-H的结直肠癌细胞株对5-FU有耐药作用, DNA错配修复系统能够识别并结合5-FU与DNA结合而触发肿瘤细胞凋亡. 多个临床研究证实, 与MSS结直肠癌患者相比, MSI结直肠癌患者未能从以5-FU为基础的化疗中获益.
本文重点探讨散发性结直肠癌微卫星不稳定性及其与临床病理生物学的关系. 运用多重荧光PCR结合GENESCAN方法检测了连续队列的结直肠癌患者的MSI状态, 结合临床资料和文献系统分析了中国人散发性结直肠癌MSI的变异及其与临床病理生物学特征的关系.
结直肠癌MSI检测不仅是筛选HNPCC肿瘤的重要指标, 而且可以使10%-15%的MSI性散发性结直肠癌的治疗和预后策略发生改变, 对提高结直肠癌的预防、诊断和治疗水平, 对降低结直肠癌的发病率和死亡率有着重要的意义.
微卫星(microsatellite): 广泛存在于原核生物及真核生物基因组中具有高度多态性的短的串联重复核苷酸序列;
微卫星不稳定(MSI): 是指DNA复制时, 由于复制错误且不能被错配修复酶更正而引起的简单重复序列的改变;
遗传性非息肉病性结直肠癌(HNPCC): 又称Lynch综合征, 由错配修复基因突变导致的常染色体显性遗传性疾病, 约占结直肠癌5%-15%.
本文较客观研究了大肠癌一个较新的生物学标志物(微卫星不稳定性)的病理表达特征以及与临床病理学的关系, 课题设计较合理, 方法学成熟, 数理统计校准确, 结论较可靠, 对临床工作有一定帮助.
编辑: 张焕兰 电编:张敏
| 1. | Parkin DM, Bray F, Ferlay J, Pisani P. Global cancer statistics, 2002. CA Cancer J Clin. 2005;55:74-108. [PubMed] [DOI] |
| 2. | Goel A, Arnold CN, Niedzwiecki D, Chang DK, Ricciardiello L, Carethers JM, Dowell JM, Wasserman L, Compton C, Mayer RJ. Characterization of sporadic colon cancer by patterns of genomic instability. Cancer Res. 2003;63:1608-1614. [PubMed] |
| 3. | Boland CR, Thibodeau SN, Hamilton SR, Sidransky D, Eshleman JR, Burt RW, Meltzer SJ, Rodriguez-Bigas MA, Fodde R, Ranzani GN. A National Cancer Institute Workshop on Microsatellite Instability for cancer detection and familial predisposition: development of international criteria for the determination of microsatellite instability in colorectal cancer. Cancer Res. 1998;58:5248-5257. [PubMed] |
| 4. | Berg KD, Glaser CL, Thompson RE, Hamilton SR, Griffin CA, Eshleman JR. Detection of microsatellite instability by fluorescence multiplex polymerase chain reaction. J Mol Diagn. 2000;2:20-28. [PubMed] [DOI] |
| 6. | Ribic CM, Sargent DJ, Moore MJ, Thibodeau SN, French AJ, Goldberg RM, Hamilton SR, Laurent-Puig P, Gryfe R, Shepherd LE. Tumor microsatellite-instability status as a predictor of benefit from fluorouracil-based adjuvant chemotherapy for colon cancer. N Engl J Med. 2003;349:247-257. [PubMed] [DOI] |
| 7. | Carethers JM, Smith EJ, Behling CA, Nguyen L, Tajima A, Doctolero RT, Cabrera BL, Goel A, Arnold CA, Miyai K. Use of 5-fluorouracil and survival in patients with microsatellite-unstable colorectal cancer. Gastroenterology. 2004;126:394-401. [PubMed] [DOI] |
| 8. | Fallik D, Borrini F, Boige V, Viguier J, Jacob S, Miquel C, Sabourin JC, Ducreux M, Praz F. Microsatellite instability is a predictive factor of the tumor response to irinotecan in patients with advanced colorectal cancer. Cancer Res. 2003;63:5738-5744. [PubMed] |
| 10. | Nash GM, Gimbel M, Shia J, Culliford AT, Nathanson DR, Ndubuisi M, Yamaguchi Y, Zeng ZS, Barany F, Paty PB. Automated, multiplex assay for high-frequency microsatellite instability in colorectal cancer. J Clin Oncol. 2003;21:3105-3112. [PubMed] [DOI] |
| 11. | Loukola A, Eklin K, Laiho P, Salovaara R, Kristo P, Järvinen H, Mecklin JP, Launonen V, Aaltonen LA. Microsatellite marker analysis in screening for hereditary nonpolyposis colorectal cancer (HNPCC). Cancer Res. 2001;61:4545-4549. [PubMed] |
| 12. | 金 黑鹰, 刘 飞, 孟 荣贵, 丁 义江, 徐 济明, 阎 于悌, 喻 德洪, 崔 龙. 微卫星标志BAT-26、BAT-25在遗传性非息肉病性结直肠癌中的变异特征及临床意义. 中华实验外科杂志. 2003;20:879-880. |
| 13. | Benatti P, Gafà R, Barana D, Marino M, Scarselli A, Pedroni M, Maestri I, Guerzoni L, Roncucci L, Menigatti M. Microsatellite instability and colorectal cancer prognosis. Clin Cancer Res. 2005;11:8332-8340. [PubMed] [DOI] |
| 14. | Hawkins N, Norrie M, Cheong K, Mokany E, Ku SL, Meagher A, O'Connor T, Ward R. CpG island methylation in sporadic colorectal cancers and its relationship to microsatellite instability. Gastroenterology. 2002;122:1376-1387. [PubMed] [DOI] |
| 15. | Umar A, Boland CR, Terdiman JP, Syngal S, de la Chapelle A, Rüschoff J, Fishel R, Lindor NM, Burgart LJ, Hamelin R. Revised Bethesda Guidelines for hereditary nonpolyposis colorectal cancer (Lynch syndrome) and microsatellite instability. J Natl Cancer Inst. 2004;96:261-268. [PubMed] [DOI] |
| 16. | Gryfe R, Kim H, Hsieh ET, Aronson MD, Holowaty EJ, Bull SB, Redston M, Gallinger S. Tumor microsatellite instability and clinical outcome in young patients with colorectal cancer. N Engl J Med. 2000;342:69-77. [PubMed] [DOI] |