修回日期: 2007-01-25
接受日期: 2007-01-31
在线出版日期: 2007-04-08
目的: 建立稳定有效的小鼠D-氨基半乳糖(D-GalN)和内毒素(LPS)致暴发性肝衰竭(FHF)模型.
方法: 采用析因实验法, 选择两个影响模型成功率的因素: D-GalN和LPS的攻击剂量. 两者各选取三个水平, 以小鼠24 h病死率为评价指标, 观察实验鼠的血清肝功能和肝组织病理学改变.
结果: 优选出两种较理想的给药方案: D-GalN 600 mg/kg联合LPS 0.5 mg/kg和D-GalN 800 mg/kg联合LPS 0.04 mg/kg腹腔注射. 不同剂量的D-GalN和LPS对模型的病死率均有影响(F = 36.878, P = 0.000; F = 32.386, P = 0.000), 均存在量效关系; 而且D-GalN和LPS间存在交互作用(F = 5.226, P = 0.005), 两种试剂合用可以明显提高模型的病死率.
结论: 建立了D-GalN和LPS致小鼠FHF的规范化模型.
引文著录: 张磐, 范学工, 章保新, 钟白云. 析因实验法建立规范化小鼠暴发性肝衰竭模型. 世界华人消化杂志 2007; 15(10): 1141-1145
Revised: January 25, 2007
Accepted: January 31, 2007
Published online: April 8, 2007
AIM: To establish a stable and effective mouse model of fulminant hepatic failure (FHF) induced by D-galactosamine (D-GalN) and lipopolysaccharide (LPS).
METHODS: Two factors, attacking dosages of D-GalN and LP, influencing the success of modeling were chosen by factorial experiment. Three dosages of two factors were injected into the peritoneal cavity of mice and the death rate within 24 h was calculated. Liver function and liver histopathological changes were also detected.
RESULTS: Two administration projects were chosen: 600 mg/kg D-GalN combined with 0.5 mg/kg LPS, or 800 mg/kg D-GalN combined with 0.04 mg/kg LPS. The death rates were affected by D-GalN and LPS in dose-dependent manner (F = 36.878, P = 0.000; F = 32.386, P = 0.000). There are interaction between D-GalN and LPS (F = 5.226, P = 0.005), and the combinatory administration of D-GalN and LPS increased the death rates of mice obviously.
CONCLUSION: The standard model of mouse FHF can be established successfully using factorial experiment.
- Citation: Zhang P, Fan XG, Zhang BX, Zhong BY. Optimization of mouse model of fulminant hepatic failure by factorial experiment. Shijie Huaren Xiaohua Zazhi 2007; 15(10): 1141-1145
- URL: https://www.wjgnet.com/1009-3079/full/v15/i10/1141.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i10.1141
肝衰竭(hepatic failure)是由于广范围的肝细胞死亡或急性严重的肝功能破坏所致的凶险的临床综合征, 是一切肝脏疾病重症化的共同结局. 暴发性肝衰竭(fuminant hepatic failure, FHF)的发生机制及其药物治疗一直是医学界的重要研究课题, 方便、有效、稳定及可重复性高的FHF模型是必要的研究基础. 采用D-氨基半乳糖(D-galactosamine, D-GalN)和内毒素(lipopolysaccharide, LPS)联合给药建立模型是目前学术界十分常用的方法, 但文献报道的建模药物剂量波动范围很大, 例如D-GalN的剂量在200-1000 mg/kg之间均有报道, 不规范的造模条件严重影响了评价标准的一致性, 不利于实验结果的横向比较和药物的科学评价. 鉴于此, 我们采用析因实验法, 选择D-GalN和LPS的攻击剂量为影响因素, 以小鼠24 h死亡率为评价指标, 通过验证实验和肝组织病理检查进一步认证来优化造模条件, 希望建立理想的FHF模型, 并且在规范建模方面做出有意义的探索.
D-GalN由重庆医科大学-生物医学工程教研室提供; 大肠杆菌O111:B4内毒素(lipopolysaccharide from Escherichia Coli Serotype O111:B4, LPS, L3012)由美国Sigma公司生产. -20 ℃低温冰箱(青岛Haier公司), -70 ℃超低温冰箱(So-low enviroment equipment公司, 美国), 台式离心机(Beckman公司, 美国), 超净工作台(苏州安泰空气技术有限公司). 采用BALB/c小鼠(清洁级), ♀, 6-7 wk, 18-22 g, 购自湖南省农业科技大实验动物中心, 在中南大学湘雅医学院实验动物学部清洁级环境中适应1 wk后开始实验, 实验前12 h禁食, 不禁水, 实验后即正常进食进水.
1.2.1 析因实验因素水平的设计: 选择两个影响模型成功率的关键因素: D-GALN和LPS的攻击剂量, 两者均选取三个水平, 设计两因素三水平的析因实验方案. 通过前期的预实验, 初筛出实验药物剂量(表1).
| 水平 | 因素 | |
| D-GalN剂量(mg/kg, ip) | LPS剂量(mg/kg, ip) | |
| 1 | 600 | 0.04 |
| 2 | 700 | 0.30 |
| 3 | 800 | 0.50 |
1.2.2 实验安排: 按因素水平表安排实验, 将实验鼠的24 h死亡率设为评价指标, 以实验鼠的血清丙氨酸氨基转移酶(ALT)水平和肝脏病理改变为验证指标, 通过验证实验进行证实.
1.2.3 动物分组及给药: BALB/c小鼠135只, 清洁级, 18-20 g, 单一雌性, 按析因设计方案随机分为9组, 每组15只, 每一组内再随机分三个平行组(n = 5). D-GalN和LPS均用无菌生理盐水溶解配制成相应浓度后过滤除菌, 所有应用器皿均经灭菌处理, 药物混合直接腹腔注射.
1.2.4 验证实验: 根据析因实验的结果, 选择最佳的剂量组合进行验证实验, 再次观察24 h病死率; 另设模型组和正常组及生理盐水对照组进行平行实验, 注射9 h后从眼球后静脉丛采血检测血清ALT(nkat/L)(送湘雅医院检验科采用全自动生化分析仪检测), 采血后立即处死, 取左叶肝组织用40 g/L甲醛固定后备做病检.
1.2.5 肝组织病理检测: 肝组织常规石蜡包埋, 连续切片, 常规HE染色, 肝损害病理分级参照文献[1,2]. 按肝组织炎症、坏死及出血程度分五级(0-Ⅳ): "0"无坏死; "Ⅰ"肝小叶中央静脉周围有点状坏死, 散在炎细胞浸润及嗜酸小体形成; "Ⅱ"肝细胞坏死呈灶状或片状, 占小叶1/3以内, 炎细胞浸润呈灶状; "Ⅲ"肝细胞坏死呈广泛坏死伴出血, 占小叶1/3-2/3, 炎症浸润呈片状; "Ⅳ"肝细胞坏死占小叶2/3以上伴严重出血, 大量炎细胞浸润.
统计学处理 计量资料以均数和标准差(mean±SD)表示, 所有数据用SPSS11.0软件进行分析处理, 析因实验部分采用单因素方差分析和Student Newman Keuls(SNK)法作多重比较, 血清ALT水平的比较采用t检验.
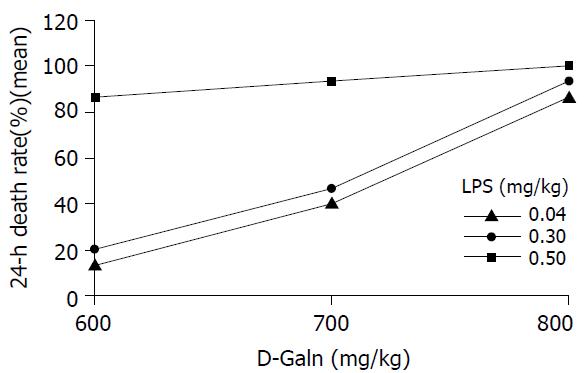
当D-GalN剂量为800 mg/kg时, LPS剂量在0.04-0.5 mg/kg区间内均能达到实验要求, 当D-GalN剂量为600 mg/kg或700 mg/kg时, LPS剂量在0.5 mg/kg时可满足实验要求(表2, 图1).
| LPS剂量(mg/kg) | D-GalN剂量(mg/kg) | ||
| 600 | 700 | 800 | |
| 0.04 | 20(1/5) | 20(1/5) | 100(5/5) |
| 0(0/5) | 40(2/5) | 80(4/5) | |
| 20(1/5) | 60(3/5) | 80(4/5) | |
| 0.30 | 40(2/5) | 60(3/5) | 100(5/5) |
| 20(1/5) | 40(2/5) | 100(5/5) | |
| 0(0/5) | 40(2/5) | 80(4/5) | |
| 0.50 | 80(4/5) | 80(4/5) | 100(5/5) |
| 100(5/5) | 100(5/5) | 100(5/5) | |
| 80(4/5) | 100(5/5) | 100(5/5) | |
不同剂量的D-GalN对模型的病死率有影响(F = 36.878, P = 0.000<0.01), 不同剂量的LPS对模型的病死率有影响(F = 32.386, P = 0.000<0.01), 均存在量效关系; 而且D-GalN和LPS间存在交互作用(F = 5.226, P = 0.005<0.01), 两种试剂合用可以明显提高模型的病死率. 根据进一步实验的要求, 我们选择的攻击强度为24 h病死率在80%以上(含80%), 结合上述析因实验的结果, 根据费效比最小的原则, 选择两种可能的最佳方案进行验证实验, 分别是D-GalN 800 mg/kg+LPS 0.04 mg/kg和D-GalN 600 mg/kg+LPS 0.5 mg/kg(表3).
| 变异来源 | 自由度 | SS | MS | F | P |
| 总变异 | 26 | 31415.265 | |||
| D-GalN主效应 | 2 | 13047.123 | 6523.561 | 36.878 | 0.000 |
| LPS主效应 | 2 | 11457.790 | 5728.895 | 32.386 | 0.000 |
| D-GalN/LPS交互效应 | 4 | 3726.246 | 931.561 | 5.266 | 0.005 |
| 误差 | 18 | 3184.107 | 176.895 |
病死率: 根据析因实验选出的两种最佳方案进行验证实验, 结果如表4所示, 每一实验组的24 h病死率都在80%以上, 结果稳定可靠、可重复性高.
| 序号 | 实验因素 | 24 h病死率(%) | |
| D-GalN剂量(mg/kg) | LPS剂量(mg/kg) | ||
| 1 | 600 | 0.5 | 80(4/5) |
| 2 | 600 | 0.5 | 100(5/5) |
| 3 | 600 | 0.5 | 80(4/5) |
| 4 | 800 | 0.04 | 80(4/5) |
| 5 | 800 | 0.04 | 80(4/5) |
| 6 | 800 | 0.04 | 100(5/5) |
肝功能: 两种方案各随机选择6只小鼠建立FHF模型组, 同时设立生理盐水对照组(n = 6)和正常组(n = 6), 在生理盐水组中小鼠给予同体积的生理盐水腹腔注射, 在给药9 h时从眼球后静脉丛采血检测血清ALT水平(nkat/L). 结果如表5所示, 模型组ALT水平较生理盐水组和正常组升高约100倍, 有显著性差别(P<0.01), 生理盐水组ALT水平较正常组也有升高, 但远低于模型组水平, 可能与损伤和应激有关.
肝组织病理改变: 给药9 h, 模型组大部分小鼠死亡或垂死, 肉眼观察肝脏表面呈酱紫色或红白相间的大片花斑样改变, 肝组织HE染色普通光镜分析: 正常组和生理盐水对照组小鼠肝组织呈正常肝细胞形态, 小叶结构完整清晰, 无炎性细胞浸润. FHF模型组所有切片失去正常肝小叶结构, 可见中、重度炎性细胞浸润, 存在大量点状坏死、小灶性坏死; 有83.3%切片病理分级在"Ⅲ"- "Ⅳ"级, 肝细胞多见片状坏死及桥接坏死, 坏死区内大量的红细胞充填并大量炎性细胞浸润, 凋亡小体多见, 存活肝细胞气球样变或嗜酸性变、萎缩、形成嗜酸性小体, 血窦反应活跃及有小胆管增生并淤胆等FHF的病理改变.
肝脏结构功能复杂, 易受多种病原体、毒物及免疫病理累及, 最终导致肝衰竭. 在中国, 肝衰竭最常见的病因是HBV或其他肝炎病毒引起的肝炎及其相关慢性肝病, 临床上大多表现为FHF经过, 病程凶险病死率极高. FHF模型是实验和临床假说的基础, 他的建立为探知FHF的病因、病理生理、药物疗效判断及疫苗开发提供有用的工具, 而可重复性、可预测性、可比性、低费效比是建模成功的关键.
D-GalN是FHF模型中十分常用的肝毒性药物, 诱发肝损伤存在剂量依赖性. Leube et al[3], Kroger et al[4]认为D-GalN进入体内后可造成两种特异生化损伤: 尿苷三磷酸(UTP)缺乏及尿苷二磷酸(UDP)-氨基半乳糖聚集, 后者可能参与粗面内质网的改变, 影响了蛋白质的合成. LPS是革兰阴性细菌胞壁中的脂多糖, 在细菌代谢过程中或死亡后释放, 由寡糖支链和类脂质A组成, 后者是LPS的主要毒性成分, 他可以与机体细胞生物膜上的磷脂相互作用, 产生多种生物学作用[5]. 韩德五[8]认为LPS血症特别是肠源性LPS血症是肝功能衰竭发生的物质基础. 近年来, 由LPS诱导的以TNF-α为核心的炎症反应, 在重型肝炎患者肝细胞继发性损伤中的作用引起人们的高度重视[6-11], 研究者认为在LPS性急性肝损伤和其他炎性细胞因子的产生中起中心作用[12-14]. LPS造成肝脏毒性的机制主要是: (1)LPS可直接或通过炎性因子的作用破坏血管内皮细胞的完整性, 造成微血管损伤及微血栓的形成, 引起肝内出血和肝细胞的坏死[9]; (2)促进肝星状细胞(HSCs)分泌多种炎性细胞因子, 如TNF-α, IL-1β和IL-6等[10]. 这些炎性因子特别是TNF-α的作用可造成凋亡性肝细胞死亡及炎性细胞的浸润. 浸润的炎细胞可进一步造成肝细胞的损伤, 形成恶性循环. D-GalN联合LPS建立FHF模型较好地模拟了重型肝炎过程, 是得到学术界公认的方法.
根据我们的研究结果可以发现, D-GalN和LPS对模型成功率均有影响, 存在剂量和肝损害的效应关系, 两者合用可以显著增效, 减少单用药物剂量. 本实验确定出D-GalN 800 mg/kg+LPS 0.04 mg/kg和D-GalN 600 mg/kg+LPS 0.5 mg/kg为合适剂量组合. 因该模型是急性损害模型, 血清总胆红素的增高存在滞后, 主要表现为肝损害早期最敏感的指标ALT的显著增高, 其血清ALT水平较正常组和生理盐水对照组升高100倍以上; 83.3%的肝组织病理分级在"Ⅲ"- "Ⅳ"级之间; 病死率在80%以上, 与临床重型肝炎的病死率及肝损害程度十分接近, 我们认为这两种模型都成功地造成FHF. 我们还发现D-GalN的剂量跨度较LPS要小, D-GalN的小幅度剂量改变即引起LPS剂量的大幅变化, 表现出增效剂功能, 与文献报道相一致[7].
值得注意的是D-GalN+LPS所造的FHF动物模型只能近似地模拟暴发性肝炎的肝脏功能、肝脏组织病理改变及部分的发病机制. 所以应用该模型在对药物进行研究的过程中, 应该充分考虑到模型本身、致病因子及药物药性三者的相互关系的复杂性, 选择合理的攻击强度, 慎重确定相应的造模条件, 进行规范化处理, 对得到的任何结果还必须透彻分析, 然后慎重下结论.
本实验采用析因实验设计的方法筛选出两种可能的FHF模型方案, 并通过验证实验从病死率、血清ALT水平和肝组织病理学改变三方面证明造模成功, 吻合一个理想的动物模型的条件[15](与人类疾病特征相似, 病变有一定的发展过程, 形成率高, 死亡率低, 重复性好, 造模简便易行), 建立了D-GalN与LPS联合建模的规范化方法, 以期为FHF的实验研究和相关抗肝衰竭药物的研究建立规范统一的方法做初步探索.
暴发性肝衰竭(FHF)的研究是医学界的热点, 用D-氨基半乳糖(D-GalN)和内毒素(LPS)建模常用, 但存在剂量波动大, 造模条件不规范等问题, 不利于实验结果的横向比较和药物的科学评价, 建立规范化模型显得十分重要. 根据研究目的不同将肝损伤模型分为: 药物中毒性肝损害动物模型、外科手术型肝损害动物模型、免疫性肝损害动物模型等等, 值得注意的是, 近年来动物实验受到公众和动物保护组织的谴责越来越多, 国际上对动物实验的管理亦日趋严格, 因而建立动物模型还应注意符合伦理学和动物权益的标准.
采用析因实验设计的方法筛选FHF模型方案, 并通过验证实验从病死率、血清ALT水平和肝组织病理学改变三方面证明造模成功, 以期为FHF的实验研究和相关抗肝衰竭药物的研究建立规范统一的方法做初步探索.
建立D-氨基半乳糖和LPS小鼠FHF模型, 关键在于科学地选择剂量, 建模药物需在短时间内注完, 以保证药物作用的有效性和均一性.
析因实验(factorialexperiment)设计方法: 是一种全面的多因素实验的方差分析方法, 包括完全析因实验设计(即对全部水平组合进行实验)和部分析因实验设计(即对部分水平组合进行实验)等, 其缺点是当因素个数较多时(三个因素以上), 所需实验单位数、处理组数、实验次数和方差分析的计算量剧增.
本文的主要特点是在实验设计上应用了析因试验法, 进行不同剂量水平D-氨基半乳糖和LPS的组合建立小鼠FHF模型, 文章层次较清晰, 讨论观点比较明确, 语言通顺, 有一定的科学性.
编辑: 张焕兰 电编:张敏
| 2. | Laskin DL, Rodriguez del Valle M, Heck DE, Hwang SM, Ohnishi ST, Durham SK, Goller NL, Laskin JD. Hepatic nitric oxide production following acute endotoxemia in rats is mediated by increased inducible nitric oxide synthase gene expression. Hepatology. 1995;22:223-234. [PubMed] |
| 3. | Leube K, Keppler DO. Combined action of acivicin and D-galactosamine on pyrimidine nucleotide metabolism in hepatoma cells. Biochem Pharmacol. 1983;32:1865-1869. [PubMed] [DOI] |
| 4. | Kröger H, Grätz R, Grahn H. Influence of D-galactosamine upon the NAD-metabolism in rat liver. Int J Biochem. 1983;15:1131-1136. [PubMed] [DOI] |
| 5. | Nolan JP, Camara DS. Intestinal endotoxins as co-factors in liver injury. Immunol Invest. 1989;18:325-337. [PubMed] [DOI] |
| 6. | Nagaki M, Iwai H, Naiki T, Ohnishi H, Muto Y, Moriwaki H. High levels of serum interleukin-10 and tumor necrosis factor-alpha are associated with fatality in fulminant hepatitis. J Infect Dis. 2000;182:1103-1108. [PubMed] [DOI] |
| 7. | Galanos C, Freudenberg MA, Reutter W. Galactosamine-induced sensitization to the lethal effects of endotoxin. Proc Natl Acad Sci U S A. 1979;76:5939-5943. [PubMed] [DOI] |
| 9. | Liu D, Li C, Chen Y, Burnett C, Liu XY, Downs S, Collins RD, Hawiger J. Nuclear import of proinflammatory transcription factors is required for massive liver apoptosis induced by bacterial lipopolysaccharide. J Biol Chem. 2004;279:48434-48442. [PubMed] [DOI] |
| 10. | Thirunavukkarasu C, Uemura T, Wang LF, Watkins SC, Gandhi CR. Normal rat hepatic stellate cells respond to endotoxin in LBP-independent manner to produce inhibitor(s) of DNA synthesis in hepatocytes. J Cell Physiol. 2005;204:654-665. [PubMed] [DOI] |
| 11. | Kobayashi Y, Mori M, Naruto T, Kobayashi N, Sugai T, Imagawa T, Yokota S. Dynamic movement of cytochrome c from mitochondria into cytosol and peripheral circulation in massive hepatic cell injury. Pediatr Int. 2004;46:685-692. [PubMed] [DOI] |
| 12. | Nowak M, Gaines GC, Rosenberg J, Minter R, Bahjat FR, Rectenwald J, MacKay SL, Edwards CK, Moldawer LL. LPS-induced liver injury in D-galactosamine-sensitized mice requires secreted TNF-alpha and the TNF-p55 receptor. Am J Physiol Regul Integr Comp Physiol. 2000;278:R1202-R1209. [PubMed] |
| 13. | Ksontini R, Colagiovanni DB, Josephs MD, Edwards CK, Tannahill CL, Solorzano CC, Norman J, Denham W, Clare-Salzler M, MacKay SL. Disparate roles for TNF-alpha and Fas ligand in concanavalin A-induced hepatitis. J Immunol. 1998;160:4082-4089. [PubMed] |
| 14. | Solorzano CC, Ksontini R, Pruitt JH, Auffenberg T, Tannahill C, Galardy RE, Schultz GP, MacKay SL, Copeland EM, Moldawer LL. A matrix metalloproteinase inhibitor prevents processing of tumor necrosis factor alpha (TNF alpha) and abrogates endotoxin-induced lethality. Shock. 1997;7:427-431. [PubMed] [DOI] |
| 15. | Denlinger LC, Garis KA, Sommer JA, Guadarrama AG, Proctor RA, Bertics PJ. Nuclear translocation of NF-kappaB in lipopolysaccharide-treated macrophages fails to correspond to endotoxicity: evidence suggesting a requirement for a gamma interferon-like signal. Infect Immun. 1998;66:1638-1647. [PubMed] |