修回日期: 2007-01-27
接受日期: 2007-02-03
在线出版日期: 2007-04-08
目的: 研究胃癌组织中多重耐药蛋白(MRP)-1的表达规律.
方法: 用免疫组织化学染色(SP法)检测30例慢性浅表性胃炎(CSG)、30例胃黏膜肠上皮化生(IM)、45例异型增生(Dys)和65例胃癌(GC)组织标本中MRP-1阳性表达情况, RT-PCR技术检测MRP-1 mRNA的表达情况. 均数的比较采用t检验, 样本率的比较采用χ2检验, 两因素的相关分析用直线相关分析.
结果: 在CSG→IM→Dys→GC的过程中, MRP-1的表达呈逐步递增趋势, MRP-1的阳性表达率GC组与Dys, IM组, 均具有显著性差异(43/65 vs 19/45, 6/30, P<0.05), GC组MRP-1以及MRP-1 mRNA阳性表达率均高于相应癌旁组, 差异具有非常显著性(66.2% vs 33.3%, 63.1% vs 28.9%, P<0.01); MRP-1与MRP-1 mRNA表达强度呈正相关(r = 0.598, P<0.05).
结论: 胃癌形成过程中, MRP-1与MRP-1 mRNA表达逐渐上调.
引文著录: 谢家泰, 陈宏斌, 蒋义贵, 徐朝焰. 多重耐药蛋白-1在胃癌中的表达及意义. 世界华人消化杂志 2007; 15(10): 1092-1095
Revised: January 27, 2007
Accepted: February 3, 2007
Published online: April 8, 2007
AIM: To explore the expression of multidrug resistance-associated protein 1 (MRP-1) in gastric carcinoma and its significance.
METHODS: The expression of MRP-1 were detected by immunohistochemistry (SP method) in 30 cases of chronic superficial gastritis (CSG), 30 cases of gastric intestinal metaplasia (IM), 45 cases of dysplasia (Dys) and 65 cases of gastric carcinoma (GC). Reverse transcription-polymerase chain reaction (RT-PCR) was used to examine the expression of MRP-1 mRNA. The comparison between mean values and rates was performed by t test and χ2 test, respectively, and the relativity between two factors was evaluated by linear relative analysis.
RESULTS: The expression of MRP-1 showed a gradually increasing tendency as the disease progressed from CSG, IM, Dys to GC, and there was significant difference between GC and Dys as well as IM (43/65 vs 19/45, 6/30, P < 0.05). The protein and mRNA expression of MRP-1 in gastric carcinoma were significantly higher than those in the corresponding cancer adjacent tissues (66.2% vs 33.3%, P < 0.01; 63.1% vs 28.9%, P < 0.01). Positive correlation was found between MRP-1 protein and mRNA expression (r = 0.598, P < 0.05).
CONCLUSION: MRP-1 expression shows a gradually increasing tendency in gastric carcinogensis both at mRNA and protein level.
- Citation: Xie JT, Chen HB, Jiang YG, Xu CY. Expression and significance of multidrug resistance-associated protein-1 in gastric carcinoma. Shijie Huaren Xiaohua Zazhi 2007; 15(10): 1092-1095
- URL: https://www.wjgnet.com/1009-3079/full/v15/i10/1092.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i10.1092
胃癌是消化系统最常见的恶性肿瘤, 其发病机制仍未完全阐明, 治疗效果不佳. 化疗是目前治疗胃癌的主要辅助手段, 能够降低胃癌患者术后局部复发及远处转移率, 但胃癌对化疗的敏感性不一, 许多患者表现为原发耐药, 化疗耐药是导致治疗失败的重要原因. 目前的研究表明, 多重耐药蛋白(MRP)介导的多重耐药是一重要的耐药机制. 本研究采用免疫组化、RT-PCR方法检测MRP-1, MRP-1 mRNA在慢性浅表性胃炎(CSG)、肠上皮化生(IM)、非典型增生(Dys)、胃癌(GC)中的表达, 以探讨MRP-1与胃癌发生、发展的关系.
收集2000-01/2005-07存档石蜡标本90例、术后新鲜标本80例, 共170例. 其中CSG 30例、IM 30例、Dys 45例, 65例GC为手术切除胃癌标本. GC组低分化25例、高中分化40例. GC按全国胃癌协作组病理组制定的方案及参照WHO肿瘤国际组织学新分类标准分为高、中、低分化型胃癌; CSG组作为对照组. 鼠抗人MRP-1 mAb、广谱超敏S-P试剂盒(Kit-9710)购自福州迈新生物技术有限公司. TRIzolTM试剂、引物购自TaKaRa公司; RT-PCR试剂盒购自北京博大泰克生物基因技术有限公司.
石蜡包埋标本制成4-5 μm的切片, 采用免疫组化(SP法)染色(按说明书), 以PBS代替一抗作阴性对照, 以已知阳性对照片作阳性对照; 新鲜组织取出后, 立即置入液氮中保存, 分别提取各组织总RNA, 用两步法进行RT-PCR(按说明书).
采用PIPS-2020病理图文分析系统, 光学显微镜下每张切片摄取10个高倍视野, 输入分析系统内, 计数阳性细胞个数, 计算阳性表达率. 无阳性染色细胞为阴性(-); 阳性细胞数1%-25%为弱阳性(+); 阳性细胞数26%-50%为中度阳性(++); 阳性细胞数>50%为强阳性(+++); 免疫组化表达强弱(即染色强度)以平均光密度值(A值)表示, 采用上述病理图文分析系统分析. RT-PCR反应后取终产物10 μL经12 g/L琼脂糖凝胶电泳后, 用凝胶分析系统观察、分析实验结果; 测出目的基因及GAPDH的积分吸光度(A)值后计算二者的比值, 以此比值作为各自mRNA的相对表达量.
统计学处理 采用SPSS统计分析软件. 两样本均数的比较采用t检验, 两样本率的比较采用χ2检验, 两因素的相关分析用直线相关分析(Pearson相关系数). 以P<0.05为差异有显著性.
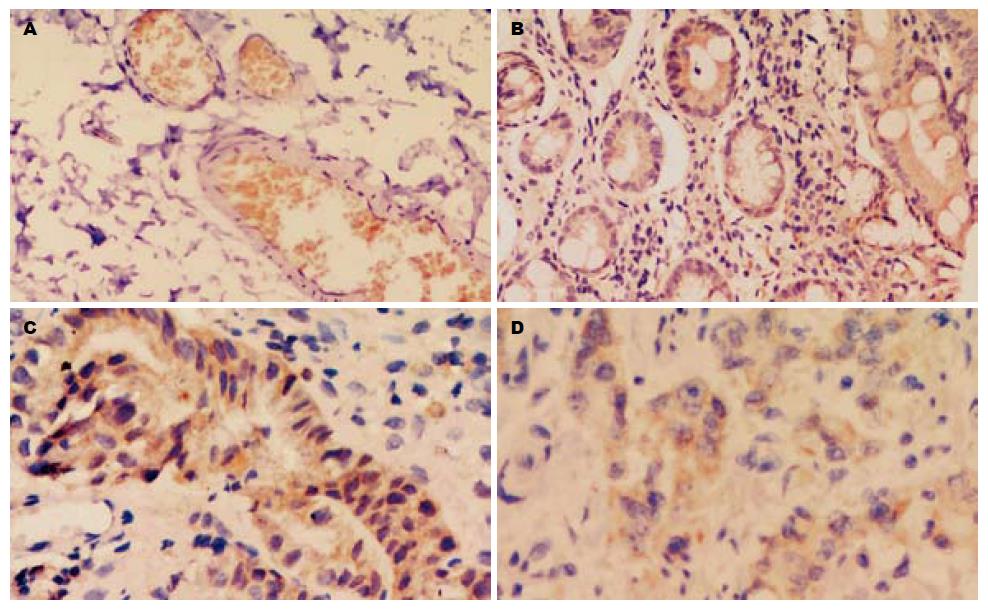
MRP-1阳性信号呈棕黄色, 位于胞质(图1), MRP-1阳性表达在CSG 2例、IM 6例、Dy 19例和GC 43例, GC组与Dys, IM组比较均具有显著性差异(χ2值分别为5.069, 17.507, P<0.05).
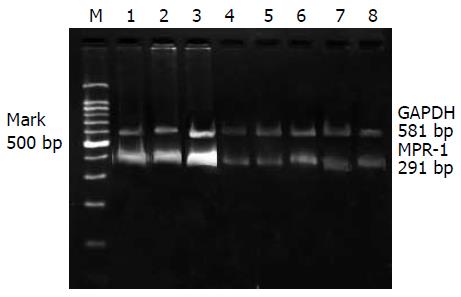
图2的RT-PCR结果显示泳道4-8的MRP-1 mRNA量明显低于泳道1-3(n = 5, P<0.01), 从泳道4-8 MRP-1 mRNA量呈逐渐减少趋势, 而高分化组明显高于低分化组(t = 3.256, P<0.01)(表1).
| 分组 | MRP-1 mRNA | |
| GC组 | 低分化 | 0.59±0.02 |
| 中分化 | 0.66±0.03 | |
| 高分化 | 0.92±0.05 | |
| Dys组 | 高度 | 0.12±0.03 |
| 轻度 | 0.12±0.01 | |
| IM组 | 高度 | 0.12±0.03 |
| 轻度 | 0.08±0.01 | |
| CSG组 | 0.09±0.01 |
胃癌组MRP-1与MRP-1 mRNA阳性表达率分别为66.2%(43/65), 63.1%(41/65), 癌旁组为33.3%(15/45), 28.9%(13/45), 胃癌组均明显高于癌旁组, 差异具有统计学意义(χ2分别为11.492, 12.436, P<0.01), 且MRP-1与MRP-1 mRNA表达具有一致性, 二者呈正相关(r值分别为0.598, 0.513, P<0.05).
有研究表明, MRP广泛分布于正常组织及肿瘤组织中, 其表达与肿瘤耐药有关[1], 在正常组织中普遍呈现低水平表达, 在肿瘤组织中表达水平高低不一. 在经药物选择后的细胞中常能检测到MRP过度表达. 本实验胃癌MRP-1阳性表达率为66.2%, 和Choi et al[2]报道相近, 但较许洪伟et al[3]报道更高, 考虑本组选取的病例标本较多经过化疗所致. 本研究发现在胃癌的演化中MRP-1呈现逐渐增高的趋势, 经免疫组化检测MRP-1蛋白和RT-PCR检测MRP-1 mRNA, 胃癌中含量较CSG及癌前病变明显增高, 具有显著意义(P<0.05). 在正常细胞中, MRP大部分位于细胞质, 主要分布于内质网、高尔基体和胞质运输囊泡等内膜系统上, 少数位于细胞膜, 在肿瘤细胞中MRP主要定位于细胞膜上[4], 和本研究结果符合. 深入研究发现MRP-1具有阻止化疗药物进人细胞内的作用, 其机制与蛋白本身的生物学作用有关[5], MRP可通过改变细胞质及细胞器的pH值, 使药物到达其作用的部位浓度减少, 并逆浓度梯度减少胞内药物浓度而导致耐药. Trompier et al[6]研究发现转染人MRP-1的幼仓鼠肾-21(BHK)细胞株用维拉帕米或其新合成的衍生物NMeOHI2处理后引起细胞死亡, 但亲代BHK细胞及无活性的MRP-1突变体并无细胞死亡, 表明细胞死亡与有功能的MRP-1转运体有关, 维拉帕米与NMeOHI2能迅速耗竭胞内GSH, 通过MRP-1介导GSH外排触发凋亡, 具有凋亡基因的作用.
在肿瘤组织中, MRP-1表达量明显增加, MRP-1的检测有助于临床化疗药物的选择[7]. 这提示MRP-1是引起胃癌原发性耐药的原因之一, 其在癌组织中高表达的原因可能与癌发生部位周围环境所含致癌物的量有关, 后者诱导MRP-1基因表达. 而在正常胃黏膜组织中, MRP-1可作为一种防御机制, 外排进入胃黏膜细胞内的外源异物. 相关研究[8]表明, MRP在胃高、中分化腺癌中的表达均高于低分化腺癌. 本组结果也显示, MRP-1和MRP-1 mRNA在胃高、中分化腺癌中的表达高于胃低分化腺癌, 提示高、中分化腺癌比低分化腺癌更易产生多药耐药, 与临床胃低分化腺癌化疗效果较好相符合.
临床上制订化疗方案前, 可首先测定有无耐药蛋白的表达, 避免采用MRP-1耐药谱中的药物, 治疗过程中, 采取一定措施, 减少或逆转MRP-1的表达.
有关MRP在胃癌中表达的研究是当前研究胃癌化疗耐药机制中的热点, 目前进行此研究的学者较多. 本文提出制定化疗方案前可先进行测定MRP的表达, 来选择化疗药物. 目前认为, 肿瘤的生长依赖于血管供血, 可联合研究多耐药基因和血管生成因子的表达为肿瘤治疗开辟崭新途径.
关于MRP在胃癌中表达的研究比较多, 本研究的内容不是十分新颖, 但作者提到在制定化疗方案时可首先测定MRP的表达来选择化疗药物, 是有意义的临床结论, 本文的研究具有一定的临床意义.
编辑: 张焕兰 电编:张敏
| 1. | Nooter K, Westerman AM, Flens MJ, Zaman GJ, Scheper RJ, van Wingerden KE, Burger H, Oostrum R, Boersma T, Sonneveld P. Expression of the multidrug resistance-associated protein (MRP) gene in human cancers. Clin Cancer Res. 1995;1:1301-1310. [PubMed] |
| 2. | Choi JH, Lim HY, Joo HJ, Kim HS, Yi JW, Kim HC, Cho YK, Kim MW, Lee KB. Expression of multidrug resistance-associated protein1, P-glycoprotein, and thymidylate synthase in gastric cancer patients treated with 5-fluorouracil and doxorubicin-based adjuvant chemotherapy after curative resection. Br J Cancer. 2002;86:1578-1585. [PubMed] [DOI] |
| 3. | 许 洪伟, 丛 衍群, 王 万忠, 姜 军梅, 秦 成坤, 秦 成勇. P-糖蛋白、多药耐药相关蛋白在胃癌的表达与化疗敏感性的相关性研究. 山东大学学报(医学版). 2005;43:594-597. |
| 4. | Kool M, de Haas M, Scheffer GL, Scheper RJ, van Eijk MJ, Juijn JA, Baas F, Borst P. Analysis of expression of cMOAT (MRP2), MRP3, MRP4, and MRP5, homologues of the multidrug resistance-associated protein gene (MRP1), in human cancer cell lines. Cancer Res. 1997;57:3537-3547. [PubMed] |
| 5. | Moriya Y, Nakamura T, Horinouchi M, Sakaeda T, Tamura T, Aoyama N, Shirakawa T, Gotoh A, Fujimoto S, Matsuo M. Effects of polymorphisms of MDR1, MRP1, and MRP2 genes on their mRNA expression levels in duodenal enterocytes of healthy Japanese subjects. Biol Pharm Bull. 2002;25:1356-1359. [PubMed] [DOI] |
| 6. | Trompier D, Chang XB, Barattin R, du Moulinet D'Hardemare A, Di Pietro A, Baubichon-Cortay H. Verapamil and its derivative trigger apoptosis through glutathione extrusion by multidrug resistance protein MRP1. Cancer Res. 2004;64:4950-4956. [PubMed] [DOI] |
| 7. | Liu ZM, Shou NH, Jiang XH. Expression of MDR-1, MRP and LRP genes in gastric carcinoma and their clinical significance. Chin J Cancer Res. 1999;11:128-130. [DOI] |