修回日期: 2006-11-10
接受日期: 2006-11-16
在线出版日期: 2007-04-08
目的: 构建胃癌及其癌前病变组织芯片, 采用免疫组化方法观察研究P73和mP53基因编码蛋白在胃癌中的表达并探讨其临床病理学意义.
方法: 收集2003-2004年辽宁省肿瘤医院和中国医大附属一院104例胃癌及癌前病变组织标本构建两个组织芯片蜡块, 组织样品直径为1 mm. 采用SABC免疫组化方法检测胃癌组织中P73和mP53蛋白的表达, 观察分析其与胃癌病理生物学行为的关系.
结果: P73基因编码蛋白在胃癌、肠上皮化生、不典型增生病变组织中的阳性表达率显著高于远癌正常胃黏膜(90.1%, 44.0%, 80.0% vs 17.9%, P<0.01). Borrman Ⅲ/Ⅳ型胃癌P73蛋白阳性表达率(92.9%/100%)显著高于Borrman Ⅱ型胃癌(57.1%)(P<0.05). 伴转移胃癌组P73蛋白阳性表达率(淋巴结转移组94.4%, 肝转移组100%, 卵巢转移100%)显著高于无转移组(76.2%)(P<0.05). 胃癌组织中P73蛋白表达与mP53蛋白表达密切相关(χ2 = 9.6736, P<0.01).
结论: P73蛋白表达与胃癌恶性病理生物学行为密切相关, 其虽与抑癌基因P53同源, 但与mP53蛋白表达呈正相关, 提示其可能作为P53的一种模拟突变体在胃癌发生、发展中起作用.
引文著录: 林志, 辛彦, 吴东瑛. 利用组织芯片技术研究P73和mP53基因编码蛋白在胃癌中的表达及意义. 世界华人消化杂志 2007; 15(10): 1087-1091
Revised: November 10, 2006
Accepted: November 16, 2006
Published online: April 8, 2007
AIM: To investigate the expression of P73 and mutant P53 (mP53) gene coding proteins and their significances in gastric carcinoma.
METHODS: Two tissue microarray blocks containing 104 cases of gastric cancer and precancerous lesions (1.0 mm each in diameter) was constructed. SABC immunohistochemical stainning was used to detect the expression of P73 and mP53 proteins and the correlation between their roles and the pathological behavior of gastric carcinoma was investigated.
RESULTS: The positive rate of P73 protein was significantly higher in gastric cancer, intestinal metaplasia and atypical hyperplasia than that in the normal tissues (90.1%, 44.0%, 80.0% vs 17.9%, P < 0.01). The expression of P73 protein was also markedly higher in gastric carcinoma of Borrman Ⅲ/Ⅳ types than that of Borrman Ⅱ type (92.9%/100% vs 57.1%, P < 0.05). Moreover, the expression P73 protein was markedly increased in gastric cancer with lymph node metastasis, liver metastasis and ovarian metastasis as compared with that in non-metastatic cancer (94.4%, 100%, 100% vs 76.2%, P < 0.01). There was a positive correlation between P73 and mP53 expression (χ2 = 9.6736, P < 0.01).
CONCLUSION: P73 expression is correlated with the malignant behaviors of gastric cancer. Although P73 protein has a similar construction to P53 protein, its expression shows a positive correlation with that of mP53 protein. This finding indicates that P73 may play a role in the carcinogenesis of gastric cancer as a mimic mutant of P53.
- Citation: Lin Z, Xin Y, Wu DY. Clinicopathological significances of P73 and P53 protein expression in gastric carcinomas with tissue microarray technique. Shijie Huaren Xiaohua Zazhi 2007; 15(10): 1087-1091
- URL: https://www.wjgnet.com/1009-3079/full/v15/i10/1087.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i10.1087
组织芯片技术(tissue microarray/tissue chiP, TMA)是1998年美国国立癌症研究所Kononen et al[1]在基因芯片的基础上发明的, 其体积小, 信息含量大, 一次性实验即可获大量结果, 是一种高通量、多样本的分析工具, 并可以与DNA、RNA、蛋白质、抗体等技术相结合[1-4]. TMA是建立疾病, 特别是肿瘤的生物分子文库的强有力的工具, 有着广阔的应用前景[5-7]. P53基因是迄今发现与人类肿瘤相关性最高的抑癌基因, 几乎50%人类肿瘤与P53突变有关. 近年又发现了结构及功能都类似于P53的新基因P73, 有研究显示P73基因异常表达与胃癌的发生、发展有一定相关性[8-12]. 本文采用免疫组织化学方法观察胃癌及其癌前病变组织中P73和P53基因编码蛋白的表达与胃黏膜癌变、侵袭转移的关系, 探讨P73和P53基因异常表达在胃癌发生、发展过程中的作用机制及相互关系.
收集中国医科大学和辽宁省肿瘤医院2003-12/2004-05手术切除胃癌标本104例(其中79例取远癌正常胃黏膜作为对照)及癌旁肠上皮化生36例和不典型增生组织6例. 标本均经40 g/L甲醛固定, 常规石蜡包埋, 制作成4 μm厚的切片供定位用. 每例均由两名资深病理医师做病理学诊断并标记出癌组织和正常组织部位. 采用组织芯片制作仪(microarrayer, beecher instruments, USA)制作组织芯片(组织芯直径为1 mm), 蜡块2枚, 蜡块A含101个组织样品, 蜡块B含124个组织样品, 最终完成胃癌及其癌前病变的组织微阵列石蜡块的制备排布成组织芯片蜡块. 行常规4 μm连续石蜡切片30-50用于免疫组织化学染色的切片, 裱于经1 g/L多聚赖氨酸防脱片处理的载玻片上, 60 ℃烤片3 min, 58 ℃中继续烤片18 h, 常温保存备用.
采用SABC免疫组化方法对胃癌及其癌前病变组织芯片进行免疫组化染色(所有步骤依据产品说明进行), 以PBS(0.01 mol/L, pH7.4)替代一抗作阴性对照. 免疫组化染色结果判定: P73蛋白阳性反应颗粒定位于细胞核和胞质, P53蛋白阳性反应颗粒定位于细胞核. 每例标本选择2个有代表性的高倍视野, 计数200个肿瘤细胞, 取平均值. 阳性细胞数≤5%为阴性(-), 6%-25%为弱阳性(+), 26%-50%为中度阳性(++), >50%为强阳性(+++).
统计学处理 本研究所有数据均采用SPSS12.0统计学软件包处理, P<0.05视为差异具有统计学意义.
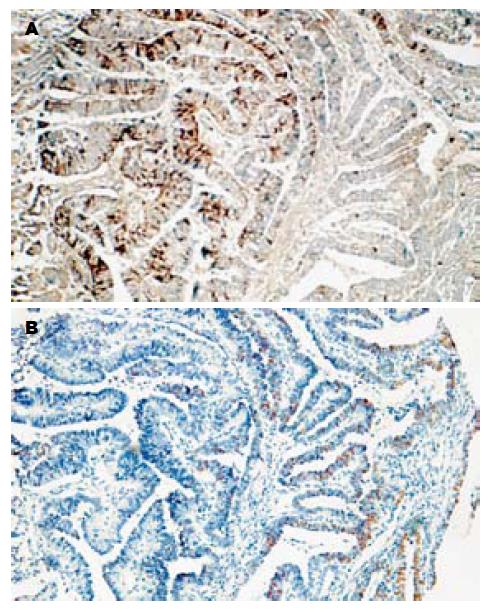
组织芯片蜡块组织排列整齐. 蜡块A中有癌组织32例, 远端正常组织32例, 不典型增生5例, 肠化生32例, 共101个样品. 蜡块B癌组织72例, 远端正常组织47例, 肠化生4例, 不典型增生1例, 共124个样品. 胃癌及其癌前病变组织芯片常规切片组织形态良好, 常规HE染色后组织芯片结构完整, 组织形态好有代表性(图1).
P73基因编码蛋白在胃癌组织中的阳性表达率(90.1%)显著高于远癌正常胃黏膜(17.9%)(P<0.01); P73蛋白在肠上皮化生组织中的阳性表达率(44.0%)显著高于远癌正常胃黏膜, 不典型增生病变组织中P73蛋白阳性表达率(80.0%)显著高于远癌正常胃黏膜(P<0.05), 而与肠上皮化生之间无显著差异. 胃癌Bormann大体分型中, Bor.Ⅲ/Ⅳ型胃癌P73蛋白阳性表达率(92.9%/100%)显著高于Bor.Ⅱ型胃癌(57.1%)(P<0.05). 伴转移胃癌组P73蛋白阳性表达率(淋巴结转移组: 94.4%, 肝转移组: 100%, 卵巢转移: 100%)显著高于无转移组(76.2%)(P<0.05, 表1). P73蛋白表达与mP53蛋白在胃癌组织中表达的关系: 胃癌组织中P73蛋白表达与mP53蛋白表达密切相关(P<0.01, 表2, 图2).
| 分组 | n | P73蛋白表达 | 阳性率(%) | χ2 | P | |||
| - | + | ++ | +++ | +~+++ | ||||
| 组织性质 | ||||||||
| 胃黏膜上皮 | 28 | 23 | 2 | 3 | 0 | 17.9 | ||
| 肠上皮化生 | 25 | 14 | 3 | 8 | 0 | 44.0 | 4.2831 | <0.05 vs N |
| 不典型增生 | 5 | 1 | 1 | 2 | 1 | 80.0 | 5.4239 | <0.05 vs N |
| 胃癌 | 81 | 8 | 12 | 28 | 33 | 90.1 | 24.7100 | <0.01 vs IM/N |
| 组织学分型 | >0.05 | |||||||
| 乳头状腺癌 | 1 | 1 | 0 | 0 | 0 | 0 | ||
| 高分化管状腺癌 | 6 | 1 | 0 | 2 | 3 | 83.3 | ||
| 中分化管状腺癌 | 25 | 2 | 2 | 8 | 13 | 91.7 | ||
| 低分化腺癌 | 30 | 3 | 5 | 10 | 12 | 90.0 | ||
| 黏液腺癌 | 13 | 0 | 2 | 8 | 3 | 100.0 | ||
| 印戒细胞癌 | 4 | 0 | 3 | 0 | 1 | 100.0 | ||
| 未分化癌 | 2 | 1 | 0 | 0 | 1 | 50.0 | ||
| 大体分型 | ||||||||
| 早期胃癌: IIc | 1 | 0 | 0 | 1 | 0 | -- | ||
| 进展期胃癌: | 5.6360 | <0.05 | ||||||
| BorrmanⅡ | 7 | 3 | 0 | 4 | 0 | 57.1 | ||
| BorrmanⅢ | 70 | 5 | 12 | 20 | 33 | 92.9 | ||
| BorrmanⅣ | 3 | 0 | 0 | 3 | 0 | 100.0 | ||
| 胃壁浸润深度 | >0.05 | |||||||
| 黏膜层 | 1 | 0 | 0 | 1 | 0 | -- | ||
| 肌层 | 6 | 1 | 0 | 4 | 1 | 100.0 | ||
| 浆膜下 | 53 | 5 | 7 | 20 | 21 | 90.6 | ||
| 穿出浆膜 | 21 | 2 | 5 | 3 | 11 | 90.5 | ||
| 转移 | 4.1324 | <0.05 | ||||||
| 无转移 | 21 | 5 | 4 | 5 | 7 | 76.2 | ||
| 淋巴结转移 | 54 | 3 | 7 | 20 | 24 | 94.4 | ||
| 肝转移 | 4 | 0 | 0 | 2 | 2 | 100.0 | ||
| 卵巢转移 | 1 | 0 | 1 | 0 | 0 | 100.0 | ||
| P73蛋白表达 | mP53基因编码蛋白表达 | 合计 | |
| - | +~+++ | ||
| - | 7 | 0 | 7 |
| +~+++ | 20 | 43 | 63 |
| 合计 | 27 | 43 | 70 |
P73蛋白在结构上与P53蛋白具有同源性, 在YAD, DBD及OD结构域的同源性分别为29%, 63%和38%[13-14], 而在羧基端无明显的同源性[15-17]. P73的功能同P53一样, 也属于转录因子, 能够诱导细胞周期阻滞和凋亡并调控DNA损伤的修复, 其作用机制基本相似[18]. 由于P73在转录激活区和核心DNA连接区与P53有高度的相似性, 当P73过表达时也能激活含有P53结合位点的受体, 如P21Wafl, 当P73发生突变时, 其诱导P21Wafl的活性也将被阻断[19-20]. Yamamoto et al[21]在乳腺癌的研究中发现P73阳性癌组织的凋亡系数比P73阴性者高, 并认为P73表达的丢失使细胞获得了逃避凋亡的特性. Gaiddon et al[22]发现, P73可以和多种细胞周期蛋白(A, B, D, E)相互作用, 使多种P73亚型第86位苏氨酸磷酸化, 其T86磷酸化作用发生在S期和G2/M期, 这种CDK依赖的T86磷酸化作用能抑制P73诱导内源性P21的表达. 这些结果均提示, P73具有抑制细胞增殖、诱导凋亡的功能.
Yokozaki et al[23]用PCR-RFLP和RT-PCR SSCP分析了32例存在杂合性丢失的胃癌, 发现P73的LOH为12/37(37.5%), 但没有发生P73的突变. 通过对发生杂合性丢失病例的年龄及标本组织表型分折提示胃癌的P73杂合性丢失, 发生于胃癌早期且好发于小凹性胃癌. 在P73表达方面, 该研究小组分析了8例存在LOH的标本, 其中6例为低水平表达, 作者推测可能是因为P73不同于P53, 是单等位基因表达, 遗传印迹已经使父源等位基因拷贝沉寂, 剩下的母源等位基因大量缺失, 就可导致P73基因失活, 进而诱导肿瘤的发生. Yokozaki认为P73基因变异(包括LOH和表达异常)可能参与了小凹性胃癌的形成. Kang et al[10]分析了75例胃癌标本及5个胃癌细胞系, 发现在非肿瘤组织及4个细胞系中P73为低水平表达, 但在37/39(94.9%)癌组织中存在显著性的高水平表达. 分析等位基因状态时发现正常胃黏膜P73为单等位基因表达, 而在癌组织为双等位基因表达, 作者认为这种改变是癌变后的继发基因变化. 国内李伟et al[11-12]利用RT-PCR及SSLP技术对胃癌、癌旁及正常组织标本中P73 mRNA表达水平及P73基因杂合性丢失进行了分析, 结果发现, 胃癌及癌旁组织中P73基因表达较正常胃黏膜显著增高(P<0.05), 在癌旁肠化组织中也发现了P73基因的高表达, 提示P73基因的过表达可能参与了胃癌, 尤其是肠型胃癌的发生与发展. 李伟et al进一步分析P73基因的表达与胃癌临床病理参数之间关系发现, 随着肿瘤增大、浸润深度的增加及淋巴结转移, P73 mRNA表达有增高趋势, 临床Ⅲ-Ⅳ期较Ⅰ-Ⅱ期表达明显升高(P<0.05), 提示P73基因过表达可能参与了胃癌细胞增殖、侵袭及转移, 可提示胃癌的预后不良. 最近, Gaiddon et al[22]在胃食管连接处的胃腺癌中检测到了P73基因第5外显子上谷氨酰胺突变为精氨酸, 但限于很少的病例. 我们发现, P73基因编码蛋白表达与胃黏膜癌前病变及胃癌的恶性病理生物学行为密切相关. P73基因虽与抑癌基因P53同源, 但P73蛋白表达与mP53蛋白表达呈正相关(P<0.01), 提示P73基因可能不是抑癌基因而是P53的一种模拟突变体, 在细胞内可以模拟mP53分子行使功能, 从而使野生型P53基因的抑癌功能失效, 最终导致细胞恶变, 在胃癌发生、发展中起作用. 本研究结果为进一步阐释P73, P53基因异常与胃癌发生、发展的关系提供了有益的研究资料.
TMA是一种高通量的组织病理学分析工具, 他克服了传统病理技术只能逐个组织切片进行研究的落后方式, 可成百成千倍的提高效率, 减少时间和资金的耗费; 可同时平行的研究组织细胞形态、一个特异性基因、蛋白在几百乃上千种疾病样本中的表达及功能状态, 避免了传统技术在不同实验条件下结果的差异性, 对比性和重复性强, 使信息来源可靠、确实, 可以快速筛选出有预防、诊断和治疗用途的基因和蛋白分子. 在肿瘤研究领域中, TMA对于肿瘤易感因素判断、病因学及发病机制、诊断和鉴别诊断、治疗及预后评估等方面均起到重要作用. 本研究进一步显示, TMA对于快速检测胃癌及其他肿瘤的分子生物学改变是一个强有力的工具, 这种高通量大样本, 高效、省时、低消耗的快速扫描式研究是传统病理学技术所远不能及的.
因P73与P53基因及编码蛋白具有同源性曾被认为是候选抑癌基因. 但近来研究发现P73基因在肿瘤发生、发展过程中的异常改变与经典的抑癌基因失活致癌理论相矛盾, 因此有研究者对P73基因是否为抑癌基因提出疑问, 也引起学者对P73与P53及肿瘤的关系更为关注.
本文利用组织芯片技术研究P73和mP53基因编码蛋白在胃癌中的表达及意义, 选题有新意, 技术成熟, 结果与结论有一定参考意义.
编辑: 王晓瑜 电编:张敏
| 1. | Kononen J, Bubendorf L, Kallioniemi A, Bärlund M, Schraml P, Leighton S, Torhorst J, Mihatsch MJ, Sauter G, Kallioniemi OP. Tissue microarrays for high-throughput molecular profiling of tumor specimens. Nat Med. 1998;4:844-847. [PubMed] [DOI] |
| 2. | Heiskanen M, Kononen J, Bärlund M, Torhorst J, Sauter G, Kallioniemi A, Kallioniemi O. CGH, cDNA and tissue microarray analyses implicate FGFR2 amplification in a small subset of breast tumors. Anal Cell Pathol. 2001;22:229-234. [PubMed] [DOI] |
| 3. | Nocito A, Bubendorf L, Tinner EM, Süess K, Wagner U, Forster T, Kononen J, Fijan A, Bruderer J, Schmid U. Microarrays of bladder cancer tissue are highly representative of proliferation index and histological grade. J Pathol. 2001;194:349-357. [PubMed] [DOI] |
| 4. | Kallioniemi OP, Wagner U, Kononen J, Sauter G. Tissue microarray technology for high-throughput molecular profiling of cancer. Hum Mol Genet. 2001;10:657-662. [PubMed] [DOI] |
| 5. | Zheng M, Simon R, Kononen J, Sauter G, Mihatsch MJ, Moch H. Analysis of gene expression profiles among 3 epithelial ovarian tumor subtypes using cDNA and tissue microarrays. Ai Zheng. 2004;23:771-776. [PubMed] |
| 6. | Andersen CL, Monni O, Wagner U, Kononen J, Bärlund M, Bucher C, Haas P, Nocito A, Bissig H, Sauter G. High-throughput copy number analysis of 17q23 in 3520 tissue specimens by fluorescence in situ hybridization to tissue microarrays. Am J Pathol. 2002;161:73-79. [PubMed] [DOI] |
| 7. | Li H, Sun Y, Kong QY, Zhang KL, Wang XW, Chen XY, Wang Q, Liu J. Combination of nucleic acid and protein isolation with tissue array construction: using defined histologic regions in single frozen tissue blocks for multiple research purposes. Int J Mol Med. 2003;12:299-304. [PubMed] [DOI] |
| 8. | Kaghad M, Bonnet H, Yang A, Creancier L, Biscan JC, Valent A, Minty A, Chalon P, Lelias JM, Dumont X. Monoallelically expressed gene related to p53 at 1p36, a region frequently deleted in neuroblastoma and other human cancers. Cell. 1997;90:809-819. [PubMed] [DOI] |
| 9. | Oren M. Lonely no more: p53 finds its kin in a tumor suppressor haven. Cell. 1997;90:829-832. [PubMed] [DOI] |
| 10. | Kang MJ, Park BJ, Byun DS, Park JI, Kim HJ, Park JH, Chi SG. Loss of imprinting and elevated expression of wild-type p73 in human gastric adenocarcinoma. Clin Cancer Res. 2000;6:1767-1771. [PubMed] |
| 13. | Aqeilan RI, Pekarsky Y, Herrero JJ, Palamarchuk A, Letofsky J, Druck T, Trapasso F, Han SY, Melino G, Huebner K. Functional association between Wwox tumor suppressor protein and p73, a p53 homolog. Proc Natl Acad Sci U S A. 2004;101:4401-4406. [PubMed] [DOI] |
| 14. | Douc-Rasy S, Goldschneider D, Million K, Bénard J. Interrelations between p73 and p53: a model, neuroblastoma. Med Sci (Paris). 2004;20:317-324. [PubMed] [DOI] |
| 15. | Melino G, Lu X, Gasco M, Crook T, Knight RA. Functional regulation of p73 and p63: development and cancer. Trends Biochem Sci. 2003;28:663-670. [PubMed] [DOI] |
| 16. | Maisse C, Guerrieri P, Melino G. p73 and p63 protein stability: the way to regulate function? Biochem Pharmacol. 2003;66:1555-1561. [PubMed] [DOI] |
| 17. | Chen YK, Huse SS, Lin LM. Differential expression of p53, p63 and p73 proteins in human buccal squamous-cell carcinomas. Clin Otolaryngol Allied Sci. 2003;28:451-455. [PubMed] [DOI] |
| 18. | Agami R, Bernards R. Distinct initiation and maintenance mechanisms cooperate to induce G1 cell cycle arrest in response to DNA damage. Cell. 2000;102:55-66. [PubMed] [DOI] |
| 19. | Marin MC, Jost CA, Irwin MS, DeCaprio JA, Caput D, Kaelin WG. Viral oncoproteins discriminate between p53 and the p53 homolog p73. Mol Cell Biol. 1998;18:6316-6324. [PubMed] [DOI] |
| 20. | Jost CA, Marin MC, Kaelin WG. p73 is a simian [correction of human] p53-related protein that can induce apoptosis. Nature. 1997;389:191-194. [PubMed] [DOI] |
| 21. | Yamamoto T, Oda K, Kubota T, Miyazaki K, Takenouti Y, Nimura Y, Hamaguchi M, Matsuda S. Expression of p73 gene, cell proliferation and apoptosis in breast cancer: Immunohistochemical and clinicopathological study. Oncol Rep. 2002;9:729-735. [PubMed] [DOI] |
| 22. | Gaiddon C, Lokshin M, Gross I, Levasseur D, Taya Y, Loeffler JP, Prives C. Cyclin-dependent kinases phosphorylate p73 at threonine 86 in a cell cycle-dependent manner and negatively regulate p73. J Biol Chem. 2003;278:27421-27431. [PubMed] [DOI] |
| 23. | Yokozaki H, Shitara Y, Fujimoto J, Hiyama T, Yasui W, Tahara E. Alterations of p73 preferentially occur in gastric adenocarcinomas with foveolar epithelial phenotype. Int J Cancer. 1999;83:192-196. [PubMed] [DOI] |