修回日期: 2007-02-05
接受日期: 2007-02-08
在线出版日期: 2007-04-08
目的: 探讨RECK及基质金属蛋白酶-9 (MMP-9)表达与食管癌发生、发展及浸润、转移的关系.
方法: 应用免疫组化SP法检测62例食管鳞癌组织、31例癌旁不典型增生组织及62例正常食管黏膜组织中RECK及MMP-9蛋白表达. 采用χ2检验进行统计学分析.
结果: 食管鳞癌组织中RECK和MMP-9蛋白表达与癌的组织学分级、浸润深度及淋巴结转移密切相关(χ2 = 10.422, 8.550, 4.751; χ2 = 8.447, 14.333, 5.373; 均P<0.05). 在食管鳞癌癌变过程中RECK蛋白表达在癌组织、癌旁不典型增生组织及正常黏膜组织中的表达率依次增高, 分别为59.7%, 71.0%, 85.5%, 组间比较有明显差异(P<0.01); 而MMP-9蛋白在癌组织、癌旁不典型增生组织及正常黏膜组织中的表达率依次降低, 分别为80.6%, 80.6%, 27.4%, 组间比较有明显差异(P<0.01).
结论: RECK和MMP-9在食管癌的浸润、转移及黏膜上皮癌变过程中起重要作用, RECK及MMP-9的联合检测可望成为食管鳞癌早期诊断和判断预后的分子指标之一.
引文著录: 李晟磊, 赵秋民, 刘宗文, 赵志华, 高冬玲, 郑湘予, 陈奎生, 张云汉. 食管鳞癌中RECK和MMP-9蛋白表达的相关性及临床病理意义. 世界华人消化杂志 2007; 15(10): 1082-1086
Revised: February 5, 2007
Accepted: February 8, 2007
Published online: April 8, 2007
AIM: To investigate the expression of reversion inducing cysteine rich protein with Kazal motifs (RECK) and matrix metalloproteinase-9 (MMP-9) protein and their correlations with the occurrence, development, invasion and metasta-sis of esophageal squamous cell carcinoma.
METHODS: SP immunohistochemical method was used to detect the expression of RECK and MMP-9 protein in 62 cases of esophageal squamous cell carcinoma (EC), 31 cases of adjacent atypical hyperplasia (AH) and 62 cases of normal esophageal epithelium (NE). Statistical analysis was performed using chi-square test.
RESULTS: The protein expression of RECK and MMP-9 were closely correlated with the tumor grade, infiltration and lymph node metastasis in esophageal squamous cell carcinoma (RECK: χ2 = 10.422, 8.550, 4.751; MMP-9: χ2 = 8.447, 14.333, 5.373; all P < 0.05). The expression rate of RECK protein was increased ordinally in EC, AH and NE which was 59.7%, 71.0%, and 85.5%, respectively, and there was significant difference between every two groups (P < 0.01). However, the expression rate of MMP-9 protein was decreased ordinally in EC, AH and NE, which was 80.6%, 80.6%, 27.4%, respectively, and there was significant difference between every two groups (P < 0.01).
CONCLUSION: RECK and MMP-9 may play important roles in the infiltration, metastasis and carcinomatous changes of mucosal epithelium in esophageal carcinoma. United detection of RECK and MMP-9 can be used in the early diagnosis and prognosis judgement of EC.
- Citation: Li SL, Zhao QM, Liu ZW, Zhao ZH, Gao DL, Zheng XY, Chen KS, Zhang YH. Correlation between the protein expression of reversion inducing cysteine rich protein with Kazal motifs and matrix matalloproteinase-9 in esophageal squamous cell carcinoma and its clinical pathological significance. Shijie Huaren Xiaohua Zazhi 2007; 15(10): 1082-1086
- URL: https://www.wjgnet.com/1009-3079/full/v15/i10/1082.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i10.1082
RECK(reversion inducing cysteine rich protein with Kazal motifs, RECK)为一种新近发现的肿瘤抑制基因, 他具有独特的抑制基质金属蛋白酶(matrix matalloproteinases, MMPs)表达与活性的功能, 是一种基质金属蛋白酶抑制剂[1]. 并且RECK基因的表达与肿瘤的浸润转移及血管生成密切相关, 研究表明, 肝癌、胰腺癌、乳腺癌、肺癌中RECK基因表达量与肿瘤的侵袭力呈负相关, 且RECK基因表达较高的患者预后往往也明显好于表达量低的患者[2-5]. 而细胞外基质(extra cellular matrix, ECM)在肿瘤的浸润和转移中同样也起着非常关键的作用[6], 肿瘤细胞在浸润和转移过程中必须破坏ECM, MMPs在参与破坏细胞外基质的酶类中起着非常重要的作用, 其家族中的MMP-2及MMP-9与肿瘤的浸润转移的关系又最为密切, 他能分解正常组织的基质, 促使肿瘤增生和癌细胞的转移[7-8]. 有关MMPs与食管癌浸润、转移的关系虽有部分文献报道, 但RECK基因与食管癌浸润、转移的关系及RECK和MMP-9表达相关性的研究, 迄今国内外均未见报道. 本文采用免疫组化SP法检测MMP-9及其抑制剂RECK基因在62例食管鳞癌组织、31例癌旁不典型增生组织及62例正常食管黏膜组织的表达情况, 探讨RECK和MMP-9在食管癌发生、发展中的作用, 以期寻找食管癌早期诊断和判断预后的分子指标.
62例食管癌手术切除标本于2006-02-26/03-16取自食管癌高发区河南省安阳市肿瘤医院, 所有病例术前均无化疗、放疗及免疫治疗史. 其中男36例, 女26例, 年龄38-75(平均60.6±9.5)岁. 全部病理组织学证实均为鳞状细胞癌. 其中组织学分级Ⅰ级15例, Ⅱ级25例, Ⅲ级22例; 伴淋巴结转移者20例, 无淋巴结转移者42例. 浸润深度分三组, 浸达浅肌层者7例, 浸达深肌层者14例, 浸达纤维膜者41例. 全部样本分别在癌灶、癌旁3 cm以内及远端正常黏膜组织3处取材, 经40 g/L多聚甲醛液固定, 常规脱水, 石蜡包埋, 连续切片, 切片厚度4-6 μm, 分别用于HE和免疫组化染色. 鼠抗人RECK mAb购自美国Santa Cruz公司, 羊抗人MMP-9 mAb购自福州迈新生物技术开发公司, SP免疫组化试剂盒购自北京中杉金桥生物技术开发公司.
采用SP法, RECK, MMP-9 mAb稀释, 稀释倍数分别为1:100和1:30, DAB显色, 苏木素复染. 染色步骤严格按说明书进行, 以PBS液代替Ⅰ抗体作为阴性对照, 阳性对照为已知的RECK, MMP-9阳性的乳腺癌组织切片. RECK及MMP-9蛋白阳性信号均呈棕黄色颗粒样物质, 位于细胞质内. 高倍镜下随机选取5个视野(每个视野观察细胞数不少于200个), 按阳性细胞所占百分比及着色深浅进行结果判定[9-10]. (1)按切片中细胞着色深浅评分: 0分, 细胞无显色; 1分, 浅黄色; 2分, 棕黄色; 3分, 棕褐色. (2)按阳性细胞数占同类细胞数的百分比, <30%为1分, 30%-70%为2分, >70%为3分. 取(1), (2)两项评分的乘积作为总积分, 0-1分为阴性(-), 2-3分为弱阳性(+), ≥4分为阳性(++).
统计学处理 应用SPSS11.0统计学软件, 采用χ2检验. 检验水准a = 0.05.
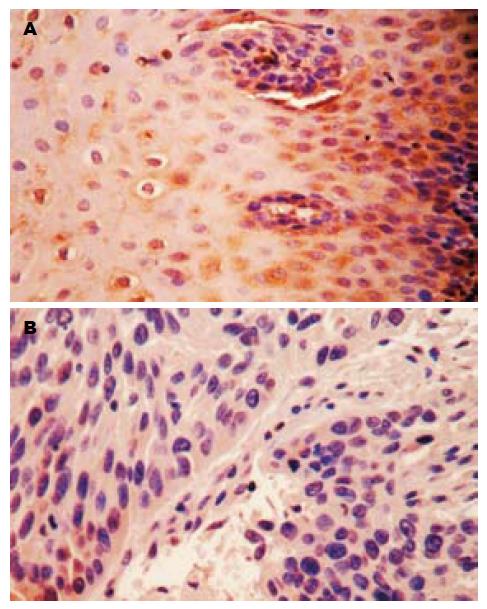
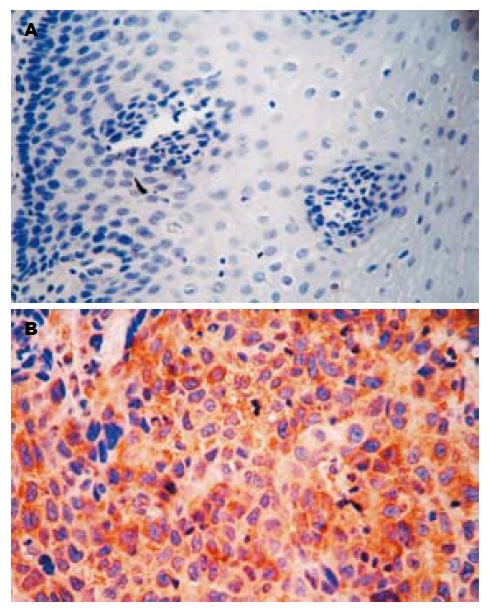
RECK蛋白阳性表达主要位于肿瘤细胞的胞质中, 呈浅黄色至深黄色(图1). 在食管鳞癌癌变过程中RECK蛋白表达在癌组织、癌旁不典型增生组织及正常黏膜组织中的表达率依次增高, 分别为59.7%(37/62), 71.0%(22/31), 85.5%(53/62), 组间比较有明显差异(χ2 = 10.331, P<0.01)(表1). RECK蛋白表达与食管鳞癌患者的性别、年龄无关(P>0.05), 与组织学分级、浸润深度、淋巴结转移有关(χ2分别为10.422, 8.550, 4.751, P均<0.05)(表2).
| n | RECK | χ2 | P | MMP-9 | χ2 | P | |||||||
| - | + | ++ | 阳性率(%) | - | + | ++ | 阳性率(%) | ||||||
| 正常黏膜上皮 | 62 | 9 | 24 | 29 | 85.5 | 10.331 | 0.006 | 45 | 16 | 1 | 27.4 | 43.684 | 0.000 |
| 非典型增生 | 31 | 9 | 10 | 12 | 71.0 | 6 | 9 | 16 | 80.6 | ||||
| 鳞癌 | 62 | 25 | 17 | 20 | 59.7 | 12 | 7 | 43 | 80.6 | ||||
| n | RECK | χ2 | P | MMP-9 | χ2 | P | |||||
| 阴性(n) | 阳性(n) | 阳性率(%) | 阴性(n) | 阳性(n) | 阳性率(%) | ||||||
| 性别 | |||||||||||
| 男 | 36 | 15 | 21 | 58.3 | 0.064 | 0.800 | 7 | 29 | 80.6 | 0.000 | 0.983 |
| 女 | 26 | 10 | 16 | 61.5 | 5 | 21 | 80.8 | ||||
| 年龄 | |||||||||||
| ≥60岁 | 33 | 13 | 20 | 60.6 | 0.025 | 0.874 | 8 | 25 | 75.8 | 1.080 | 0.299 |
| <60岁 | 29 | 12 | 17 | 58.6 | 4 | 25 | 86.2 | ||||
| 组织分级 | |||||||||||
| Ⅰ | 15 | 1 | 14 | 93.3 | 7 | 8 | 53.3 | ||||
| Ⅱ | 25 | 11 | 14 | 56.0 | 10.422 | 0.005 | 3 | 22 | 88.0 | 8.447 | 0.015 |
| Ⅲ | 22 | 13 | 9 | 40.9 | 2 | 20 | 90.9 | ||||
| 浸润深度 | |||||||||||
| 浅肌层 | 7 | 0 | 7 | 100.0 | 5 | 2 | 28.6 | ||||
| 深肌层 | 14 | 5 | 9 | 64.3 | 8.550 | 0.014 | 4 | 10 | 71.4 | 14.333 | 0.001 |
| 纤维膜 | 41 | 20 | 21 | 51.2 | 3 | 38 | 92.7 | ||||
| 淋巴结转移 | |||||||||||
| 无 | 42 | 13 | 29 | 69.0 | 4.751 | 0.029 | 12 | 30 | 71.4 | 5.373 | 0.020 |
| 有 | 20 | 12 | 8 | 40.0 | 0 | 20 | 100.0 | ||||
MMP-9蛋白阳性着色定位于细胞质, 呈棕黄色或深黄色(图2). 在食管鳞癌癌变过程中MMP-9蛋白在癌组织、癌旁不典型增生组织及正常黏膜组织中的表达率依次降低, 分别为80.6%(50/62), 80.6%(25/31), 27.4%(17/62), 组间比较有明显差异(χ2 = 43.684, P<0.01)(表1). MMP-9蛋白表达在食管鳞癌患者的性别、年龄分组中差异无统计学意义(P>0.05), MMP-9蛋白阳性表达率随着组织学分级、浸润深度级别的增加逐渐升高(χ2分别为8.447, 14.333; P均<0.05); 有淋巴结转移组MMP-9蛋白阳性表达率高于无淋巴结转移组(χ2 = 5.373, P<0.05)(表2).
作为消化系统中最常见的恶性肿瘤之一, 研究人员对食管癌已经做了大量的研究, 结果表明, 食管癌的发生、发展是一个多阶段多因素的过程[11]. 一般表现为单纯增生、不典型增生、原位癌、浸润癌这样一个自然病程. 其中涉及到许多癌基因及抑癌基因的变化, 但具体调控机制仍不完全清楚. 本研究应用免疫组化技术系统的对比研究了食管黏膜上皮癌变过程中MMP-9及其抑制剂RECK蛋白的变化规律及其与食管鳞癌临床生物学行为的关系.
RECK基因是由Takahashi et al[1]在转染了v-Ki-Ras基因的NIH3T3细胞系中发现的, RECK基因定位于9p13-p12染色体上, 编码一个相对分子质量为110000的膜锚合葡萄糖蛋白, 最初认为RECK是一个新的转化抑制基因, 后来发现他能抑制3个MMP的成员MMP-2, MMP-9及MT1-MMP的分泌与活性[12]. RECK基因在正常组织中高表达, 而在各种肿瘤来源的细胞系及转染了ras等癌基因的细胞中不表达, 许多癌基因如ras, fos, myc等均可下调RECK基因的表达[5,13], 这说明RECK基因可能是癌基因共同作用的一个负调节靶位点, 此外RECK基因的适量表达能抑制血管的生成[14-16]. 国外的临床研究发现, RECK作为一个独立的因素与肝癌、胰腺癌及乳腺癌的预后密切相关, 肿瘤组织中RECK表达阳性的患者预后均好于表达阴性的患者[2-5], 提高RECK的表达可抑制肿瘤细胞的浸润转移[17-21]. 此外RECK基因跨膜部分还可能参与信号的传导过程[18], RECK在肿瘤生长与转移过程中所起的作用可能比现在发现的更为广泛. 目前认为RECK可能通过抑制MMP酶活性和肿瘤血管新生两方面影响肿瘤的侵袭转移, 为一种抑癌基因[16]. 本实验研究结果显示, RECK基因在正常食管组织、食管癌旁不典型增生组织及癌组织中均有表达, 但在癌组织中的表达水平显著降低, 差异有统计学意义. 这就说明了RECK低表达的肿瘤具有更强的侵袭能力.
MMPs家族是降解细胞外基质的主要酶类, 在肿瘤侵袭和转移中具有重要意义[7-8]. MMPs家族中的明胶酶是唯一能降解ECM和BM中Ⅳ胶原三螺旋结构的酶, 可分为MMP-2和MMP-9两个亚型, 其中MMP-9不仅可以降解、破坏肿瘤患者的细胞外基质和基底膜, 使肿瘤细胞通过缺损的基底膜向周围组织浸润, 还通过影响新生血管的生成促进肿瘤的生长和扩散. 本实验研究结果显示, MMP-9在正常食管黏膜上皮表达极低, 在非典型增生和浸润癌中的表达显著升高, 与正常食管黏膜上皮比较有明显差异. MMP-9蛋白表达与食管鳞癌的性别、年龄无显著关系, 与组织学分级、浸润深度和有无淋巴结转移显著相关.
结果表明, RECK基因正常食管组织、癌旁不典型增生组织及癌组织中均有表达, 但在食管癌组织中的表达水平显著降低, 而食管癌组织中MMP-9的表达水平与正常组织相比显著升高. 这与之前在肝细胞癌、大肠癌和胰腺癌的临床研究结果一致[3]. MMP-9高表达可促进细胞外基质的降解, 有利于肿瘤细胞的侵犯和转移. 这就充分说明RECK参与对MMPs的调节, 肿瘤对MMP-9的调节除了直接上调其表达外, 还可以通过下调RECK基因的表达而间接上调MMP-9的活性[22-23].
总之, 作为一种新型的MMPs抑制基因, RECK的表达量与肿瘤患者预后密切相关; 同时, RECK对基质金属蛋白酶的抑制作用具有一定的针对性. 对RECK基因的深入研究有利于我们进一步的了解食管癌的生物学行为, 为食管癌的早期诊断和治疗提供一个新的发展方向.
RECK基因是在NIH3T3细胞中发现的一种新的突变抑制基因, 他在调节MMPs和肿瘤浸润、转移和血管生成等方面起着重要的作用.
有关MMPs与食管癌浸润、转移的关系虽有部分文献报道, 但RECK基因与食管癌浸润、转移的关系及RECK和MMP-9表达相关性的研究, 迄今国内外均未见报道. 关于RECK和肿瘤细胞浸润、转移机制的研究已成为热点.
国内外研究表明, 肝癌、胰腺癌、乳腺癌、肺癌中RECK基因表达量与肿瘤的侵袭力呈负相关, 且RECK基因表达较高的患者预后往往也明显好于表达量低的患者.MMP-9与肿瘤的浸润转移的关系非常为密切, 他能分解正常组织的基质, 促使肿瘤增生和癌细胞的转移.
对RECK基因的深入研究有利于进一步的了解食管癌的生物学行为, 为食管癌的早期诊断和治疗提供一个新的发展方向. RECK可作为食管癌早期诊断和判断预后的分子指标.
本文分析了RECK和MMP-9蛋白在食管鳞癌组织中的表达, 发现他们与癌发生、浸润、转移有密切关系, 对早期诊断和预后有帮助, 科学性较好, 有临床价值.
编辑: 张焕兰 电编:张敏
| 1. | Takahashi C, Sheng Z, Horan TP, Kitayama H, Maki M, Hitomi K, Kitaura Y, Takai S, Sasahara RM, Horimoto A. Regulation of matrix metalloproteinase-9 and inhibition of tumor invasion by the membrane-anchored glycoprotein RECK. Proc Natl Acad Sci U S A. 1998;95:13221-13226. [PubMed] [DOI] |
| 2. | Span PN, Sweep CG, Manders P, Beex LV, Leppert D, Lindberg RL. Matrix metalloproteinase inhibitor reversion-inducing cysteine-rich protein with Kazal motifs: a prognostic marker for good clinical outcome in human breast carcinoma. Cancer. 2003;97:2710-2715. [PubMed] [DOI] |
| 3. | Masui T, Doi R, Koshiba T, Fujimoto K, Tsuji S, Nakajima S, Koizumi M, Toyoda E, Tulachan S, Ito D. RECK expression in pancreatic cancer: its correlation with lower invasiveness and better prognosis. Clin Cancer Res. 2003;9:1779-1784. [PubMed] |
| 4. | da Silva Cardeal LB, Brohem CA, Corrêa TC, Winnischofer SM, Nakano F, Boccardo E, Villa LL, Sogayar MC, Maria-Engler SS. Higher expression and activity of metalloproteinases in human cervical carcinoma cell lines is associated with HPV presence. Biochem Cell Biol. 2006;84:713-719. [PubMed] [DOI] |
| 5. | Chang HC, Cho CY, Hung WC. Downregulation of RECK by promoter methylation correlates with lymph node metastasis in non-small cell lung cancer. Cancer Sci. 2007;98:169-173. [PubMed] [DOI] |
| 6. | Rajapakse N, Kim MM, Mendis E, Huang R, Kim SK. Carboxylated chitooligosaccharides (CCOS) inhibit MMP-9 expression in human fibrosarcoma cells via down-regulation of AP-1. Biochim Biophys Acta. 2006;1760:1780-1788. [PubMed] [DOI] |
| 7. | Egeblad M, Werb Z. New functions for the matrix metalloproteinases in cancer progression. Nat Rev Cancer. 2002;2:161-174. [PubMed] [DOI] |
| 8. | Sheu BC, Lien HC, Ho HN, Lin HH, Chow SN, Huang SC, Hsu SM. Increased expression and activation of gelatinolytic matrix metalloproteinases is associated with the progression and recurrence of human cervical cancer. Cancer Res. 2003;63:6537-6542. [PubMed] |
| 11. | 李 玉林. 病理学. 第6版. 北京: 人民卫生出版社 2004; 113-117. |
| 12. | Oh J, Takahashi R, Kondo S, Mizoguchi A, Adachi E, Sasahara RM, Nishimura S, Imamura Y, Kitayama H, Alexander DB. The membrane-anchored MMP inhibitor RECK is a key regulator of extracellular matrix integrity and angiogenesis. Cell. 2001;107:789-800. [PubMed] [DOI] |
| 13. | Sasahara RM, Takahashi C, Noda M. Involvement of the Sp1 site in ras-mediated downregulation of the RECK metastasis suppressor gene. Biochem Biophys Res Commun. 1999;264:668-675. [PubMed] [DOI] |
| 14. | Takenaka K, Ishikawa S, Kawano Y, Yanagihara K, Miyahara R, Otake Y, Morioka Y, Takahashi C, Noda M, Wada H. Expression of a novel matrix metalloproteinase regulator, RECK, and its clinical significance in resected non-small cell lung cancer. Eur J Cancer. 2004;40:1617-1623. [PubMed] [DOI] |
| 15. | Noda M, Oh J, Takahashi R, Kondo S, Kitayama H, Takahashi C. RECK: a novel suppressor of malignancy linking oncogenic signaling to extracellular matrix remodeling. Cancer Metastasis Rev. 2003;22:167-175. [PubMed] [DOI] |
| 16. | Sasahara RM, Brochado SM, Takahashi C, Oh J, Maria-Engler SS, Granjeiro JM, Noda M, Sogayar MC. Transcriptional control of the RECK metastasis/angiogenesis suppressor gene. Cancer Detect Prev. 2002;26:435-443. [PubMed] [DOI] |
| 17. | Oh J, Seo DW, Diaz T, Wei B, Ward Y, Ray JM, Morioka Y, Shi S, Kitayama H, Takahashi C. Tissue inhibitors of metalloproteinase 2 inhibits endothelial cell migration through increased expression of RECK. Cancer Res. 2004;64:9062-9069. [PubMed] [DOI] |
| 18. | Liu LT, Chang HC, Chiang LC, Hung WC. Histone deacetylase inhibitor up-regulates RECK to inhibit MMP-2 activation and cancer cell invasion. Cancer Res. 2003;63:3069-3072. [PubMed] |
| 19. | Correa TC, Brohem CA, Winnischofer SM, da Silva Cardeal LB, Sasahara RM, Taboga SR, Sogayar MC, Maria-Engler SS. Downregulation of the RECK-tumor and metastasis suppressor gene in glioma invasiveness. J Cell Biochem. 2006;99:156-167. [PubMed] [DOI] |
| 20. | Li Y, Zhang Y, Zheng Q. Expression of RECK gene and MMP-9 in hilar cholangiocarcinoma and its clinical significance. J Huazhong Univ Sci Technolog Med Sci. 2005;25:552-554. [PubMed] [DOI] |
| 21. | Song SY, Son HJ, Nam E, Rhee JC, Park C. Expression of reversion-inducing-cysteine-rich protein with Kazal motifs (RECK) as a prognostic indicator in gastric cancer. Eur J Cancer. 2006;42:101-108. [PubMed] [DOI] |
| 22. | Xu ZY, Gao JP, Zhang ZP, Ge JP, Xu CL, Sun YH. Expression and significance of the matrix metalloproteinase inhibitor RECK gene in prostate cell strains. Zhonghua Nan Ke Xue. 2005;11:727-730. [PubMed] |
| 23. | Takagi S, Kato Y, Asano K, Ohsaki T, Bosnakovski D, Hoshino Y, Okumura M, Kadosawa T, Fujinaga T. Matrix metalloproteinase inhibitor RECK expression in canine tumors. J Vet Med Sci. 2005;67:761-767. [PubMed] [DOI] |