修回日期: 2006-08-18
接受日期: 2006-08-22
在线出版日期: 2007-01-08
目的: 探讨术前希罗达化疗对结直肠癌胸苷磷酸化酶/血小板衍化内皮细胞生长因子(TP/PD-ECGF)表达、肿瘤组织微血管密度(MVD)的影响.
方法: 对32例术前应用希罗达化疗的和25例未做术前化疗的结直肠癌标本, 进行TP/PD-ECGF、CD34免疫组织化学标记, 检测其TP/PD-ECGF表达及微血管密度MVD.
结果: 术前化疗组TP/PD-ECGF阳性表达率显著低于对照组(31.2% vs 60%, P<0.05); MVD值在术前化疗组与对照组分别为20.7±8.5和42.3±7.8, 两者差异有显著性(P<0.05).
结论: 希罗达术前化疗能使TP/PD-ECGF活性降低, 抑制结直肠癌肿瘤血管生成.
引文著录: 余细球. 希罗达术前化疗对结直肠癌组织TP/PD-ECGF表达和血管生成的影响. 世界华人消化杂志 2007; 15(1): 95-98
Revised: August 18, 2006
Accepted: August 22, 2006
Published online: January 8, 2007
AIM: To investigate the effect of capecitabine (xeloda) by preoperation administration on the microvessel density (MVD) and expression of thymidine phosphorylase/platelet-derived endothelial cell growth factor (TP/PD-ECGF) in patients with colorectal cancer.
METHODS: Immunohistochemical staining of CD34 and TP/PD-ECGF monoclonal antibodies was performed in 32 colorectal cancer patients with preoperative xeloda chemotherapy and 25 cases without chemotherapy (served as controls), and then the expression of TP/PD-ECGF and MVD were analyzed.
RESULTS: The positive rate of TP/PD-ECGF expression in patients with chemotherapy was significantly lower than that in the controls (31.2% vs 60.0%, P < 0.05). As compared with that in the controls, the value of MVD in patients with chemotherapy was markedly different (20.7 ± 8.5 vs 42.3 ± 7.8, P < 0.05).
CONCLUSION: Preoperation chemotherapy of xeloda can decrease the activity of TP/PD-ECGF and inhibit the angiogenesis in colorectal cancer.
- Citation: Yu XQ. Preoperative administration of xeloda on the angiogenesis and expression of thymidine phosphorylase/platelet-derived endothelial cell growth factor in colorectal cancer. Shijie Huaren Xiaohua Zazhi 2007; 15(1): 95-98
- URL: https://www.wjgnet.com/1009-3079/full/v15/i1/95.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i1.95
希罗达(N4-戊氧基碳酰-5'-脱氧-5-氟胞嘧啶)是一种新型口服氟化嘧啶类抗肿瘤药物. 他以完整形式通过胃肠道, 经过肝脏和肿瘤中三种酶催化的一系列反应转化为5-氟尿嘧啶(5-FU). 首先由肝脏中的羧酸脂酶转化为5'-脱氧-5-氧胞嘧啶(5-DFCR), 然后由胞苷脱氨酶的作用下转化为5'-脱氧-5-氟尿嘧啶(5-DFUR), 最后由肿瘤组织含量较高的胸苷磷酸化酶(thymidine phosphorylase, TP)转化为5-FU, 从而发挥抗肿瘤作用[1]. 而胸苷磷酸化酶与血小板衍化内皮细胞生长因子(platelet-derived endothelial cell growth factor, PD-ECGF)是同一物质, 是促血管生长因子之一, 能够刺激内皮细胞生长和趋化. 有报道证实, TP/PD-ECGF在多种实体瘤中表达增高, 且与肿瘤微血管生长密切相关[2]. 我们应用免疫组织化学方法, 检测希罗达术前化疗组与对照组结直肠癌组织中的TP/PD-ECGF表达和肿瘤微血管密度(microvessel density, MVD), 探讨术前希罗达化疗对结直肠癌组织TP/PD-ECGF表达与血管形成的影响.
2003-08/2004-08我院收治的结直肠癌患者57例. 术前化疗组32例, 结肠癌14例, 直肠癌18例; 男25例, 女7例, 年龄33-67(中位43)岁. 对照组25例, 结肠癌14例, 直肠癌11例; 男20例, 女5例, 年龄36-70(中位45)岁. 两组患者术前均经病理确诊, 术后有病理诊断证实, 其中管状腺癌39例、乳头状腺癌6例、黏液腺癌7例、印戒细胞癌3例、未分化癌2例. 两组年龄、肿瘤分期、分化程度、转移等方面统计学上均具有可比性. 实验组术前口服希罗达1250 mg/m2, 每日2次, 连续1 wk后手术; 对照组术前不进行任何化疗或放疗.
手术切除新鲜标本经40 g/L甲醛固定、石蜡包埋, 常规HE染色法及免疫组织化学SP法标记CD34和TP/PD-ECGF. 采用DAB染色. SP试剂盒、鼠抗人TP/PD-ECGF mAb、鼠抗人CD34 mAb, 均购自北京中山生物试剂公司. TP/PD-ECGF染色后主要定位于细胞质, 呈黄色, 偶有胞核染色. TP/PD-ECGF表达阳性根据细胞染色强度和染色细胞所占面积两者积分来判断. 染色强度积分为: 不染色 = 0; 轻度染色 = 1; 中度染色 = 2; 强染色 = 3. 染色面积分为: 无细胞染色 = 0; <25%细胞染色 = 1; 25%-50%细胞染色 = 2; >50%细胞染色 = 3. 若两种积分之和>2, 则为TP/PD-ECGF表达阳性, ≤2则为表达阴性[3]. CD34+染色后定位于内皮细胞胞质, 呈棕褐色. 先用低倍镜(×40倍)扫视整个切片以寻找高血管密度区即"热点"区, 再转到高倍镜(×200倍)下通过计算机显微图像分析系统在监视器上计数微血管数目. 取3个热点区微血管数量的平均值作为每例的微血管数. 微血管判断不以红细胞的出现来确定是否为血管, 也不以是否出现管腔来计数血管. 凡染成棕黄色、数个内皮细胞或内皮细胞族作为一个血管计数, 凡管腔大于8个红细胞大小、带有肌层的血管均不计数[4].
统计学处理 TP/PD-ECGF表达为计数资料, 采用χ2检验. 微血管密度MVD为计量资料以mean±SD表示, 显著性检验采用t检验, P<0.05为有统计学意义.
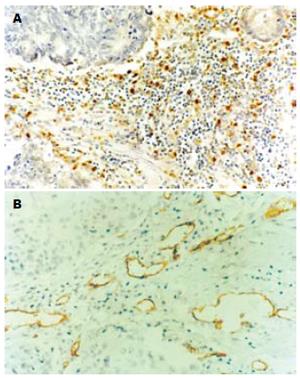
以肿瘤浸润前沿的肿瘤细胞多见而肿瘤中心的细胞团少有阳性表达或呈弱阳性表达(图1A). 术前化疗组TP/PD-ECGF表达阳性率(10/32, 31.2%)较对照组(15/25, 60.0%)明显降低(P<0.05)
结直肠癌组织中微血管内皮细胞均为CD34+染色阳性, 呈棕褐色. 微血管呈圆形或椭圆形, 多见于肿瘤间质(图1B). 术前化疗组 MVD值明显低于对照组, 其差异具显著性(20.7±8.5 vs 42.3±7.8, P<0.05).
氟化嘧啶类抗肿瘤药5-FU作为静脉化疗药临床上得到广泛应用, 但其不良反应限制了对许多患者的使用. 近年来, 氟化嘧啶类药物的研制和临床应用都取得了相当大的成就, 抗肿瘤活性不断提高, 毒副作用逐渐减轻, 特别是氟铁龙、希罗达等具选择特异性的新药的应用, 因其巧妙的结构设计和独特的活化机制, 成功的提高了抗肿瘤的特异性. 尤其是希罗达(卡培他滨, capecitabine)是一种对肿瘤细胞有选择性活性的口服细胞毒制剂. 作为一种肿瘤内激活的口服药物, 希罗达对抗肿瘤选择性高, 特异性强而引起肿瘤化疗界的广泛重视[5]. 希罗达是5-FU的前体物质, 在TP酶作用下才转化为5-FU而发挥抗肿瘤作用. 一般认为癌细胞增殖旺盛, 核酸合成活跃, TP酶的活性高, 故TP酶在肿瘤组织异常增高, 高于正常组织3-10倍[6], 且其活性增高往往预示预后不良[7]. 正由于TP酶具有特异的组织分配特性, 即在肿瘤组织中的活性均高于正常组织, 因此希罗达也在肿瘤组织局部分解活跃, 从而显示出希罗达的选择特异性抗肿瘤作用[8], TP酶与PD-ECGF为同一物质, 而后者有促血管生长作用. 5-FU与胸腺嘧啶结构相似, 故TP/PD-ECGF酶能催化抗嘧啶代谢药5-FU和2-脱氧-核糖-1-磷酸反应生成5'-氟-2'-脱氧尿苷(5'-FduR); 其最终代谢产物使DNA合成障碍. 因2-脱氧-核糖-1-磷酸是TP/PD-ECGF酶降解产物之一, 也有促血管生成作用, 故氟尿嘧啶类化疗药有双重功能: 阻断DNA合成, 消除潜在血管生长因子[9]. 据报道称肿瘤PD-ECGF与肿瘤微血管密度密切相关, 且TP/PD-ECGF可致肿瘤组织微血管密度增加及肿瘤组织凋亡减少[10-11], 因此TP也是重要的肿瘤预后因子之一[12]. 希罗达能够选择性的在肿瘤组织高的TP酶的作用下转化为5-FU, 发挥了双重功效, 既减少TP酶活性, 从而减少肿瘤血管增生, 同时又阻抑肿瘤细胞DNA合成, 也降低了对正常组织的毒性作用, 为肿瘤联合化疗及抗血管增生提供机会.
我们也发现, 术前希罗达化疗后TP表达阳性率31.2%明显低于对照组60.0%, 且其肿瘤组织的MVD值20.7±8.5也低于对照组MVD值42.3±7.8. 说明术前希罗达化疗能降低大肠癌组织的TP活性, 减弱其血管增生作用, 从而减少肿瘤微血管的增生. 我们还发现, 无论实验组或对照组, 其TP阳性组MVD值总高于TP阴性组, 其差异有统计学意义. 表明TP/PD-ECGF与结直肠癌微血管形成密切相关, 是大肠癌血管形成与维持的重要因子. 从免疫组织化学染色图片上, 与Okada et al[13]观察到的一样, 我们也发现, TP/PD-ECGF阳性染色主要见于肿瘤浸润边缘的癌细胞, 而肿瘤中心的癌细胞团少有阳性染色, 而CD34+标记的微血管其分布亦具异质性, 即肿瘤间质尤其肿瘤浸润前缘的微血管较肿瘤内部密集, 肿瘤间质中的巨噬细胞、内皮细胞、淋巴细胞也有阳性染色. 肿瘤微血管主要积聚于肿瘤组织间质. 这进一步说明, 位于肿瘤组织间质的TP/PD-ECGF与肿瘤组织的微血管形成有密切关系. 同时我们发现, 希罗达的毒副作用相对较轻, 主要表现为恶心、腹泻、手足综合征等, 无Ⅲ, Ⅳ度以上不良反应.
已知细胞或生长因子如白介素-1、bFGF和IFN-α能上调PD-ECGF的TP酶活性, 肿瘤微环境的低氧和低pH也有一定影响. 故希罗达可能通过其抗肿瘤毒性而使白介素-1、肿瘤坏死因子等减少或通过改变肿瘤低氧、pH而下调TP活性, 从而抑制肿瘤微血管增生[14]. 总之, 希罗达是一新型的口服氟化嘧啶类抗代谢作用的药物. 其作用于依赖TP酶, 而TP酶又具有独特的具酶活性的促血管生成作用. 故TP酶能增强希罗达的抗肿瘤作用. 希罗达以其独特的结构与活化机制, 使其有别于5-FU而成为有选择性抗肿瘤作用, 提高了肿瘤的活性, 减低了毒副作用, 成功地提高了抗肿瘤特异性. 近年来临床上屡见报道希罗达有效治疗其他化疗药或5-FU化疗失败的结直肠癌或乳腺癌患者[15]. 因此检测TP酶活性可以有效指导化疗. 且希罗达可口服, 依从性好, 副作用少, 对于TP酶高的肿瘤, 尤其是消化道肿瘤应用希罗达有独特疗效, 从抗肿瘤生长及抗血管增生方面是理想的化疗药物.
肿瘤微血管密度与肿瘤的发生、发展及转归关系密切, 术前化疗即新辅助化疗是恶性肿瘤综合治疗手段之一. 希罗达是结直肠癌辅助化疗的一线抗癌药物, 本实验通过术前口服希罗达后肿瘤微血管密度的改变, 从肿瘤血管行为学方面研究希罗达术前化疗对治疗结直肠癌的意义.
目前, capecitabine在临床已得到广泛应用, 对TP和血管生成的影响也有较多研究结果, 因此本文学术价值一般, 可供临床参考.
电编: 张敏 编辑: 潘伯荣
| 1. | Schmoll HJ, Arnold D. Update on capecitabine in colorectal cancer. Oncologist. 2006;11:1003-1009. [PubMed] [DOI] |
| 2. | Jiang LN, Yu SY, Xiong HH, Zhang MX. [Expression of thymidine phosphorylase in cancer]. Zhonghua Zhong Liu Za Zhi. 2004;26:297-299. [PubMed] |
| 3. | Mattern J, Koomägi R, Volm M. Biological characterization of subgroups of squamous cell lung carcinomas. Clin Cancer Res. 1999;5:1459-1463. [PubMed] |
| 4. | Weidner N. Current pathologic methods for measuring intratumoral microvessel density within breast carcinoma and other solid tumors. Breast Cancer Res Treat. 1995;36:169-180. [PubMed] [DOI] |
| 5. | Toi M, Atiqur Rahman M, Bando H, Chow LW. Thymidine phosphorylase (platelet-derived endothelial-cell growth factor) in cancer biology and treatment. Lancet Oncol. 2005;6:158-166. [PubMed] [DOI] |
| 6. | Miwa M, Ura M, Nishida M, Sawada N, Ishikawa T, Mori K, Shimma N, Umeda I, Ishitsuka H. Design of a novel oral fluoropyrimidine carbamate, capecitabine, which generates 5-fluorouracil selectively in tumours by enzymes concentrated in human liver and cancer tissue. Eur J Cancer. 1998;34:1274-1281. [PubMed] [DOI] |
| 8. | Koizumi W, Saigenji K, Nakamaru N, Okayasu I, Kurihara M. Prediction of response to 5'-deoxy-5-fluorouridine (5'-DFUR) in patients with inoperable advanced gastric cancer by immunostaining of thymidine phosphorylase/platelet-derived endothelial cell growth factor. Oncology. 1999;56:215-222. [PubMed] [DOI] |
| 9. | Shuai XM, Han GX, Wang GB, Chen JH. Cyclin D1 antisense oligodexoyneucleotides inhibits growth and enhances chemosensitivity in gastric carcinoma cells. World J Gastroenterol. 2006;12:1766-1769. [PubMed] [DOI] |
| 10. | Osaki M, Sakatani T, Okamoto E, Goto E, Adachi H, Ito H. Thymidine phosphorylase expression results in a decrease in apoptosis and increase in intratumoral microvessel density in human gastric carcinomas. Virchows Arch. 2000;437:31-36. [PubMed] [DOI] |
| 11. | Okamoto E, Osaki M, Kase S, Adachi H, Kaibara N, Ito H. Thymidine phosphorylase expression causes both the increase of intratumoral microvessels and decrease of apoptosis in human esophageal carcinomas. Pathol Int. 2001;51:158-164. [PubMed] [DOI] |
| 12. | Ma T, Zhu ZG, Ji YB, Zhang Y, Yu YY, Liu BY, Yin HR, Lin YZ. Correlation of thymidylate synthase, thymidine phosphorylase and dihydropyrimidine dehydrogenase with sensitivity of gastrointestinal cancer cells to 5-fluorouracil and 5-fluoro-2'-deoxyuridine. World J Gastroenterol. 2004;10:172-176. [PubMed] |
| 13. | Okada K, Yokoyama K, Okihara K, Ukimura O, Kojima M, Miki T, Takamatsu T. Immunohistochemical localization of platelet-derived endothelial cell growth factor expression and its relation to angiogenesis in prostate. Urology. 2001;57:376-381. [PubMed] [DOI] |
| 14. | Tsuneyoshi K, Haraguchi M, Hongye Z, Gotanda T, Tachiwada T, Sumizawa T, Furukawa T, Baba M, Akiyama S, Nakagawa M. Induction of thymidine phosphorylase expression by AZT contributes to enhancement of 5'-DFUR cytotoxicity. Cancer Lett. 2006;244:239-246. [PubMed] [DOI] |
| 15. | Delord JP, Pierga JY, Dieras V, Bertheault-Cvitkovic F, Turpin FL, Lokiec F, Lochon I, Chatelut E, Canal P, Guimbaud R. A phase I clinical and pharmacokinetic study of capecitabine (Xeloda) and irinotecan combination therapy (XELIRI) in patients with metastatic gastrointestinal tumours. Br J Cancer. 2005;92:820-826. [PubMed] [DOI] |