修回日期: 2006-01-20
接受日期: 2006-01-24
在线出版日期: 2006-03-28
目的: 观察HBeAg和HBsAg对人肝癌细胞系HepG2细胞中血管紧张素转化酶(ACE)分泌的影响.
方法: 利用本所既往构建的表达乙肝病毒(HBV)表面抗原和E抗原的真核表达载体pcDNA3.1(-)-HBsAg、pcDNA3.1(-)-HBeAg及空载体pcDNA3.1(-)转染HepG2细胞, 观察转染24, 48 h后细胞上清中ACE活性和炎性细胞因子IL-6、IL-8的变化. 培养细胞上清液内ACE活性采用底物裂解法检测; IL-6、IL-8浓度采用流式细胞仪检测.
结果: 转染48 h的HepG2细胞裂解液中检测到了HBsAg和HBeAg的表达, 但二者细胞上清中的ACE与转染空载体对照pcDNA3.1(-)细胞上清中的ACE无显著差异; 同样, 炎性因子IL-6和IL-8也没有显著差异.
结论: HBV HBsAg和HBeAg对ACE活性、IL-6和IL-8不具有显著的上调或下调作用; HBsAg和HBeAg在肝纤维化发生过程中的作用机制尚待进一步阐明.
引文著录: 刘志英, 黄玉波, 魏红山, 宋淑静, 冯鑫, 刘亚楠, 成军. 表达HBeAg和HBsAg对HepG2细胞系细胞因子分泌及ACE活性的影响. 世界华人消化杂志 2006; 14(9): 904-907
Revised: January 20, 2006
Accepted: January 24, 2006
Published online: March 28, 2006
AIM: To evaluate the effects of hepatitis B virus surface and e antigens (HBeAg and HBsAg) on the activity of angiotensin-converting enzyme (ACE) and cytokines excretion in hepatocellular carcinoma cell line HepG2.
METHODS: The eukaryotic expression plasmids, including pcDNA3.1(-)-HBsAg, pcDNA3.1(-)-HBeAg, and empty plasmid pcDNA3.1(-), were transfected into HepG2 cells, and the levels of cytokines, such as IL-6 and IL-8, and the activity of ACE were determined in the supernatants 48 h after transfection by flow cytometry and biochemical methods, respectively.
RESULTS: The expression of HBeAg and HBsAg were detected in the supernatants, but there was no significant difference of ACE activity between the cells tranfected with pcDNA3.1(-)-HBsAg, pcDNA3.1(-)-HBeAg, and empty plasmid pcDNA3.1(-). The levels of IL-6 and IL-8 in the supernatants had no significant differences between the cells transfected with pcDNA3.1(-)-HBsAg, pcDNA3.1(-)-HBeAg and the control cells.
CONCLUSION: HBeAg and HBsAg has no significant effects on ACE activity and IL-6, IL-8 secretion in HepG2 cells.
- Citation: Liu ZY, Huang YB, Wei HS, Song SJ, Feng X, Liu YN, Cheng J. Effects of HBeAg and HBsAg on cytokine excretion and angiotensin-converting enzyme activity in HepG2 cell line. Shijie Huaren Xiaohua Zazhi 2006; 14(9): 904-907
- URL: https://www.wjgnet.com/1009-3079/full/v14/i9/904.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i9.904
近期我们研究结果显示, 肝组织局部肾素血管紧张素系统(RAS)的激活与肝纤维化的发生有关, 并证实激活的肝星状细胞表达血管紧张素1型受体[1-2]. 该观点随后也被国外研究所证实[3-4]. 但在慢性乙型肝炎肝纤维化发生过程中, 乙型肝炎病毒(HBV)抗原与肝组织局部RAS活性之间的关系尚不明确. 本研究旨在探讨HBV某些抗原对RAS中关键成分, 血管紧张素转化酶的表达活性、某些炎性细胞因子表达水平的影响, 以期明确慢性乙型肝炎肝纤维化发生与RAS活性之间可能的关系.
绿色荧光蛋白表达质粒pEGFP、E抗原表达质粒P-HBeAg、表面抗原表达质粒P-HBsAg、pcDNA3.1(-)真核表达载体、感受态JM109和HepG2细胞由本室保存, 限制性内切酶KpnⅠ和NheⅠ购自欣经科生物公司, GeneJammer多胺转染试剂购自Stratagene公司, 磁珠法质粒提取试剂盒购自Promega公司, 血管紧张素转化酶(ACE)检测试剂盒购自九强公司, 炎性细胞因子测定试剂盒购自美国BD公司.
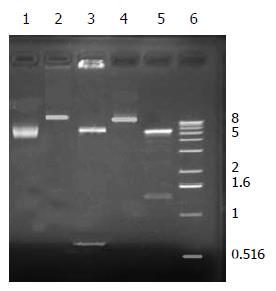
1.2.1 重组质粒的提取、测序和酶切鉴定: 按试剂盒说明书进行质粒的中量提取, 设计针对pcDNA3.1(-)载体多克隆位点插入片段上下游引物序列: 上游: 5' GAG AAC CCA CTG CTT ACT GGC 3', 下游: 5' AAC TAG AAG GCA CAG TCG AGG 3', 对提取质粒进行序列测定, 并用KpnⅠ和NheⅠ对重组质粒进行双酶切鉴定.
1.2.2 细胞培养: HepG2细胞生长于含100 mL/L胎牛血清(Hyclone)的1640培养基中. 于转染前24 h消化, 接种于6孔培养板中, 调节细胞浓度至2×105细胞/孔.
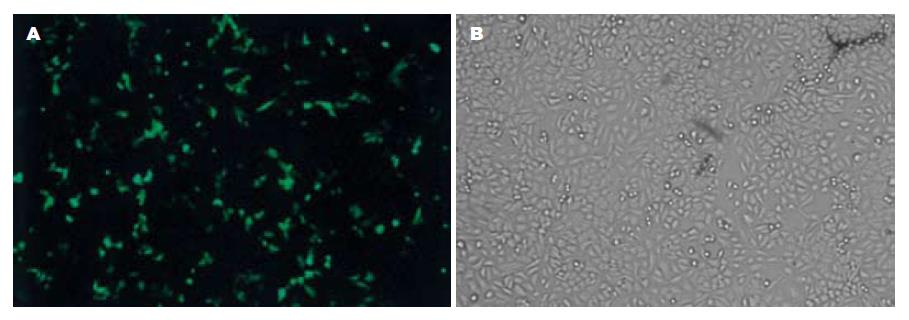
1.2.3 细胞转染: 将表达载体pcDNA3.1(-)-HBeAg, pcDNA3.1(-)-HBsAg按GeneJammer转染试剂说明书转染入HepG2细胞, 按1 µg DNA/3 µL转染试剂/孔的量进行转染; 设pcDNA3.1(-)空载体对照和正常细胞对照, 另外设立转染效率对照pEGFP. 分别于转染24, 48 h后收集转染细胞上清液, 测定上述细胞内ACE和炎性细胞因子IL-6和IL-8在上清的分泌情况; 在转染48 h消化收集转染后的细胞, 用化学发光法检测细胞裂解液中HBeAg和HBsAg的表达. 并在荧光显微镜下观察绿色荧光蛋白表达情况, 计算转染效率.
1.2.4 ACE和细胞因子的测定: ACE测定用购自九强生物公司的试剂盒, 在大型自动生化分析仪(型号: HITACHI7180)进行.
1.2.5 炎性细胞因子(IL-6、IL-8)测定: BD CBA试剂盒购自美国BD公司, 用流式细胞仪进行测定.
统计学处理 计量资料以mean±SD表示, 组间差异采用ANOVA分析. 统计软件使用Office 2000 EXCEL.
重组质粒pcDNA3.1(-) -HBeAg和pcDNA3.1(-)-HBsAg经NheⅠ+KpnⅠ双酶切鉴定可见639 bp的HBeAg和1.2 kb的HBsAg片段(图1). 序列测定结果表明重组质粒构建正确.
pEGFP转染HepG2细胞结果显示, pEGFP转染成功且转染率达到30%-40%. 化学发光法检测转染pcDNA3.1(-)-HBeAg和pcDNA3.1(-)-HBsAg表达载体的细胞培养上清液和细胞裂解液, 结果表明转染48 h后细胞裂解液中HBeAg和HBsAg检测阳性, pcDNA3.1(-)-HBeAg和pcDNA3.1(-)-HBsAg转染成功, 并且在HepG2细胞内得到了有效的表达(图2). 但二者在细胞培养液上清中检测结果均为阴性.
转染pcDNA3.1(-) -HBeAg, pcDNA3.1(-)-HBsAg后24, 48 h后HepG2细胞上清液与同期转染空载体对照的pcDNA3.1(-)的细胞上清液分泌的ACE比较无统计学差异, 同时细胞上清分泌的炎性细胞因子IL-6和IL-8也无显著的差异(表1).
| 组别 | n | ACE (活性单位) | IL-6 (ng/L) | IL-8 (ng/L) | |||
| 24 h | 48 h | 24 h | 48 h | 24 h | 48 h | ||
| pcDNA3.1(-)-HBeAg | 4 | 2.89±1.98 | 2.51±1.59 | 414.62±98.98 | 369.77±37.43 | 24.32±18.32 | 77.84±57.57 |
| pcDNA3.1(-)-HBsAg | 4 | 4.47±0.87 | 3.07±2.04 | 394.97±47.75 | 402.58±37.54 | 21.25±11.94 | 126.01±63.47 |
| pcDNA3.1(-) | 4 | 2.54±1.18 | 3.78±2.33 | 368.11±68.97 | 295.37±78.93 | 21.25±11.94 | 98.00±47.01 |
早期, 我们的研究曾经揭示, 肝组织局部RAS的激活与肝纤维化发生有关, 血管紧张素转化酶抑制剂和血管紧张素Ⅱ受体阻断剂可以延缓肝纤维化的发生[5]. 肝纤维化是肝硬化发生的必然过程, 但乙型肝炎病毒表达蛋白与肝纤维化之间的关系仍然未明确, 一个临床上显而易见的事实是某些慢性HBV携带的患者, 尽管没有显著的慢性肝损伤病史却同样可以导致肝硬化的发生. 究竟是什么因素导致了慢性HBV感染后肝纤维化的发生? 我们试图明确HBV编码蛋白是否可以通过组织局部RAS激活, 即是否通过非炎症机制促进了肝纤维化的发生.
Bruns et al[6]研究结果显示, HBV非感染性亚病毒颗粒对肝细胞HBV具有自身增强作用. 表达HBV表面大蛋白(large surface protein of hepatitis B virus, LHBs)可以导致肝细胞毛玻璃样变, 提示HBV编码蛋白可能通过非炎症机制导致肝细胞的直接损伤[7]. 利用构建的HBeAg和HBsAg表达质粒, 转染HepG2细胞系的研究结果显示, 转染HBeAg和HBsAg表达质粒后, 培养HepG2细胞上清液内血管紧张素转化酶活性并未见增加, 提示HBeAg和HBsAg可能不是肝组织局部RAS活性的直接调控因子, 但LHBs对ACE的活性影响我们正在观察过程中. 但不能排除的一个因素是体外培养的HepG2细胞系可能本身即不表达ACE活性. 另外, 本研究中转染后细胞培养上清中HBeAg和HBsAg两种蛋白检测为阴性结果, 可能与载体pcDNA3.1(-)不具有分泌活性有关.
IL-6是一个与肝细胞分泌密切相关的细胞因子, 并具有肝细胞自身保护作用, IL-6基因缺陷小鼠对乙醇诱导的肝细胞损伤更为敏感[8]. 体内研究还揭示, 高表达IL-6显著降低暴发性肝衰竭的发生率[9]. IL-8是一个肝细胞和肝星状细胞表达的炎性趋化因子, 高表达IL-8可加剧镉诱导的肝细胞损伤[10-11]. 为了进一步明确HBeAg和HBsAg对培养肝细胞系的可能间接影响, 我们对转染后的HepG2培养上清液内的IL-6、IL-8表达水平也进行了检测. 如表1所示, 转染HBeAg后IL-6有所降低, IL-8有所升高, 而HBsAg似乎也有类似影响, 但与转染空质粒相比无显著性差异.
基于现有的研究资料, HBV表达的蛋白中只有LHBs对肝细胞有直接毒性作用的客观证据[7], 但因LHBs具有很强的细胞内滞留性, 质粒构建和表达相对困难[12], 相应的研究我们目前正在进行中.
近期研究显示, 肝组织局部肾素血管紧张素系统(RAS)的激活与肝纤维化的发生有关, 并证实激活的肝星状细胞表达血管紧张素1型受体. 但在慢性乙型肝炎肝纤维化发生过程中, 乙型肝炎病毒(HBV)抗原与肝组织局部RAS活性之间的关系尚不明确.
利用构建的HBeAg和HBsAg表达质粒, 转染HepG2细胞系的研究结果显示, 转染HBeAg和HBsAg表达质粒后, 培养HepG2细胞上清液内血管紧张素转化酶活性并未见增加, 提示HBeAg和HBsAg可能不是肝组织局部RAS活性的直接调控因子.
电编: 张敏 编辑:王瑾晖
| 1. | Wei HS, Lu HM, Li DG, Zhan YT, Wang ZR, Huang X. The expression of AT1 receptor on hepatic stellate cells in rat fibrosis induced by CCl4. Chin Med J. 2001;114:583-587. [PubMed] [DOI] |
| 3. | Paizis G, Tikellis C, Cooper ME, Schembri JM, Lew RA, Smith AI, Shaw T, Warner FJ, Zuilli A, Burrell LM. Chronic liver injury in rats and humans upregulates the novel enzyme angiotensin converting enzyme 2. Gut. 2005;54:1790-1796. [PubMed] [DOI] |
| 4. | Bataller R, Sancho-Bru P, Gines P, Lora JM, Al-Garawi A, Sole M, Colmenero J, Nicolas JM, Jimenez W, Weich N. Activated human hepatic stellate cells express the renin-angiotensin system and synthesize angiotensin II. Gastroenterology. 2003;125:117-125. [PubMed] [DOI] |
| 6. | Bruns M, Miska S, Chassot S, Will H. Enhancement of hepatitis B virus infection by noninfectious sub-viral particles. J Virol. 1998;72:1462-1468. [PubMed] |
| 7. | Foo NC, Ahn BY, Ma X, Hyun W, Yen TS. Cellular vacuolization and apoptosis induced by hepatitis B virus large surface protein. Hepatology. 2002;36:1400-1407. [PubMed] [DOI] |
| 8. | El-Assal O, Hong F, Kim WH, Radaeva S, Gao B. IL-6-deficient mice are susceptible to ethanol-induced hepatic steatosis: IL-6 protects against ethanol-induced oxidative stress and mitochondrial permea-bility transition in the liver. Cell Mol Immunol. 2004;1:205-211. [PubMed] |
| 9. | Hecht N, Pappo O, Shouval D, Rose-John S, Galun E, Axelrod JH. Hyper-IL-6 gene therapy reverses fulminant hepatic failure. Mol Ther. 2001;3:683-687. [PubMed] [DOI] |
| 10. | Gutierrez-Ruiz MC, Bucio L, Correa A, Souza V, Hernandez E, Gomez-Quiroz LE, Kershenobich D. Metadoxine prevents damage produced by ethanol and acetaldehyde in hepatocyte and hepatic stellate cells in culture. Pharmacol Res. 2001;44:431-436. [PubMed] [DOI] |
| 11. | Horiguchi H, Harada A, Oguma E, Sato M, Homma Y, Kayama F, Fukushima M, Matsushima K. Cadmi-um-induced acute hepatic injury is exacerbated in human interleukin-8 transgenic mice. Toxicol Appl Pharmacol. 2000;163:231-239. [PubMed] [DOI] |