修回日期: 2006-01-15
接受日期: 2006-02-25
在线出版日期: 2006-03-18
目的: 研究siRNA对生长抑素(SOM)基因表达的抑制作用.
方法: 根据生长抑素基因序列设计和合成RNA干扰的靶序列, 应用RiboMAXT7体外转录试剂盒合成siRNA并转染胃癌细胞系SGC-7901, 经RT-PCR, 免疫组化法检测生长抑素在mRNA和蛋白质水平的抑制效应.
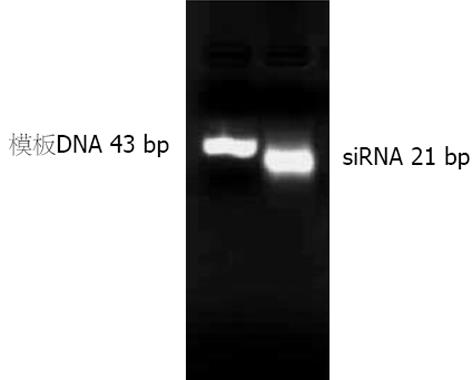
结果: 成功合成了siRNA(21 bp). 胃癌细胞系SGC-7901中SOM基因的表达呈强阳性, 分布在胞质中, siRNA作用48 h后SOM基因的表达明显抑制, 与空转染和空白对照组相比有显著性差异(49.71%±0.056% vs 10.49%±0.021%, 0%, P<0.01).
结论: siRNA可特异性抑制生长抑素基因的表达.
引文著录: 朱晓燕, 岳保红, 张钦宪. siRNA对生长抑素基因表达的抑制作用. 世界华人消化杂志 2006; 14(8): 784-788
Revised: January 15, 2006
Accepted: February 25, 2006
Published online: March 18, 2006
AIM: To research inhibitory effects of small interfering RNA (siRNA) on the expression of somatostatin gene.
METHODS: According to the gene sequence of somatostatin in GenBank, we designed the siRNA-targeted templates and synthesized siRNA using T7 RiboMAX Express RNAi System in vitro. The obtained siRNA was then transfected into gastric cancer cell line SGC-7901. Reverse transcription polymerase chain reaction (RT-PCR) and immunohistochemical techniques were used to detect the expression of somatostatin at both mRNA and protein levels.
RESULTS: The target siRNA with a length of 21 bp was successfully synthesized. Before transfection, somatostatin was strongly and positively expressed in gastric cancer cell line SGC-7901, locating at the cytoplasm. Forty-eight hours after transfection , somatostatin expression was markedly inhibited and the inhibitory rate in siRNA-transfected cells was significantly higher than that in the cells transfected with empty vector and non-transfected cells (49.71% ± 0.056% vs 10.49% ± 0.021%, 0%, both P < 0.01).
CONCLUSION: siRNA can inhibit the expression of somatostatin specifically.
- Citation: Zhu XY, Yue BH, Zhang QX. Inhibitory effects of small interfering RNA on expression of somatostatin gener. Shijie Huaren Xiaohua Zazhi 2006; 14(8): 784-788
- URL: https://www.wjgnet.com/1009-3079/full/v14/i8/784.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i8.784
RNA干扰(RNA interference, RNAi)是双链RNA(dsRNA)介导的序列特异性转录后同源靶基因沉默效应[1]. 由于小干扰RNA(small interfering RNA, siRNA)在哺乳动物细胞中可以诱导RNAi效应, 他已经成为基因功能研究的重要工具[2]. 胃癌的发病机制十分复杂, 其病因目前尚未阐明, 胃肠激素在胃癌发生、发展的过程中所起的作用正日益受到关注[3-4]. 我们设计并体外合成了siRNA, 通过转染胃癌细胞系SGC-7901, 研究其干扰生长抑素(somatostatin, SOM)基因表达的效应, 为筛选抑制SOM基因表达的有效序列, 进一步研究其功能奠定了基础.
胃癌细胞系SGC-7901, 由本教研室保存; 胎牛血清和胰蛋白酶购自TaKaRa; T7RiboMAXTM Express RNAi System购自Promega公司; CodeBreakerTM siRNA Transfection Reagent购自Promega公司; Trizol Reagent RNA提取试剂盒购自Invitrogen; RT-PCR两步法试剂盒购自上海生物工程公司; PUC19DNA Marker购自上海生物工程公司.
在GenBank中取得SOM基因全长cDNA序列, 用Sira mode of Sfdd软件(http://sfdd.ward worch.org/sirna.pl)进行siRNA的设计及RNA二级结构的预测. SOM基因全长cDNA共633个碱基, 根据分析结果选择162-180 bp为靶序列, gcaggaactggccaagtac. 依据所设计的靶向siRNA序列, 根据试剂盒的要求设计siRNA模板寡核苷酸, 由上海生物工程公司合成, 序列为: Primer1: 5'-GGATCCTAATACGACTCACTATAGCAGGAACTGGCCAAGTAC-3'; Primer2: 5'-AAGTACTTGGCCAGTTCCTGCTATAGTGAGTCGTATTAGGATCC-3'; Primer3: 5'-GGATCCTAATACGACTCACTATA GTACTTGGCCAGTTCCTGC-3'; Primer4: 5'-AAGCAGGAACTGGCCAAGTACTATAGTGAGTCGTATTAGGATCC-3'. 根据GenBank上发表的看家基因β-actin的序列, 利用Primer premier5.0软件设计了β-actin的序列, 上游引物: 5'-TTCTGACCCATGCCCACCAT-3'(sense); 下游引物: 5'-ATGGATGATGATATCGCCGCGCTC-3'(antisense), 扩增长度为198 bp. 根据GenBank上发表的SOM基因的序列(accession No. BC032625)利用Primer premier5.0软件设计了RT-PCR的序列, 上游引物: 5'-GATGCTGTCCTGCCGCCTCCAG-3'(sense); 下游引物: 5'-acaggatgtgaaagtcttcca-3'(antisense), 356 bp. 用T7RiboMAXTM Express RNAi System试剂, 按照试剂盒说明书以合成的寡核苷酸为模板, 体外合成siRNA. 37℃, 50 mL/L CO2, 100 mL/L胎牛血清常规培养胃癌细胞系SGC-7901, CodeBreakerTM siRNA Transfection Reagent转染SGC-7901. 转染前6孔板接种3孔, 24孔板接种3孔, 分别设空白细胞对照组, 空转染试剂对照组和转染实验组, 待细胞长到50%-70%, 进行转染. 24孔板转染时, 准备2个500 μL离心管, 每管加入2 μL转染试剂与125 μL无血清培养基充分涡旋混合, 室温孵育20 min, 空转染对照组不加siRNA, 实验组加入双链siRNA 0.1 μL到稀释的转染试剂, 使siRNA转染浓度达到10 nmol/L, 轻轻用手指弹匀, 室温孵育20 min, 分别加入6孔板中的两个孔中, 加100 mL/L胎牛血清培养基2.5 mL, 37℃, 50 mL/L CO2, 培养48 h后收集细胞. 6孔板转染时, 准备两个1.5 mL离心管, 每管加入10 μL转染试剂与625 μL无血清培养基充分涡旋混合, 室温孵育20 min, 空转染对照组不加siRNA, 实验组加入双链siRNA 0.5 μL到稀释的转染试剂, 使siRNA转染浓度达到10 nmol/L, 轻轻用手指弹匀, 室温孵育20 min, 加入6孔板中的2个孔中, 加100 mL/L胎牛血清培养基2.5 mL, 37℃, 50 mL/L CO2, 培养48 h后收集细胞.
1.2.1 免疫组化检测抑制效应: 转染后48 h, 收集24孔板培养的三组细胞, 做细胞涂片, 40 g/L多聚甲醛固定, 按照试剂盒要求做免疫组化.
1.2.2 RT-PCR检测抑制效应: 转染后48 h, 收集6孔板培养的三组细胞, 每孔加1 mL Trizol试剂, 按试剂盒操作说明, 分别提取总RNA, 电泳鉴定, 按照RT-PCR试剂盒两步法说明书操作, 分别用SOM基因和β-actin基因引物, 进行RT-PCR.
统计学处理 应用SPSS 10.0统计软件对数据进行统计学处理, 对计数资料采用χ2检验, 对计量资料, 统计学数据用均数±标准差(mean±SD)表示. 以α = 0.05为检验水准.
根据设计的siRNA模板寡核苷酸, 成功合成了siRNA(图1).
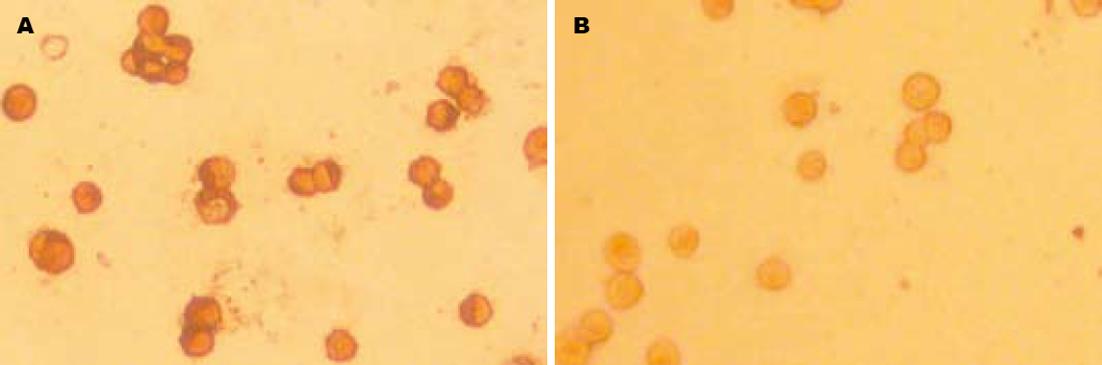
胃癌细胞系SGC-7901中SOM基因的表达呈强阳性, 分布在胞质中(图2A) . siRNA作用胃癌细胞系48 h后SOM基因的表达明显被抑制(图2B). 镜下观察标本, 并同时做半定量计数分析. 每个标本随机观测十个视野(40×10), 记录强阳性(细胞内含大量粗大棕黄色颗粒, 计3分), 阳性(细胞内有较多的棕黄色着色颗粒, 计2分)及弱阳性(细胞内可见散在的棕黄色颗粒, 计1分)细胞平均积分值. 抑制率(mean±SD)% = (1-实验组阳性细胞平均积分值/对照组阳性细胞平均积分值)×100%(表1).
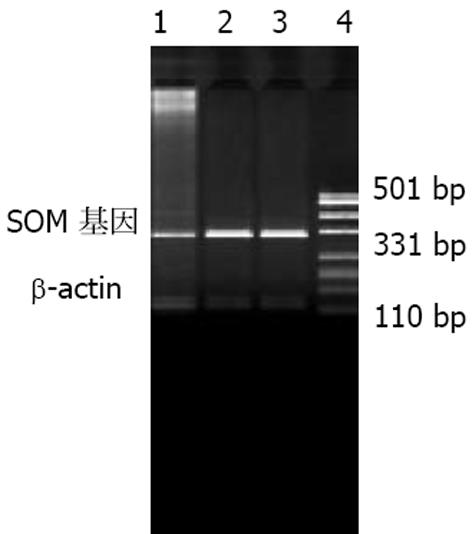
取RT-PCR产物5 μL, 15 g/L琼脂糖凝胶电泳, 结果(图3)可以看出两组样品在198 bp处均可见到β-actin, 转染组在356 bp处条带较弱, 说明SOM基因表达受到抑制, 而正常对照组在356 bp处条带较亮, 说明扩增出了靶基因.
肿瘤是多基因、多因素疾病, 是多个基因相互作用的基因网络调控的结果, 胃肠激素在胃癌发生、发展的过程中起着重要作用[5,6]. 生长抑素(somatostatin, SOM)是1973年Brazeau et al[7]从羊下丘脑中分离并提纯的, 此后的研究证实生长抑素不仅存在于下丘脑, 而且广泛分布于脑、胰、肠道神经细胞, 对机体几乎所有的生理性内分泌反应均起抑制作用[8,9]. 大部分研究表明, SOM对正常细胞和肿瘤的生长增殖具有抑制作用[10-13], 但Koper et al[14]发现, SOM或其激动剂对体外培养的人脑膜瘤细胞没有抑制作用, 反而具有刺激作用. Savage et al[15]和Tatsuta et al[16]对SOM和SOM的类似物SMS201-995在肿瘤发生中的作用进行研究发现, SOM对十二指肠肿瘤和胃癌非但没有抑制作用, 反而促进其肿瘤发生. 生长抑素通过与膜上生长抑素受体(SSTR)结合起作用[17]. SSTR是一种膜蛋白受体, 属G蛋白偶联受体家族, 共有5个亚型, 即SSTR1-SSTR5, SSTR各亚型由于序列的不同而导致与配体结合的亲和力不同[18]. SSTR分布广泛, 包括内分泌细胞与淋巴细胞在内的许多正常细胞及肿瘤细胞等都能表达SSTR. SSTR具有识别不同化学信使的能力, 并能通过一些直接或间接的偶联系统启动生物反应, 但具体的信号传导途径不详[19]. 尽管大量文献报道SOM抗肿瘤作用机制, 但看法不尽一致. Lahlou et al[20]认为通过Ras-, Rap1-, 和 B-Raf-ERK2激活有丝分裂原激活的蛋白激酶(MAPK)抑制细胞的增殖. Liang et al[21], Charland et al[22]报道SOM可以抑制肿瘤细胞Akt磷酸化和细胞周期启动. Hu et al[10]研究发现SOM类似物可诱导瘤细胞凋亡, 同时伴随着肿瘤内增高的去磷酸化状态, SOM类似物已应用于神经内分泌肿瘤的治疗[23]. Mentlein et al[24]在神经胶质瘤细胞中发现SOM通过抑制血管内皮生长因子抑制肿瘤生长. 对该基因进行功能研究是了解肿瘤发生、发展过程的重要策略, 不仅可以探究造成基因表型差异的遗传原因或外界原因, 而且对肿瘤的诊断和治疗具有重要的意义.
一般认为, 目前对基因功能的研究最有效的方法有两种: 一是观察该基因突变的表型改变, 这类改变可通过同源重组的方式直接诱导产生, 也可经研究某随机突变生物体中该基因损害而得到认识; 另一种是利用反义核酸技术特异性抑制该基因的表达, 从而研究该基因的功能, 但反义技术存在特异性不强、效率不高等缺点[25-26], 自1998年以来, RNA干扰(RNA interference, RNAi)技术已成功应用于线虫、果蝇、斑马鱼、真菌、植物以及哺乳动物等生物的基因功能研究, 并且应用范围不断拓宽, 他的出现为基因功能研究提供了一种新的具有高效性和高度特异性的功能基因组研究策略[27-28]. siRNA作用靶序列的选择是RNA干扰的关键, 选择靶序列应遵循下列原则[29-31]: (1)选择GC含量在35%-50%之间的mRNA区域; (2)避免选择启动子起始部位下游50-100 nt内的区域或终止子上游50-100 nt内的区域; (3)避免超过3个G或3个C重叠. 多聚G或多聚C序列能产生堆积, 形成类聚物而干扰siRNA沉默机制; (4)选择以2个AA开始的序列, 这将使合成siRNA更加容易、更加经济和创建一个对核酸酶更有抵抗力的siRNA; (5)保证靶序列与其他基因没有同源性. 通过BLAST查询是否具有同源性, 以避免产生同一序列的基因干扰. 本实验设计并合成的siRNA能有效抑制SOM基因的表达, 为进一步研究SOM基因在胃癌发生、发展中的作用机制奠定了基础.
胃癌的发病机制十分复杂, 其病因目前尚未阐明, 胃肠激素在胃癌发生、发展的过程中所起的作用正日益受到关注. 在哺乳动物细胞中可以诱导RNAi效应, 他已经成为基因功能研究的重要工具. 本研究设计并体外合成了siRNA, 通过转染胃癌细胞系SGC-7901, 研究其干扰生长抑素基因表达的效应.
目前应用RNA干扰技术来研究基因的功能成为该领域的热点. 生长抑素通过与受体结合, 启动生物反应, 但其具体的信号传导途径不详, 故成为研究的重点.
以往利用反义核酸技术特异性抑制该基因的表达, 从而研究该基因的功能, 存在特异性不强、效率不高等缺点, 本实验采用RNAi技术特异性抑制生长抑素基因的表达, 为进一步研究生长抑素基因在胃癌发生、发展中的作用奠定了基础.
本实验体外合成了siRNA, 可在mRNA和蛋白质水平抑制胃癌细胞系SGC-7901生长抑素基因的表达, 为阐明生长抑素基因在胃癌发生、发展中的作用奠定了基础.
立题有一定的科学性, SOM对胃癌细胞作用如何还未定论, 因此siRNA抑制SOM基因的表达具有意义.
电编: 张敏 编辑:潘伯荣
| 1. | Heidersbach A, Gaspar-Maia A, McManus MT, Ramalho-Santos M. RNA interference in embryonic stem cells and the prospects for future therapies. Gene Ther. 2006;13:478-486. [PubMed] [DOI] |
| 2. | Omarov R, Sparks K, Smith L, Zindovic J, Scholthof HB. Biological relevance of a stable biochemical in-teraction between the tombusvirus-encoded P19 and short interfering RNAs. J Virol. 2006;80:3000-3008. [PubMed] [DOI] |
| 3. | Schubert ML. Gastric secretion. Curr Opin Gastro-enterol. 2005;21:636-643. [PubMed] [DOI] |
| 4. | Tack J, Depoortere I, Bisschops R, Delporte C, Coulie B, Meulemans A, Janssens J, Peeters T. Influence of ghrelin on interdigestive gastrointes-tinal motility in humans. Gut. 2006;55:327-333. [PubMed] [DOI] |
| 5. | Lindblad M, Garcia Rodriguez LA, Chandanos E, Lagergren J. Hormone replacement therapy and risks of oesophageal and gastric adenocarcinomas. Br J Cancer. 2006;94:136-141. [PubMed] [DOI] |
| 6. | Gower WR Jr, Premaratne S, McCuen RW, Arimura A, McAfee Q, Schubert ML. Gastric atrial natriuretic peptide regulates endocrine secretion in antrum and fundus of human and rat stomach. Am J Physiol Gastrointest Liver Physiol. 2003;284:G638-G645. [PubMed] [DOI] |
| 7. | Brazeau P, Vale W, Burgus R, Ling N, Butcher M, Rivier J, Guillemin R. Hypothalamic polypeptide that inhibits the secretion of immunoreactive pitui-tary growth hormone. Science. 1973;179:77-79. [PubMed] [DOI] |
| 8. | Kao JY, Pierzchala A, Rathinavelu S, Zavros Y, Tessier A, Merchant JL. Somatostatin inhibits den-dritic cell responsiveness to Helicobacter pylori. Regul Pept. 2006;134:23-29. [PubMed] [DOI] |
| 9. | Hirsch AB, McCuen RW, Arimura A, Schubert ML. Adrenomedullin stimulates somatostatin and thus inhibits histamine and acid secretion in the fundus of the stomach. Regul Pept. 2003;110:189-195. [PubMed] [DOI] |
| 10. | Hu C, Yi C, Hao Z, Cao S, Li H, Shao X, Zhang J, Qiao T, Fan D. The effect of somatostatin and SSTR3 on proliferation and apoptosis of gastric cancer cells. Cancer Biol Ther. 2004;3:726-730. [PubMed] [DOI] |
| 11. | Delaunoit T, Rubin J, Neczyporenko F, Erlichman C, Hobday TJ. Somatostatin analogues in the treatment of gastroenteropancreatic neuroendocrine tumors. Mayo Clin Proc. 2005;80:502-506. [PubMed] [DOI] |
| 12. | Zavros Y, Kao JY, Merchant JL. Inflammation and cancer III. Somatostatin and the innate immune system. Am J Physiol Gastrointest Liver Physiol. 2004;286:G698-G701. [PubMed] [DOI] |
| 13. | Cascinu S, Del Ferro E, Catalano G. A randomised trial of octreotide vs best supportive care only in advanced gastrointestinal cancer patients refractory to chemotherapy. Br J Cancer. 1995;71:97-101. [PubMed] [DOI] |
| 14. | Koper JW, Markstein R, Kohler C, Kwekkeboom DJ, Avezaat CJ, Lamberts SW, Reubi JC. Somatostatin inhibits the activity of adenylate cyclase in cultured human meningioma cells and stimulates their growth. J Clin Endocrinol Metab. 1992;74:543-547. [PubMed] |
| 15. | Savage AP, Matthews JL, Adrian TE, Ghatei MA, Cooke T, Bloom SR. Effect of a long-acting analogue of somatostatin, SMS 201-995, on the development of intestinal tumours in azoxymethane-treated rats. Carcinogenesis. 1987;8:561-563. [PubMed] [DOI] |
| 16. | Tatsuta M, Iishi H, Baba M, Taniguchi H. Enhan-cement by somatostatin of experimental gastric carcinogenesis induced by N-methyl-N'-nitro-N-nitrosoguanidine in Wistar rats. Cancer Res. 1989;49:5534-5536. [PubMed] |
| 17. | Kolby L, Wangberg B, Ahlman H, Jansson S, Forssell-Aronsson E, Erickson JD, Nilsson O. Gastric carcinoid with histamine production, histamine transporter and expression of somatostatin recep-tors. Digestion. 1998;59:160-166. [PubMed] [DOI] |
| 18. | Smith WH, Nair RU, Adamson D, Kearney MT, Ball SG, Balmforth AJ. Somatostatin receptor subtype expression in the human heart: differential expression by myocytes and fibroblasts. J Endocrinol. 2005;187:379-386. [PubMed] [DOI] |
| 19. | Volante M, Bozzalla-Cassione F, Papotti M. Somato-statin receptors and their interest in diagnostic pathology. Endocr Pathol. 2004;15:275-291. [PubMed] [DOI] |
| 20. | Lahlou H, Saint-Laurent N, Esteve JP, Eychene A, Pradayrol L, Pyronnet S, Susini C. sst2 Somatostatin receptor inhibits cell proliferation through Ras-, Rap1-, and B-Raf-dependent ERK2 activation. J Biol Chem. 2003;278:39356-39371. [PubMed] [DOI] |
| 21. | Liang J, Slingerland JM. Multiple roles of the PI3K/PKB (Akt) pathway in cell cycle progression. Cell Cycle. 2003;2:339-345. [PubMed] [DOI] |
| 22. | Charland S, Boucher MJ, Houde M, Rivard N. Somatostatin inhibits Akt phosphorylation and cell cycle entry, but not p42/p44 mitogen-activated protein (MAP) kinase activation in normal and tumoral pancreatic acinar cells. Endocrinology. 2001;142:121-128. [PubMed] [DOI] |
| 23. | Kaltsas GA, Papadogias D, Makras P, Grossman AB. Treatment of advanced neuroendocrine tumo-urs with radiolabelled somatostatin analogues. Endocr Relat Cancer. 2005;12:683-699. [PubMed] [DOI] |
| 24. | Mentlein R, Eichler O, Forstreuter F, Held-Feindt J. Somatostatin inhibits the production of vascular endothelial growth factor in human glioma cells. Int J Cancer. 2001;92:545-550. [PubMed] [DOI] |
| 25. | Thaler S, Rejdak R, Dietrich K, Ladewig T, Okuno E, Kocki T, Turski WA, Junemann A, Zrenner E, Schuettauf F. A selective method for transfection of retinal ganglion cells by retrograde transfer of antisense oligonucleotides against kynurenine aminotransferase II. Mol Vis. 2006;12:100-107. [PubMed] |
| 26. | Maksimenko A, Polard V, Villemeur M, Elhamess H, Couvreur P, Bertrand JR, Aboubakar M, Gottikh M, Malvy C. In Vivo Potentialities of ews-fli-1 targeted antisense oligonucleotides-nanospheres complexes. Ann N Y Acad Sci. 2005;1058:52-61. [PubMed] [DOI] |
| 27. | Harborth J, Elbashir SM, Vandenburgh K, Man-ninga H, Scaringe SA, Weber K, Tuschl T. Sequence, chemical, and structural variation of small inter-fering RNAs and short hairpin RNAs and the effect on mammalian gene silencing. Antisense Nucleic Acid Drug Dev. 2003;13:83-105. [PubMed] [DOI] |
| 28. | Arias CF, Dector MA, Segovia L, Lopez T, Camacho M, Isa P, Espinosa R, Lopez S. RNA silencing of rotavirus gene expression. Virus Res. 2004;102:43-51. [PubMed] [DOI] |
| 29. | Shabalina SA, Spiridonov AN, Ogurtsov AY. Computational models with thermodynamic and composition features improve siRNA design. BMC Bioinformatics. 2006;7:65. [PubMed] [DOI] |
| 30. | Ramakrishnan VG, Aljamali MN, Sauer JR, Essen-berg RC. Application of RNA interference in tick salivary gland research. J Biomol Tech. 2005;16:297-305. [PubMed] |