修回日期: 2005-09-01
接受日期: 2005-09-06
在线出版日期: 2006-03-18
目的: 观察血管内皮细胞生长因子(vascular endothelial growth factor, VEGF)通过p38信号传导通路诱导肝癌HepG2细胞转移及其对黏附作用的影响.
方法: 以p38MAPK信号通路特异性阻断剂SB203580预处理肝癌HepG2细胞, 采用3H-TdR掺入及鼠尾胶黏附实验测定不同浓度VEGF对肝癌HepG2细胞同质性和异质性黏附作用, 流式细胞术检测VEGF诱导肝癌细胞CD44v6表达.
结果: 1 μg/L和5 μg/L VEGF诱导HepG2细胞60 min 3H-TdR掺入实验结果(dpm/min)分别为1 758.67±289.46、1 380.03±328.55; 90 min分别为3 124.30±2 262.14、2 245.60±273.24; 10 μg/L VEGF诱导HepG2细胞60, 90, 120 min 3H-TdR掺入实验分别为1 232.32±201.04、2 337.50±333.04、2 236.99±237.07, 显著低于对照组的2 184.49±336.03、3 560.00±255.17、4 337.40±377.35(P<0.05或0.01); 经SB203580预处理的HepG2细胞, 60, 90, 120 min后的结果为2 634.23±375.21、3 834.82±535.79、4 398.40±564.76, VEGF诱导肝癌细胞同质性黏附作用降低. 5 μg/L和10 μg/L VEGF诱导HepG2细胞60 min鼠尾胶黏附实验吸光度A值为0.263±0.021、0.238±0.034, 1, 5和10 μg/L VEGF诱导HepG2细胞90 min A值分别为0.269±0.023、0.373±0.083、0.393±0.081; 120 min分别为0.371±0.061、0.390±0.074、0.433±0.122, 分别高于对照组的0.130±0.025、0.143±0.036、0.210±0.028(P<0.05或0.01); 经SB203580预处理的HepG2细胞, 60, 90, 120 min鼠尾胶黏附实验吸光度A值分别为0.201±0.035、0.347±0.112、0.479±0.217, VEGF诱导的肝癌细胞异质性黏附作用降低. 5 μg/L VEGF诱导肝癌细胞2 h后CD44v6表达阳性细胞数为32.6%±4.2%, 用SB203580阻断p38信号传导通路后, CD44v6阳性细胞数(4.3%±0.54%)显著下降(P<0.01).
结论: VEGF可以通过p38信号传导通路增加肝癌细胞异质性黏附作用以及降低肝癌细胞的同质性黏附作用, 促进肝癌HepG2细胞侵袭与转移.
引文著录: 毛华, 黄纯炽, 赵敏芳, 宋卫生. p38MAPK信号传导通路调控VEGF诱导肝癌细胞黏附作用. 世界华人消化杂志 2006; 14(8): 778-783
Revised: September 1, 2005
Accepted: September 6, 2005
Published online: March 18, 2006
AIM: To investigate the role of the p38MAPK signal transduction pathway in the metastasis and adhesion of hepatocellular carcinoma cell line HepG2 induced by vascular endothelial growth factor (VEGF).
METHODS: Hepatocellular cancinoma cell line HepG2 were or not pretreated with specific blocker (SB203580) of p38MAPK signal transduction pathway. 3H-TdR infiltration and the experiment of rat tail colloid were used to measure the effects of different concentrations of VEGF on the homotypic and hetertypic adhesion in HepG2 cells. Flow cytometry was adopted to detect VEGF-induced expression of CD44v6 and by Boyden-Chamber assay was used to evaluate VEGF-induced metastasis of HepG2 cells.
RESULTS: After 1 and 5 mg/L VEGF induction for 60 min, the values (dpm/min) of 3H-TdR infiltration in HepG2 cells were 1 758.67 ± 289.46 and 1 380.03 ± 328.55; for 90 min, the values were 3 124.30 ± 2 262.14 and 2 245.60 ± 273.24, respectively. After 10 mg/L VEGF induction, the values were 1 232.32 ± 201.04, 2 337.50 ± 333.04, and 2 236.99 ± 237.07, respectively, which were dramatically lower than those in control group (P < 0.05 or 0.01). However, in the HepG2 cells pretreated with SB203580, the values of 3H-TdR infiltration after 60, 90 and 120 min were 1 232.32 ± 201.04, 2 337.50 ± 333.04, and 2 236.99 ± 237.07, respectively, and the homotypic adhesion induced by VEGF were inhibited. After 5 and 10 mg/L induction for 60 min, the optical densities (A values) of the experiment of rat tail colloid were 0.263 ± 0.021 and 0.238 ± 0.034, respectively. After 1, 5, and 10 mg/L VEGF induction for 90 min, the A values were 0.269 ± 0.023, 0.373 ± 0.083, and 0.393 ± 0.081, respectively; for 120 min, the A values were 0.371 ± 0.061, 0.390 ± 0.074, and 0.433 ± 0.122, respectively, in HepG2 cells, which were remarkably higher than those in control group (P < 0.05 or P < 0.01). However, in the HepG2 cells pretreated with SB203580, the A values after 60, 90, and 120 min were 0.201 ± 0.035, 0.347 ± 0.112, and 0.479 ± 0.217, respectively, and the hetertypic adhesion induced by VEGF was restrained. After 5 mg/L VEGF induction for 2 h, the CD44v6 positive HepG2 cells counted for a percentage of 32.6% ± 4.2%, but rate of positive cell decreased to 4.3% ± 0.54% when p38MAPK signal transduction pathway was blocked (P < 0.01).
CONCLUSION: VEGF can promote the hetertypic adhesion and decrease the homotypic adhesion of hepatocellular carcinoma HepG2 cells by through p38MAPK signal transduction pathway, which play an important role in the invasion and metastasis of HepG2 cells.
- Citation: Mao H, Huang CZ, Zhao MF, Song WS. Role of p38MAPK signal transduction pathway in adhesion of hepatocellular cancinoma cell line HepG2 induced by vascular endothelial growth factor. Shijie Huaren Xiaohua Zazhi 2006; 14(8): 778-783
- URL: https://www.wjgnet.com/1009-3079/full/v14/i8/778.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i8.778
血管内皮细胞生长因子(vascular endothelial growth factor, VEGF)可诱导肿瘤血管形成, 在肿瘤组织中有较高表达, 与肿瘤浸润和转移密切相关[1-5]. 我们研究了VEGF可以通过p38MAPK信号传导通路诱导肝癌细胞出现转移[6-8], 但是与肿瘤浸润和转移密切相关VEGF是否通过p38MAPK信号传导通路影响肝癌转移过程中肿瘤细胞黏附作用, 目前还未见文献报道. 我们研究了VEGF作用于肝癌细胞后以及用SB203580特异性阻断p38MAPK信号传导通路后VEGF对肝癌细胞同质性黏附和异质性黏附的影响.
肝癌HepG2细胞株由南方医科大学南方医院消化疾病研究所实验中心提供, RPMI 1640购自Sigma, 小牛血清购自杭州四季青公司, VEGF购自美国Pepro Tech, 用无血清RPMI 1640培养液配制成10 mg/L, 置于-200℃保存待用. 鼠尾胶(主要含Ⅰ、Ⅳ型胶原酶, 由暨南大学医学院病理教研室谢举楦教授惠赠). 牛血清白蛋白(BSA)为Sigma公司产品, 用无血清RPMI 1640培养液配制成10 μg/L置于4℃冰箱保存. p38磷酸化活性检测试剂盒购自NEW ENGLISH BioLabs公司. MTT为美国Sigma公司产品. p38MAPK信号通路特异性阻断剂SB203580购自美国Calbiochem公司, Mr 337.4, 用二甲基亚砜(DMSO)溶解, 配制成1 mmol/L, 置于-20℃保存待用. CD44v6小鼠抗人一抗, FITC标记羊抗小鼠IgG二抗购自武汉博士德生物工程有限公司. 美国Meridian公司生产Acas ULTIMA312型激光共聚焦显微镜.
1.2.1 p38MAPK蛋白激酶测定: HepG2细胞以1×106细胞/瓶的浓度接种于50 mL培养瓶中, 设对照组、5 μg/L VEGF组、5 μg/L VEGF+5 μmol/L SB203580, 37℃、50 mL/L CO2培养2 h后, 收集细胞, 超声波裂解30 s, 冰浴10 min, 10 000 g低温离心10 min, 收集细胞裂解液上清, 考马斯亮蓝法测定蛋白质浓度. 取200 μL细胞裂解液上清, 加入2 μL p38mAB, 冰上放置45 min于4℃以12 000 g离心10 min, 取上清500 μL, 加入蛋白A-Sepharose 40 μL, 混匀, 4℃搅拌孵育1 h, 4℃, 10 000 g离心, 加入1×SDS-PAGE 50 μL加样缓冲液, 煮沸10 min, SDS-PAGE电泳, 将蛋白转移至硝酸纤维素膜, 显影, 定影, 对显影条带进行定量分析.
1.2.2 细胞基质黏附实验(异质性黏附实验): 将4℃保存的5 g/L鼠尾胶(暨南大学医学院病理教研室谢举楦教授惠赠, PBS稀释)加入96孔板中, 每孔20 μL, 置于37℃烤箱中1 h. 在铺好鼠尾胶的96孔板中加入培养的HepG2细胞(108/L), 每孔100 μL, 37℃, 50 mL/L CO2培养24 h后, 每孔加终浓度5 μg/L VEGF分别培养60, 90, 120 min, 对照组仅加PBS缓冲液. 另外一组为预先用SB203580阻断p38MAPK组(简称SB组), 在铺好鼠尾胶的96孔板中加入培养的HepG2细胞(108/L), 每孔100 μL, 37℃, 50 mL/L CO2培养24 h后, 每孔加终浓度5 μSB203580, 15 min后加入5 μg/L VEGF, 培养120 min(SB组). 各组细胞培养结束后, 缓慢吸出培养液, 每孔加入5 g/L的四氮唑兰盐(MTT)20 μL, 继续培养4 h, 吸出MTT, 每孔中加入二甲基亚砜(DMSO)100 μL, 室温孵育10 min, 用Biol Rad-酶联免疫检测仪在570 nm测吸光度A值. 每组设4个复孔, 取平均值.
1.2.3 流式细胞术检测VEGF诱导肝癌细胞CD44v6表达: HepG2细胞以1×106细胞/瓶的浓度接种于50 mL培养瓶中, 设对照组、1, 5, 10 VEGF组、1 μg/L VEGF+5 μmol SB203580、5 μg/L VEGF+5 μmol SB203580、10 μg/L VEGF+5 μmol SB203580组, 37℃、CO2培养2 h后, 观察VEGF及阻断p38信号通路VEGF对肝癌黏附分子CD44v6表达关系. 除对照组外, 其余每管细胞中加入0.5 mL稀释抗CD44v6一抗(武汉博士德生物医学公司, 1∶86稀释). 冰浴30 min, 1 500 r/min离心5 min, 弃上清. 加入FITC标记羊抗小鼠IgG二抗(武汉博士德生物医学公司, 1∶100稀释), 暗处冰浴30 min. 500目尼龙网过滤, 调整细胞浓度为1×106/mL, 总量0.5 mL, 冰浴备用. 上机检测. 每组测试3次, 取3次测试结果平均值.
1.2.4 细胞间黏附实验(同质性黏附实验): 96孔板中加入培养的HepG2细胞(108/L), 每孔100 μL, 置于37℃、50 mL/L CO2培养箱. 在细胞生长旺盛时加入含3H-TdR的新鲜RPMI 1640培养液, 标记18-24 h后, 调整细胞浓度为108/L, 然后将标记的细胞悬液100 μL加到单层培养的靶细胞表面, 设置空白、全部加入标记肿瘤细胞对照组, 以及VEGF 1 μg/L、5 μg/L、10 μg/L浓度组, 各组分别培养60, 90, 120 min, 每组设3个复孔, 取平均值. 另外一组预先用SB203580阻断p38MAPK信号传导通路组, 在长满单层细胞的培养孔中每孔预先终浓度5 μmol SB203580, 15 min后加入终浓度5 μg/L VEGF, 置于37℃、CO2培养箱中培养2 h, 培养结束后, 多头细胞收集仪收集96孔板底部的细胞至醋酸纤维滤纸上, 考干后置于闪烁液中, Backman-L600型液闪仪进行液闪计数, 测定脉冲数cpm(dpm/min). 每组取3次实验结果的平均值.
1.2.5 肝癌细胞E-cadherin表达: 消化培养的HepG2细胞(1085/L)100 μL置于细胞培养皿中央, 置于37℃、CO2培养6-8 h. 对照组加入5 μL RPMI 1640, 一组加入VEGF, 使终浓度为5 μg/L, 另外一组在加终浓度为5 μg/L VEGF前15 min, 预先在细胞培养皿底加入终浓度5 μmol SB203580(SB组), 继续培养120 min, 5mL/L小牛血清100 μL覆盖细胞10 min, 去除内源性非特异性蛋白. 加入小鼠抗人E-Cadnine IgG一抗0.5-1 mg/L, 置于湿盒中, 室温下孵育60 min. 加入FITC标记羊抗小鼠二抗, 室温下暗处孵育30 min后, 上机激光共聚焦显微镜检测计算每个样品100个细胞的平均荧光值.
统计学处理 多组间计数资料比较采用F检验、两组间比较采用t检验.
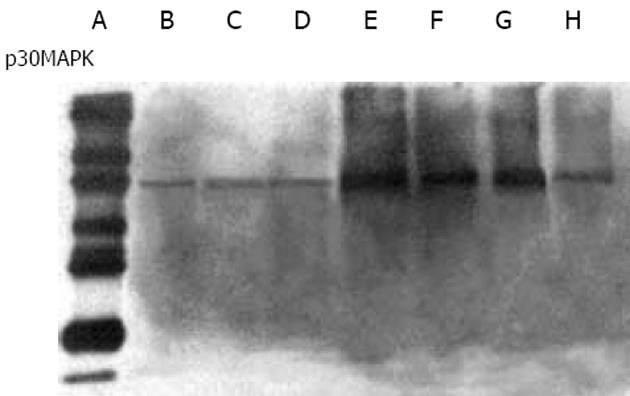
VEGF诱导肝癌细胞后5 min p38MAPK活性开始增加, 30-60 min明显增高, 120 min达到高峰, 300 min接近基础水平(图1).
VEGF可以使肝癌细胞与基质的黏附(异质性黏附)作用增加. 明显高于对照组(P<0.05). 5 μg/L、10 μg/L VEGF对肝癌细胞的异质性黏附作用大于1 μg/L VEGF(P<0.05). 肝癌细胞的异质性黏附作用在VEGF诱导后60 min开始产生, 90-120 min作用最强, 持续作用6 h, 并呈时间、剂量依赖关系. 用SB203580阻断p38MAPK信号传导通路, 能够抑制VEGF增强肝癌细胞异质性黏附作用, 有利于肝癌细胞道的侵袭与转移(表1).
对照组CD44v6表达阳性肝癌细胞为1.7%, 1 μg/L、10 μg/L VEGF诱导肝癌细胞2 h后CD44v6表达阳性细胞数为3.1%, 1.7%, 与对照组比较, 差异无显著性(P>0.05), 5 μg/L VEGF肝癌细胞2 h CD44v6表达阳性细胞数为32.6%, 显著高于其余各组(P<0.01). 用SB203580阻断p38信号传导通路后, 能显著抑制5 μg/L VEGF上调肝癌细胞表达CD44v6蛋白(表2).
1 μg/L VEGF作用肝癌细胞120 min后同质性黏附作用降低有显著性, P<0.05; 5 μg/L、10 μg/L VEGF作用肝癌细胞60, 90 min后显著降低同质性黏附作用, P<0.05, 作用120 min后同质性黏附作用有非常显著性降低, P<0.01. 用SB203580阻断p38信号传导通路, 可以显著抑制VEGF诱导肝癌细胞同质性黏附作用降低(表3).
| 分组 | t(VEGF作用) | ||
| 60min | 90min | 120min | |
| 空白对照 | 50.54±10.23 | 105.70±23.56 | 115.10±31.09 |
| 对照 | 2184.49±336.03 | 3560.00±255.17 | 4337.40±377.35 |
| 1 μg/L | 1758.67±289.46 | 3124.30±2262.14 | 2657.43±310.31a |
| 5 μg/L | 1380.00±328.55a | 2245.60±273.24a | 2091.50±213.84b |
| 10 μg/L | 1232.30±201.04a | 2337.50±333.04a | 2236.90±237.07b |
| SB组 | 2634.23±375.21 | 3834.82±535.79 | 4398.40±564.76 |
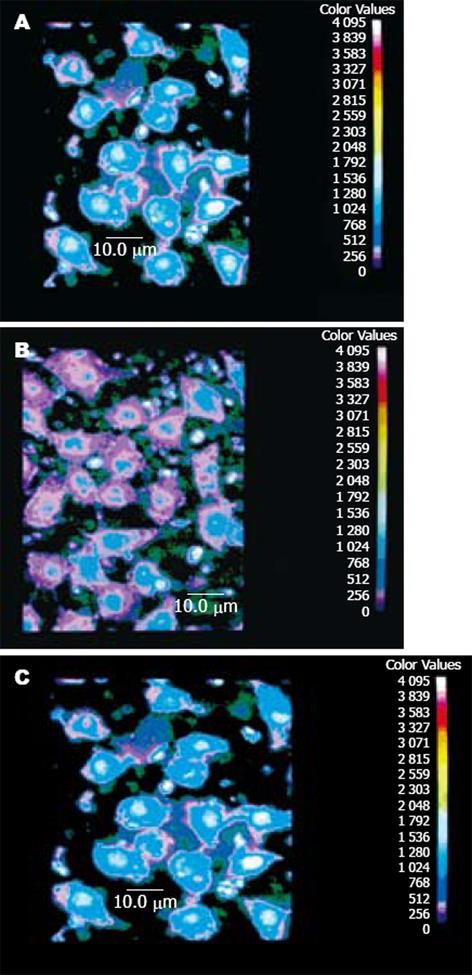
激光扫描共聚焦显微镜观察发现肝癌细胞表达的钙黏附素蛋白分布在细胞膜表面. 对照组肝癌细胞荧光强度(图2A)较VEGF诱导2 h后肝癌荧光强度(图2B)更高, VEGF能够降低肝癌细胞钙黏附素的表达, 与对照组比较, 差异有非常显著性(P<0.01). SB203580阻断p38MAPK信号传导通路, 可阻断VEGF诱导的E-cadherin表达降低(图2C), 与对照组(757±103)比较(vs 803±121, P>0.05), 与VEGF组(352±56)比较(P<0.01).
癌的侵袭与转移行为是引起肿瘤患者死亡的主要原因, 癌转移是一个复杂的多步骤连续过程, 包括肿瘤细胞从原发部位脱落、肿瘤细胞溶解组织基质后移动、肿瘤细胞与血管内皮细胞黏附、肿瘤细胞穿透血管壁、肿瘤细胞在血管内运行、转移灶的形成等过程. 已有资料显示, 癌转移与肿瘤细胞之间黏附能力降低以及瘤细胞与内皮细胞黏附能力增强有关[9-13]. 研究表明, E-cadherin的表达减少或在动物高浸润性肿瘤细胞株, 其瘤细胞表面的钙黏附蛋白分子E(E-cadherin)丧失与肿瘤细胞从原发瘤上脱落密切相关[14-15]. 钙黏附蛋白分子是一类介导同种细胞相互黏附的钙依赖性跨膜蛋白, 参与形成和维护正常细胞的连接, 是介导细胞间连接最重要的一类分子. 他通过连接素与细胞骨架形成一复合物, 他的活性也可影响细胞间紧密连接、缝隙连接和桥粒连接. 而将编码黏附分子E的DNA插入到肿瘤细胞基因组中, 则肿瘤细胞丧失转移和浸润能力[16-17]. E-黏附素介导细胞间的黏附作用, 高浸润性肿瘤细胞E-cadherin的表达和分泌减少, 使瘤细胞彼此分散才能侵入细胞外基质(extracellular matrix, EMC)[18-20]. 肿瘤的生长可分为肿瘤细胞的克隆性增殖期(无血管期)和血管形成期[21]. 当肿瘤组织生长在2-3 mm以内时, 肿瘤细胞数在107以内, 肿瘤组织没有血管生成, 肿瘤一般无转移倾向. 一旦新生毛细血管长进肿瘤组织, 肿瘤组织中VEGF表达增加, 血管生成增多, 肿瘤转移倾向增高[22]. VEGF促使肿瘤组织血管生成是肿瘤生长和转移的形态学基础, 是促进肿瘤转移的重要因素, 他不仅为肿瘤细胞提供充足的营养, 促进肿瘤细胞分裂、增殖, 而且为转移的肿瘤细胞提供了通道. 我们研究表明VEGF也能使肝癌细胞本身转移能力增强[23-24], VEGF可以减少肝癌HepG2细胞E-cadherin黏附素的表达和分泌, 细胞间同质性黏附作用降低, 5 μg/L VEGF作用肝癌细胞2 h, 与对照组比较, 差异有非常显著性, P<0.01. 同质性黏附作用减弱, 恶性肿瘤细胞彼此间黏附及连接作用减弱, 使肿瘤细胞从原发灶脱落, 获得高转移的能力[25-26].
我们研究表明, VEGF可以使肝癌细胞穿透羊膜基质能力增强, VEGF诱导向下室转移的细胞显著高于对照组[27]. 癌细胞侵袭转移过程, 包括肿瘤细胞从原发癌灶脱离, 并与基质和血管内皮细胞黏附, 进入循环中在远隔器官着床的过程. 我们研究发现, VEGF可以诱导肝癌HepG2细胞异质性黏附作用增加, 呈时间、剂量依赖关系. 异质性黏附作用增加可以增强肿瘤细胞与内皮细胞的黏附, 穿过内皮细胞进入血液循环; 异质性黏附作用增加可以增强脱离的肿瘤细胞要与基质的胶原纤维黏附, 有利于肿瘤细胞的运动和转移灶的形成[28]. 1 μg/L VEGF作用120 min后、1 μg/L、5 μg/L、10 μg/L VEGF作用60, 90, 120 min后诱导大肠癌细胞同质性黏附作用减弱, 与对照组比较, 差异有显著性或非常显著性, P<0.05或P<0.01. 恶性肿瘤细胞彼此间黏附及连接作用减弱, 使肿瘤细胞从原发灶脱落, 获得高转移的能力[29].
VEGF诱导肝癌细胞转移, 与其增强肝癌细胞异质性黏附作用, 降低肝癌细胞同质性黏附作用有关. 研究VEGF作用的信号传导途径, 并阻断VEGF发生生物学作用的信号途径, 可能成为抑制VEGF诱导的肿瘤侵润与转移的新靶点.
血管内皮细胞生长因子(VEGF)在肝癌组织中有较高表达, 并与肝癌浸润和转移密切相关. VEGF对肿瘤细胞形态学改变研究甚少. p38信号通路是MAPK家族重要组成, 在全身性炎症反应、休克、细胞迁移、细胞凋亡、心血管疾病等方面具有重要作用. 业已表明肿瘤转移过程涉及多种机制, 其中癌细胞运动、黏附、瘤体内血管生成、癌细胞凋亡及转移相关基因与肿瘤浸润.
本文阐述了VEGF诱导肝癌细胞转移的机制, 是通过p38 MAPK信号通路导致了同质性黏附作用降低和异质性黏附作用增强.
研究肿瘤转移过程中p38 MAPK信号传导通路改变, 对于了解p38信号传导通路与肿瘤转移关系以及p38信号传导通路作为肿瘤治疗靶点提供理论依据和治疗途径.
电编: 张敏 编辑:菅鑫妍
| 1. | Du JR, Jiang Y, Zhang YM, Fu H. Vascular endothe-lial growth factor and microvascular density in eso-phageal and gastric carcinomas. World J Gastroen-terol. 2003;9:1604-1606. [PubMed] [DOI] |
| 2. | Lissoni P, Rovelli F, Malugani F, Brivio F, Fumagalli L, Gardani GS. Changes in circulating VEGF levels in relation to clinical response during chemotherapy for metastatic cancer. Int J Biol Markers. 2003;18:152-155. [PubMed] |
| 3. | Zheng S, Han MY, Xiao ZX, Peng JP, Dong Q. Clinical significance of vascular endothelial growth factor expression and neovascularization in colorectal carci-noma. World J Gastroenterol. 2003;9:1227-1230. [PubMed] [DOI] |
| 6. | Mao H, Yuan AL, Zhao MF, Lai ZS. Role of signal transduction pathway of mitogen-activated protein kinase on metastasis of hepatocellular carcinoma induced by VEGF. Zhonghua Xiaohua Zazhi. 2001;2:38-41. |
| 7. | Chen JL, Chen WX, Zhu JS, Chen NW, Zhou T, Yao M, Zhang DQ, Wu YL. Effect of P-selectin monoclonal antibody on metastasis of gastric cancer and immune function. World J Gastroenterol. 2003;9:1607-1610. [PubMed] [DOI] |
| 8. | 毛 华, 袁 爱力, 赵 敏芳, 赖 卓胜, 张 亚历, 周 殿元. p38MAPK信号通路影响血管内皮细胞生长因子诱导肝癌细胞超微结构变化. 世界华人消化杂志. 2000;8:536-538. |
| 10. | Ding YB, Chen GY, Xia JG, Zang XW, Yang HY, Yang L. Association of VCAM-1 overexpression with oncogenesis, tumor angiogenesis and metasta-sis of gastric carcinoma. World J Gastroenterol. 2003;9:1409-1414. [PubMed] [DOI] |
| 11. | Mine S, Fujisaki T, Kawahara C, Tabata T, Iida T, Yasuda M, Yoneda T, Tanaka Y. Hepatocyte growth factor enhances adhesion of breast cancer cells to endothelial cells in vitro through up-regulation of CD44. Exp Cell Res. 2003;288:189-197. [PubMed] [DOI] |
| 12. | Joo M, Lee HK, Kang YK. Expression of E-cadherin, beta-catenin, CD44s and CD44v6 in gastric adeno-carcinoma: relationship with lymph node metasta-sis. Anticancer Res. 2003;23:1581-1588. [PubMed] |
| 15. | Sun BC, Sun Y, Zhao XL, Liu YX, Zhang SW, Liu YX. Expressions and significance of E-cadherin and beta-catenin in synovial sarcoma. Zhonghua Zhongliu Zazhi. 2005;27:727-730. [PubMed] |
| 16. | Endo K, Ueda T, Ueyama J, Ohta T, Terada T. Imm-unoreactive E-cadherin, alpha-catenin, beta-catenin, and gamma-catenin proteins in hepatocellular carcinoma: relationships with tumor grade, clinico-pathologic parameters, and patients' survival. Hum Pathol. 2000;31:558-565. [PubMed] [DOI] |
| 17. | Santos-Garcia A, Abad-Hernandez MM, Fonseca-Sanchez E, Julian-Gonzalez R, Galindo-Villardon P, Cruz-Hernandez JJ, Bullon-Sopelana A. E-cadherin, laminin and collagen IV expression in the evolution from dysplasia to oral squamous cell carcinoma. Med Oral Patol Oral Cir Bucal. 2006;11:E100-E105. [PubMed] |
| 19. | Lombaerts M, van Wezel T, Philippo K, Dierssen JW, Zimmerman RM, Oosting J, van Eijk R, Eilers PH, van de Water B, Cornelisse CJ. E-cadherin transcriptional downregulation by promoter methylation but not mutation is related to epithelial-to-mesenchymal transition in breast cancer cell lines. Br J Cancer. 2006;94:661-671. [PubMed] [DOI] |
| 20. | Sun BC, Sun Y, Zhao XL, Liu YX, Zhang SW, Liu YX. Expressions and significance of E-cadherin and beta-catenin in synovial sarcoma. Zhonghua Zhongliu Zazhi. 2005;27:727-730. [PubMed] |
| 21. | Folkman J. Angiogenesis. Annu Rev Med. 2006;57:1-18. [DOI] |
| 22. | 陈 汝福. 抗肿瘤血管形成基因治疗研究现状. 国外医学·肿瘤学分册. 1998;25:211-213. |
| 23. | 姜 金波, 朱 民, 李 雪梅, 寿 楠海, 吕 丽红, 邵 军, 尹 金岭. 结肠癌VEGF-C表达、淋巴管密度与淋巴转移和预后的关系. 山东大学学报·医学版. 2005;43:616-620. |
| 25. | 蒋 新农, 周 柔丽. 肿瘤细胞黏附、迁移与转移的相关性. 生物化学与生物物理进展. 1998;25:404-407. |
| 28. | Lesley J, Hyman R, Kincade PW. CD44 and its inter-action with extracellular matrix. Adv Immunol. 1993;54:271-335. [PubMed] [DOI] |
| 29. | 杨 秋霞, 赵 贤姝. CD44分子生物学特性及与肿瘤关系的研究进展. 国外医学·免疫学分册. 2000;23:12-15. |