修回日期: 2006-02-15
接受日期: 2006-03-09
在线出版日期: 2006-03-18
目的: 应用12色荧光原位杂交技术(multicolor fluorescence in situ hybridization, M-FISH)鉴定食管癌细胞系KYSE450的染色体畸变.
方法: 采用DOP-PCR(degenerate oligonucleo-tide primer-polymerase chain reaction)法混合标记两组多色painting探针, 先后两次杂交到相同的KYSE450染色体片, 结合反相DAPI显带技术进行核型分析.
结果: 成功地建立了一种重复的12色荧光原位杂交技术, 并鉴定出KYSE450中存在的畸变染色体. 该细胞系共有54条染色体, 只有13, 21和X号染色体是正常的, 其余21条染色体均表现异常. 1, 2, 3, 5, 6, 8, 9, 14, 15, 16和17号染色体部分区带增益, 4和18号染色体部分区带缺失. 7, 11, 12和19号染色体同时存在区带增益和其它部分区带缺失. 1, 2, 3, 4, 5, 6, 7, 8, 9, 11, 12, 14, 15, 16, 17, 18和19号染色体显示有易位. 22号染色体丢失1条, 未检测到10, 20, Y染色体成分.
结论: 12色荧光原位杂交可用于鉴定肿瘤中复杂的染色体异常. KYSE450存在较多与原发性食管鳞癌一致的染色体改变.
引文著录: 吴玉鹏, 杨壹羚, 韩亚玲, 徐昕, 蔡岩, 杨光之, 王学英, 詹启敏, 吴旻, 王明荣. 建立十二色荧光原位杂交技术鉴定食管癌 KYSE450 细胞系的核型. 世界华人消化杂志 2006; 14(8): 747-751
Revised: February 15, 2006
Accepted: March 9, 2006
Published online: March 18, 2006
AIM: To establish the technique of multicolor fluorescence in situ hybridization (M-FISH) for identification of chromosome aberrations in esophageal carcinoma cell line KYSE450.
METHODS: Two pools of 12-color whole-chromosome painting (WCP) probes were designed and labeled by degenerate oligonucleotide primer-polymerase chain reaction (DOP-PCR). FISH was performed twice on the same metaphase spreads. The karyotype was analyzed by the combination of inverted DAPI banding and M-FISH.
RESULTS: Repetitive 12-color M-FISH was successfully established and the cytogenetic abnormalities in KYSE450 cells were characterized. There were 54 chromosomes in the cell line, but only those numbered 13, 21 and X were normal. DNA losses were observed at parts of chromosomes 4, 7, 11, 12, 18 and 19. Chromosomal gains and translocations occurred at chromosome 1, 2, 3, 4, 5, 6, 7, 8, 9, 11, 12, 14, 15, 16, 17, 18 and 19. Chromosome 22 showed monosomy, and no chromosomes 10, 20 and Y were detected.
CONCLUSION: The established 12-color M-FISH is useful for the analysis of chromosomes in the whole genome of human tumors. KYSE450 cell line presents multiple cytogenetic abnormalities, which are in accordance with those occurred in primary esophageal squamous cell carcinoma.
- Citation: Wu YP, Yang YL, Han YL, Xu X, Cai Y, Yang GZ, Wang XY, Zhan QM, Wu M, Wang MR. Identification of complex chromosome abnormalities in esophageal carcinoma cells KYSE450 by multicolor fluorescence in situ hybridization. Shijie Huaren Xiaohua Zazhi 2006; 14(8): 747-751
- URL: https://www.wjgnet.com/1009-3079/full/v14/i8/747.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i8.747
肿瘤和先天性遗传病等大多有染色体异常, 分析染色体异常的常规方法是基于传统的细胞遗传学显带技术. 对于肿瘤尤其是实体瘤, 传统的显带技术很难对其复杂的染色体异常进行分析. 单色或双色荧光原位杂交有其高度敏感性和特异性, 但不能同时观察肿瘤细胞全部染色体的变化情况. 多色荧光原位杂交(multicolor fluorescence in situ hybridization, M-FISH)、光谱核型分析(spectral karyotyping, SKY)等技术的出现使得一次性进行肿瘤细胞全基因组染色体异常的筛查成为可能[1-2], 但是由于这些技术成本太高, 目前尚难在国内推广应用. 我们建立一种12色荧光原位杂交技术, 其费用较为低廉, 经过两次杂交即可完成整个基因组全部染色体的分析.
食管癌细胞系KYSE450由日本京都大学Shimada教授惠赠, 来自于一位59岁男性患者、分化良好且手术前没有经过放化疗的原发食管癌组织[3]. 1-22, X和Y号染色体涂染探针由中国医学科学院基础医学研究所陈虹教授惠赠. DEAC-5-dUTP和FITC-12-dUTP(PerkinElmer), Cy3-dUTP和Cy5-dUTP(Amersham Biosciences), 去离子甲酰胺(Invitrogen), 硫酸葡聚糖(Invitrogen), 4, 6-二氨基-2-苯吲哚(DAPI, Roche), Cot-1 DNA (Invitrogen), 秋水仙胺 (Gibco), RPMI 1640培养基(医科院基础所遗传室), Taq 酶 (TaKaRa). 引物由上海生工公司合成. 引物序列: 5,-CCGACTCGAGNNNNNN ATGTGG-3,.
KYSE450细胞培养对数生长期时, 加秋水仙胺(终浓度为100 μg/L)继续培养100 min左右, 消化离心, 常规低渗、固定和滴片, 空气干燥30 min, 65℃烤150 min后备用. 中期染色体片用RNase(Sigma, 0.1 g/L)和Pepsin(Sigma, 0.05 g/L)先后处理, 10 g/L多聚甲醛固定15 min, PBS缓冲液洗涤后. 染色体片在700 mL/L甲酰胺/2×SSC(pH7.0)72℃变性3 min, 2×SSC 4℃ 3 min洗涤2次, 梯度乙醇脱水, 室温晾干. 采用DOP-PCR法标记染色体涂染探针, 通过琼脂糖凝胶电泳检测标记产物的大小及范围. 按染色体大小成比例地吸取已标记的染色体涂染探针, 加入与探针总体积相同的Cot-1 DNA, 乙醇/醋酸钠法沉淀探针, 700 mL/L乙醇洗涤, 室温暗处晾干. 杂交液(含500 mL/L去离子甲酰胺, 100 g/L硫酸葡聚糖, 2×SSC)5μL加入晾干的探针, 37℃溶解30 min, 混匀后75℃变性8 min, 置冰上2 min, 37℃水浴预复性30 min. 将探针加在预处理好的中期染色体片上, 盖玻片覆盖, rubber cement封片, 置于湿盒中, 37℃温箱中杂交48 h. 除去rubber cement和盖玻片, 将染色体片放入500 mL/L甲酰胺/2×SSC溶液, 42℃洗涤15 min, 2×SSC室温摇洗3 min×2次, 梯度乙醇脱水, 室温暗处晾干. 加甘油∶PBS(9∶1, 含20 g/L DABCO, 1 mg/L DAPI)20 μL, 封片. 荧光显微镜下观察, 通过MetaMorph Imaging System (Universal Imaging Corporation)控制的CCD摄取图.
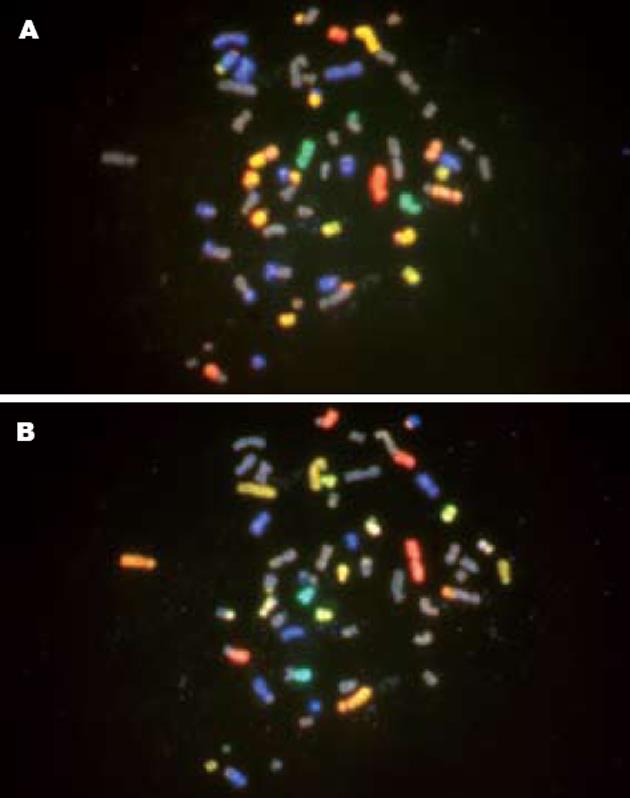
我们设计了两组探针池(表1), 先后与相同的KYSE450染色体片杂交. 第1次应用Pool 1杂交, 镜检选取分散较好的中期分裂相, 进行定位、拍照及图像合成(图1A). 之后将杂交片置于纯乙醇中浸泡, 脱去盖片, 再用纯乙醇洗涤2次, 晾干. 第2次杂交前玻片直接用700 mL/L甲酰胺在72℃变性, 2×SSC洗涤, 梯度乙醇脱水, 晾干后应用Pool 2杂交, 根据第1次定位的坐标, 镜检拍照, 再对第2次杂交的图像进行合成(图1B). 由此我们成功建立了12色荧光原位杂交技术. 综合2次12色杂交和DAPI反相显带(图2)的结果, KYSE450细胞系共有54条染色体(图3), 但只有13, 21和X号染色体是正常的, 其余21条染色体均发生畸变. 其中, 2, 3, 6, 8, 15, 16和17号染色体都存在2条正常染色体, 1, 5和14号染色体都存在1条正常染色体, 但是这些染色体均存在整条染色体或部分区带的净增益. 4和18号分别存在1条正常染色体, 各自的另一条染色体发生了部分区带缺失. 7, 11, 12和19号染色体既表现部分区带增益又有其它区带缺失. 1, 2, 3, 4, 5, 6, 7, 8, 9, 11, 12, 14, 15, 16, 17, 18和19号染色体显示结构畸变, 包括易位和缺失. 其中5和14号整条染色体各参与了一个衍生染色体[der(5)t(5;15)(pter→qter∷q21)和der(14)t(9; 14)(q21→q31∷pter→qter)]的组成, 另有一个衍生11号染色体涉及了3条染色体之间的易位, 即der(11)t(11;7;5)(p14→qter∷q22∷q32→q23). 染色体结构畸变的断点位于着丝粒区域的有1p10, 1q10, 2q10, 3q10, 7q10, 9p10, 11q10和19q10, 染色体3, 4, 5, 6, 7, 8, 9, 11, 12, 14, 15, 16, 17, 18和19畸变的断点位于非着丝粒区域. 22号丢失1条, 未检测到10, 20, Y染色体成分(表2).
荧光原位杂交(fluorescence in situ hybridization, FISH)是Pinkel et al[4]于1986年创建的一种应用荧光法检测细胞核中或染色体上特异DNA序列的技术. 随着不同荧光素和滤光片的发展, 相继出现了双色或三色标记的探针. 1990年Nederlof et al[5]报道了一种组合标记法, 利用3种荧光素(FITC, TRITC, AMCA)标记出7种探针, 用于产前诊断及肿瘤染色体的畸变分析, 这样一次杂交可以检测较多的染色体变化. 但是, 人类有22条常染色体和2条性染色体, 7种探针还是不能满足一次试验检测出人类24条染色体变化情况. 根据组合标记法的设计原则提示, N种荧光分子有2N-1种组合, 5种不同的荧光染料可以有31种不同的组合, 足以赋予22条常染色体及2条性染色体24种不同的颜色. 直到1996年, 多色荧光原位杂交(M-FISH)技术和光谱核型分析(SKY)的出现终于使这一设想成为现实[1-2]. 该技术是一种快速而强有力的分子细胞遗传学方法, 使研究者能够通过一次杂交同时观察到全部染色体的异常情况, 鉴定出各种简单或复杂的易位、插入以及标记染色体的来源[6-12]. 然而, 国内24色全染色体M-FISH的研究工作罕有报道, 迄今仅有一篇关于白血病细胞染色体分析的文献[13]. 造成这一现状的主要原因是该工作目前只能应用国外公司的已标记探针池试剂盒, 研究所需的成本太高. 为此, 我们建立了一种12色荧光原位杂交技术, 即设计两组探针池, 先后两次杂交到同一染色体片, 成功地鉴定了KYSE450食管癌细胞系的核型, 表明该方法是可行而且有效的. 我们应用4种荧光染料(DEAC, FITC, Cy3和Cy5)标记探针, 与国外公司的多色探针池相比, 该技术的显著特点是费用低廉. 我们所使用的染体片预处理液、杂交液等均是自行配制的, 更降低了实验成本. 由于需要在同一染色体片上进行重复杂交, 染色体片的质量非常关键. 高质量中期分裂相染色体是保证M-FISH方法成功的一个重要因素. 这样的分裂相要求染色体细长, 均匀分布, 无扭结, 不交叉重叠, 而且染色体有较少的细胞质, 以免产生较强的背景. 本项研究中, 我们探索了染色体制片及杂交前预处理的一些条件. 例如, 空气湿度过高可能导致探针的靶DNA降解而检测不到信号, 这可以通过杂交前临时制备染色体片解决. 我们对比了以下两种染色体片制备和老化方法: A: 常规滴片, 室温过夜老化, -20℃冻存, 杂交前取出; B: 当天滴片, 65℃烤片1-3 h, 然后杂交. 两种方法老化的染色体片杂交后均有信号, 但后者较好. 而且, 我们发现, 65℃烤片1 h的杂交信号比烤片3 h虽然稍强一点, 但前者经过第2次杂交后, 镜检发现染色体丢失严重, 而烤片3 h则不掉片. 显而易见, 虽然减少染色体片老化时间可以适当提高杂交信号强度, 但是染色体片老化程度不能太低, 因为老化不足会造成染色体丢失, 无法进行第2次杂交.
在进行第2次杂交前, 需要除去封片剂和盖片, 我们直接将玻片连同盖片在纯乙醇中浸泡, 至盖片脱落后换用新的纯乙醇振荡洗涤5 min ×2次, 晾干即可变性, 进行第2次杂交. 我们的方法比Muller et al[14]报道的进行重复杂交时除盖片和封片剂的步骤要简洁得多, 能够最大限度地避免染色体受损而影响杂交效果. 另一方面, 每次杂交时间均不可过长, 否则会导致信号模糊, 特别是第2次杂交的结果将显得不清晰. 这可能由于中期染色体在杂交液中长时间浸泡而变得松散. 我们的经验表明, 每次杂交以36-48 h为宜, 这样能够得到较强的信号且染色体形态保持良好.
我们应用重复12色荧光原位杂交技术分析了食管癌KYSE450细胞系中存在的畸变染色体, 其结果与我们前面研究以及文献报道的食管癌中发生的细胞遗传学改变有较多的一致性. 根据两次杂交的发现, KYSE450中存在1q, 2q, 3q, 5, 6p, 8p, 9, 11q, 12, 14, 15q, 16, 17和19p等染色体部分增益和4q, 7, 11p, 12q, 18q和19q等染色体部分丢失. Yen et al[15]运用比较基因组杂交(CGH)技术检测了46例食管癌手术标本, 结果显示扩增频率较高的染色体臂有1q, 2q, 3q, 5p, 7p, 7q, 8q, 11q, 12p, 12q, 14q, 17q, 20q和Xq, 丢失多发生在染色体臂1p, 3p, 4p, 5q, 8p, 9p, 9q, 11q, 13q, 16p, 17p, 18q, 19p和19q. Noguchi et al[16]分析53例食管癌组织中的DNA拷贝数变化, 发现最常见的增益位于3q, 5p, 8q, 11q和Xq, 最多的丢失为3p, 5q, 4p, 1p和Xp. 我们最近通过CGH方法观察25例中国北方的食管癌组织, 也发现高频率的1q, 3q, 5p, 9q, 11q, 15q增益和4q, 18q丢失[17]. 所有这些结果表明, KYSE450细胞系中存在的染色体畸变在一定程度上可以反映食管癌的部分原发性细胞遗传学变化, 本研究为更好地利用该细胞系进行相关研究提供了重要的背景资料.
肿瘤大多存在复杂的染色体异常.多色荧光原位杂交技术或光谱核型分析是两种强有力的染色体异常分析方法, 但是由于这些技术成本太高, 目前尚难在国内推广应用.
目前,多色荧光原位杂交技术的研究主要集中在如何将这项技术应用到绝大多数的实体肿瘤, 鉴定筛选这些常见实体肿瘤中的染色体异常. 另一个方面是如何提高该技术的分辨力, 如应用多色特异区带探针鉴定更加细小的染色体的畸变.
由于多色荧光原位杂交技术或光谱核型分析成本太高, 目前尚难在国内推广应用. 本文建立了一种费用较为低廉的12色荧光原位杂交技术, 经过两次杂交即可完成整个基因组全部染色体的分析, 鉴定了食管癌KYSE450细胞系的染色体畸变.
建立的12色FISH技术将可用于筛选与肿瘤发生、发展密切相关的染色体畸变, 有助于阐明肿瘤发生、发展分子机制. 对KYSE450的核型的明确将有助于更好地利用该细胞系.
本研究建立的12色荧光原位杂交技术, 通过对食管癌KYSE450细胞系中存在的畸变染色体分析, 结果发现与文献报道的食管癌中发生的细胞遗传学改变有较多的一致性, 表明该方法是可行而且有效. 该方法具有经济实用、一次性能进行全染色体分析等优点, 可对复杂的染色体异常进行筛查和分析, 具有较好的学术和应用价值.
电编: 李琪 编辑:潘伯荣
| 1. | Schrock E, du Manoir S, Veldman T, Schoell B, Wienberg J, Ferguson-Smith MA, Ning Y, Ledbetter DH, Bar-Am I, Soenksen D. Multicolor spectral karyotyping of human chromosomes. Science. 1996;273:494-497. [PubMed] [DOI] |
| 2. | Speicher MR, Gwyn Ballard S, Ward DC. Karyotyping human chromosomes by combinatorial multi-fluor FISH. Nat Genet. 1996;12:368-375. [PubMed] [DOI] |
| 3. | Shimada Y, Imamura M, Wagata T, Yamaguchi N, Tobe T. Characterization of 21 newly established esophageal cancer cell lines. Cancer. 1992;69:277-284. [PubMed] [DOI] |
| 4. | Pinkel D, Straume T, Gray JW. Cytogenetic analysis using quantitative, high-sensitivity, fluorescence hybridization. Proc Natl Acad Sci USA. 1986;83:2934-2938. [PubMed] [DOI] |
| 5. | Nederlof PM, van der Flier S, Wiegant J, Raap AK, Tanke HJ, Ploem JS, van der Ploeg M. Multiple fluorescence in situ hybridization. Cytometry. 1990;11:126-131. [PubMed] [DOI] |
| 6. | Ferti AD, Stamouli MJ, Panani AD, Raptis SA, Young BD. Molecular cytogenetic analysis of breast cancer: a combined multicolor fluorescence in situ hybridization and G-banding study of uncultured tumor cells. Cancer Genet Cytogenet. 2004;149:28-37. [PubMed] [DOI] |
| 7. | Poppe B, Cauwelier B, Van Limbergen H, Yigit N, Philippe J, Verhasselt B, De Paepe A, Benoit Y, Speleman F. Novel cryptic chromosomal rearrangements in childhood acute lymphoblastic leukemia detected by multiple color fluorescent in situ hybridization. Haematologica. 2005;90:1179-1185. [PubMed] |
| 8. | Williams SV, Adams J, Coulter J, Summersgill BM, Shipley J, Knowles MA. Assessment by M-FISH of karyotypic complexity and cytogenetic evolution in bladder cancer in vitro. Genes Chromosomes Cancer. 2005;43:315-328. [PubMed] [DOI] |
| 9. | Stamouli MI, Panani AD, Ferti AD, Petraki C, Oliver RT, Raptis SA, Young BD. Detection of genetic alterations in primary bladder carcinoma with dual-color and multiplex fluorescence in situ hybridization. Cancer Genet Cytogenet. 2004;149:107-113. [PubMed] [DOI] |
| 10. | Davidsson J, Paulsson K, Johansson B. Multicolor fluorescence in situ hybridization characterization of cytogenetically polyclonal hematologic malignancies. Cancer Genet Cytogenet. 2005;163:180-183. [PubMed] [DOI] |
| 11. | Gunawan B, Mirzaie M, Schulten HJ, Heidrich B, Fuzesi L. Molecular cytogenetic analysis of two primary squamous cell carcinomas of the lung using multicolor fluorescence in situ hybridization. Virchows Arch. 2001;439:85-89. [PubMed] [DOI] |
| 12. | Strefford JC, Stasevich I, Lane TM, Lu YJ, Oliver T, Young BD. A combination of molecular cytogenetic analyses reveals complex genetic alterations in conventional renal cell carcinoma. Cancer Genet Cytogenet. 2005;159:1-9. [PubMed] [DOI] |
| 13. | 赵 萌, 陈 冰, 王 璐, 徐 岚, 曹 琪, 苏 欣莹, 陈 赛娟. 多重荧光原位杂交技术体系的建立及其在检测白血病复杂核型异常中的应用. 中华医学遗传学杂志. 2002;19:375-378. |
| 14. | Muller S, Neusser M, Wienberg J. Towards unlimited colors for fluorescence in-situ hybridization (FISH). Chromosome Res. 2002;10:223-232. [DOI] |
| 15. | Yen CC, Chen YJ, Chen JT, Hsia JY, Chen PM, Liu JH, Fan FS, Chiou TJ, Wang WS, Lin CH. Comparative genomic hybridization of esophageal squamous cell carcinoma: correlations between chromosomal aberrations and disease progression/prognosis. Cancer. 2001;92:2769-2777. [PubMed] [DOI] |
| 16. | Noguchi T, Kimura Y, Takeno S, Chujo M, Uchida Y, Mueller W, Gabbert HE. Chromosomal imbalance in esophageal squamous cell carcinoma: 3q gain correlates with tumor progression but not prognostic significance. Oncol Rep. 2003;10:1393-1400. [PubMed] [DOI] |
| 17. | Wei F, Ni J, Wu SS, Liu H, Xu X, Han YL, Cai Y, Zhang JW, Chen XJ, Pang H. Cytogenetic studies of esophageal squamous cell carcinomas in the northern Chinese population by comparative genomic hybridization. Cancer Genet Cytogenet. 2002;138:38-43. [PubMed] [DOI] |