修回日期: 2006-02-10
接受日期: 2006-02-16
在线出版日期: 2006-03-08
目的: 建立一种简便、快速、实用的乙型肝炎病毒(HBV)阿德福韦(ADV)耐药变异-rtA181V变异的快速检测方法.
方法: 根据GenBank收录的HBV基因全序设计巢式PCR引物, 使野生株(rt181 A)PCR产物中含有BlpⅠ酶切位点(5,GCTNAGC3), 而变异株(rt181V)无此限制性酶切位点. 选取4份应用ADV治疗1 a以上出现HBV DNA反跳的临床耐药慢性乙型肝炎患者血清,经PCR扩增、BlpⅠ酶切、30 g/L琼脂糖凝胶电泳, 进行限制性片段长度多态性(RFLP)分析. 并选择经该方法鉴定的野生株及变异株各一例进行HBV RT区基因序列分析及对照质粒的构建.
结果: 自4份血清标本中检测到2例rtA181V变异. 所建立的ntPCR-RFLP方法灵敏度高, 可以检测到103 copies/L的HBV DNA; 特异性强, 其RFLP分析结果与DNA测序结果一致.
结论: 应用ntPCR-RFLP方法检测rtA181V变异具有灵敏、特异、简便的优点, 适用于ADV耐药变异的临床监测工作.
引文著录: 闫杰, 谢雯, 王磊, 王晶波, 冯鑫, 宋淑静, 刘顺爱, 魏红山. ntPCR-RFLP检测HBV阿德福韦耐药变异-rtA181V变异. 世界华人消化杂志 2006; 14(7): 714-717
Revised: February 10, 2006
Accepted: February 16, 2006
Published online: March 8, 2006
AIM: To establish a simple, accurate and practical method for the detection of adefovir dipivoxil resistance-associated mutation (rtA181V mutation) in hepatitis B virus.
METHODS: Four shares of serum were collected from patients who had been treated with adefovir dipivoxil for more than 1 year, and HBV DNA replication reoccurred. Two pairs of primers were designed to amplify the region of HBV reverse transcriptase codon 181(rt181) in order to introduce a BlpI restriction site upon PCR product of wild type (wt). After amplification, the PCR products were digested with BlpI and then subjected to electrophoresis. The patterns of rtA181V mutation were detected by restriction fragment length polymorphism (RFLP) analysis.
RESULTS: Of the 4 patients, rtA181V mutation was detected in 2 cases by the above method. The established nest PCR-RFLP assay could detect HBV DNA at the level of 103 copies/L. The result of RFLP analysis was in accordance with that of DNA sequencing.
CONCLUSION: The ntPCR-RFLP assay is a rapid, simple, specific and sensitive method for the detection of rtA181V mutation in HBV.
- Citation: Yan J, Xie W, Wang L, Wang JB, Feng X, Song SJ, Liu SA, Wei HS. Application of nest PCR-RFLP in the detection of adefovir dipivoxil resistance-associated mutation in hepatitis B virus. Shijie Huaren Xiaohua Zazhi 2006; 14(7): 714-717
- URL: https://www.wjgnet.com/1009-3079/full/v14/i7/714.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i7.714
抗乙型肝炎病毒(HBV)新药-阿德福韦酯(adefovir dipivoxil, ADV)已经国家食品药品管理局(SFDA)批准在我国上市. 临床研究表明ADV能有效地抑制HBV DNA复制, 使HBV DNA滴度迅速降低, 而且在出现拉米夫定(lamivudine)耐药的患者中ADV能继续有效地抑制变异株[1-3]. 但随着ADV的长期应用, 目前已发现该药亦存在耐药现象; 现已得到学术界公认的耐药株有两种: rtN236T变异和rtA181V变异[4-5]. 此前我们已建立了基于巢式聚合酶链反应-限制性片段长度多态技术(ntPCR-RFLP assay)的rtN236T变异快速检测方法[6]. 进一步应用该技术建立用于rtA181V变异的快速检测方法, 以期对ADV耐药变异进行更为全面的监测.
4份慢性乙型肝炎(CHB)血清取自北京地坛医院及济南传染病医院就诊患者. 4患者均应用ADV治疗1年以上, 治疗过程中曾出现HBV DNA阴转, 此后再次出现HBV DNA反跳.
胃采用异硫氰酸胍一步法提取血清中的DNA. 待检血清50 mL加入含4 mol/L异硫氰酸胍的裂解液60 mL,37℃温育10 min; 加入酚/氯仿/异戊醇(25∶24∶1)50 mL, 震荡混匀后13 000 g离心10 min; 取上清, 加入等量异丙醇, -20℃沉淀2 h, 13 000 g离心10 min, 弃上清; 加入600 mL/L 乙醇50 mL, 13 000 g离心10 min, 弃上清, 室温干燥后加入双蒸水20 mL溶解, -20℃保存.
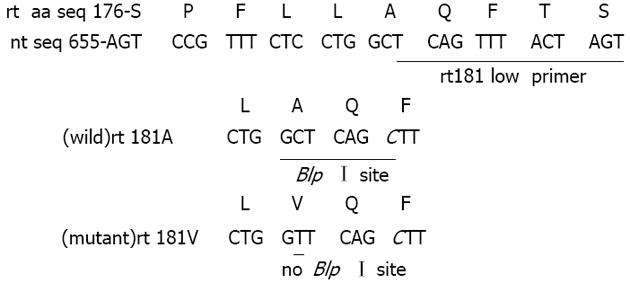
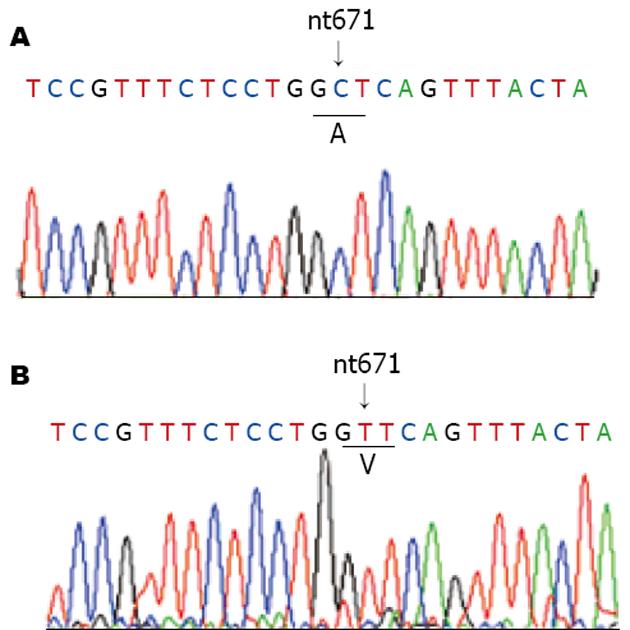
rtA181V变异是由于HBV基因组第671碱基由胞嘧啶(C)突变为胸腺嘧啶(T), 从而导致HBV聚合酶B区rt181氨基酸由丙氨酸(alanine, A)变异为缬氨酸(valine, V)(图1). 故而以此为基础, 检索GenBank收录的HBV基因全序, 采用Primer Premier 5.0及Oligo 6.67软件辅助分析, 设计巢式PCR引物(外引物: P1、P2, 内引物: rt181up, rt181low); 旨在使野生株(rt181 A)PCR产物中含有BlpⅠ酶切位点(5, GCTNAGC3, ), 而变异株(rt181V)无此限制性酶切位点(图1, 表1).
| 引物 | nt | 序列 |
| P1 | 105-122 | 5'CCTCACCCATATCGTCAA3' |
| P2 | 1 255-1 238 | 5'CCTCACCCATATCGTCAA3' |
| rt181up | 362-380 | 5'CCTGGT(C)TATCGC(T)TGGATGT 3' |
| rt181low | 692-672 | 5'TGAACAAATG(T)GCACTAGTAAGCTGA 3' |
以血清提取物为模板进行巢式PCR反应: 30 mL PCR反应体系含Taq酶1 U, 10×扩增缓冲液3 mL,25 mol/L dNTP 0. 12 mL、50 mmol/L引物0.12 mL; 第一轮PCR模板为血清提取物6 mL, 引物为P1, P2; 第二轮PCR模板为第一轮PCR产物3 mL, 引物为rt181up, rt181low. 两轮PCR循环条件均为94℃ 3 min, 94℃ 10 s, 53℃ 30 s, 72℃ 30 s, 共 30循环, 72℃ 7 min. 取第二轮PCR产物8 mL, 以10 g/L琼脂糖凝胶电泳, EB染色后于紫外灯下观察结果, 于331 bp处出现荧光条带者为阳性.
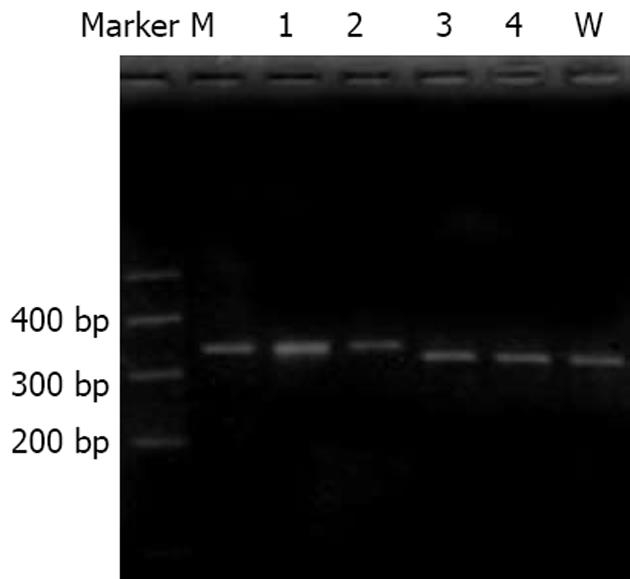
BlpⅠ酶切: 10 mL酶切反应体系内含第二轮PCR产物8 mL, BlpⅠ10 U, 酶切缓冲液1 mL, 于37℃酶切4 h. 将全部酶切产物以30 g/L琼脂糖凝胶电泳, EB染色后于紫外灯下观察结果. PCR产物经酶切后野生株较变异株缺失21 bp, 故电泳速度稍快.
对照质粒的构建: 同时采用PCR产物直接测序方法对经该方法鉴定的野生株及变异株进行HBV RT区基因序列分析(方法见参考文献[7], 序列测定由上海生工生物工程技术服务公司完成); 并将上述PCR产物纯化后与T-载体(美国Promega公司)连接, 构建重组质粒, 转化JM109菌, 经双脱氧末端终止法进行测序鉴定后用作对照质粒.
以不同HBV DNA浓度的血清提取物为模板进行PCR检测, 终检浓度为103 copies/L(HBV DNA荧光定量试剂盒购自深圳匹基生物技术公司), 表明该巢式PCR反应具有良好的灵敏度. 阳性标本PCR产物大小与预期值相符(331 bp), 表明该巢式PCR反应具有高度特异性. RFLP分析: BlpⅠ酶切后电泳结果显示, 4份血清标本中有2份被完全酶切, 为野生株(rt181A); 尚有2份未被酶切, 为变异株(rt181V)(图2). HBV RT区基因序列测定结果与RFLP分析结果一致(图3), 并将2条变异株RT区基因序列提交至GenBank, 其序列号(accession number)分别为: DQ343155、DQ343156.
随着ADV临床应用时间的延长, 与之相关的HBV耐药变异发生率亦逐年增多, 并且该类耐药变异的出现可能会导致严重的肝脏失代偿[8]. 我国HBV慢性感染患者众多, 在ADV广泛应用之前应建立完善的耐药监测体系以指导临床合理用药[9], 为此亟待建立一种简便、快速的ADV耐药变异检测方法. 目前得到学术界公认的耐药株有两种: rtN236T变异和rtA181V变异[4-5], 此前我们已建立了基于巢式聚合酶链反应-限制性片段长度多态技术(ntPCR-RFLP assay)的rtN236T变异快速检测方法[6]; 为了能够对ADV耐药变异进行更为全面的监测, 进一步应用该技术建立用于rtA181V变异的快速检测方法.
在技术路线方面, 仍采用用于检测rtN236T变异的ntPCR-RFLP技术和30 g/L琼脂糖凝胶电泳; 是因为基于上述技术的拉米夫定耐药变异检测方法已为国内众多实验室广泛应用, 具有灵敏、特异、简便、实用之优点[10-13], 故而采用该技术便于在国内推广, 建立全国性的完善的ADV耐药监测体系.
目前已有两种品牌的阿德福韦酯在我国上市, 随着用药时间的延长, 已有部分患者出现HBV DNA反跳, 甚至临床症状的加重. 我们应用ntPCR-RFLP技术检测4例服用ADV 1a以上出现临床耐药的患者血清中HBV变异情况, 发现2例rtA181V变异和1例rtN236T(将于另文报道); 可见对ADV耐药变异进行临床监测确系刻不容缓.
阿德福韦酯是抗HBV核苷类似物,目前发现HBV对该药存在耐药现象, 已得到学术界公认的耐药株有两种: rtN236T变异和r tA181V变异. 研究针对该药物的HBV耐药变异快速检测方法对指导临床合理用药意义重大.
本文应用ntPCRRF LP技术对rtA181V变异进行快速检测, 显示其具有灵敏、特异、简便、实用之优点.
本文针对常见的HBV的ADV耐药株建立了一种操作简单、反应灵敏的检测方法, 具有较好的实用性,具有推广价值.
电编: 李琪 编辑:潘伯荣
| 1. | Hadziyannis SJ, Tassopoulos NC, Heathcote EJ, Chang TT, Kitis G, Rizzetto M, Marcellin P, Lim SG, Goodman Z, Wulfsohn MS. Adefovir dipivoxil for the treatment of hepatitis Be antigen-negative chronic hepatitis B. N Engl J Med. 2003;348:800-807. [PubMed] [DOI] |
| 2. | Marcellin P, Chang TT, Lim SG, Tong MJ, Sievert W, Shiffman ML, Jeffers L, Goodman Z, Wulfsohn MS, Xiong S. Adefovir dipivoxil for the treatment of hepatitis Be antigen-positive chronic hepatitis B. N Engl J Med. 2003;348:808-816. [PubMed] [DOI] |
| 3. | Schiff ER, Lai CL, Hadziyannis S, Neuhaus P, Terrault N, Colombo M, Tillmann HL, Samuel D, Zeuzem S, Lilly L. Adefovir dipivoxil therapy for lamivudine-resistant hepatitis B in pre- and post-liver transplantation patients. Hepatology. 2003;38:1419-1427. [PubMed] |
| 4. | Angus P, Vaughan R, Xiong S, Yang H, Delaney W, Gibbs C, Brosgart C, Colledge D, Edwards R, Ayres A. Resistance to adefovir dipivoxil therapy associated with the selection of a novel mutation in the HBV polymerase. Gastroenterology. 2003;125:292-297. [PubMed] [DOI] |
| 5. | Villeneuve JP, Durantel D, Durantel S, Westland C, Xiong S, Brosgart CL, Gibbs CS, Parvaz P, Werle B, Trepo C. Selection of a hepatitis B virus strain resistant to adefovir in a liver transplantation patient. J Hepatol. 2003;39:1085-1089. [PubMed] [DOI] |
| 6. | 闫 杰, 冯 鑫, 王 磊, 宋 淑静, 谢 雯, 欧 蔚妮, 李 蕴铷. ntPCR-RFLP检测HBV阿德福韦耐药变异-rtN236T变异. 世界华人消化杂志. 2005;13:543-545. [DOI] |
| 7. | 闫 杰, 冯 鑫, 王 磊, 宋 淑静, 谢 雯, 李 蕴铷. 拉米夫定治疗中病毒核酸无应答患者体内乙型肝炎病毒逆转录酶基因变异分析. 世界华人消化杂志. 2005;13:130-132. [DOI] |
| 8. | Fung SK, Andreone P, Han SH, Rajender Reddy K, Regev A, Keeffe EB, Hussain M, Cursaro C, Richtmyer P, Marrero JA. Adefovir-resistant hepatitis B can be associated with viral rebound and hepatic decompensation. J Hepatol. 2005;43:937-943. [PubMed] [DOI] |
| 11. | 丁 静娟, 张 伟三, 张 莉莎. 乙型肝炎病毒耐拉米夫定多聚酶基因变异检测方法研究. 中华实验和临床病毒学杂志. 2004;18:24-27. |
| 12. | 赵 平, 李 捍卫, 楼 敏, 程 勇前, 兰 云, 福 军亮. 拉米夫定耐药的慢性乙肝患者联合干扰素或苦参素治疗疗效观察. 中华实验和临床病毒学杂志. 2004;18:80-82. |