修回日期: 2006-01-05
接受日期: 2006-01-14
在线出版日期: 2006-03-08
目的: 研究肝细粒棘球蚴(肝包虫)周围纤维囊壁中骨桥蛋白(osteopontin, OPN)的表达定位.
方法: 采用免疫印记法检测OPN在肝细粒棘球蚴(n = 48)周围纤维囊壁中的表达, 并结合免疫组化方法观察其组织学分布.
结果: 肝细粒棘球蚴周围纤维囊壁经免疫印记分析80%有OPN表达, 形态学观察集中分布于近虫体侧纤维性囊壁(内层), 与近肝侧纤维性囊壁(外层)比较有显著差异(75% vs 8.3%, P<0.05).
结论: OPN参与肝细粒棘球蚴周围内层纤维性囊壁肉芽肿反应的调节.
引文著录: 李建辉, 彭心宇, 唐娟, 吴向未, 张示杰, 牛建华, 孙红, 牛少雄, 吕游. 肝包虫周围纤维囊壁中骨桥蛋白免疫印记与组化分析. 世界华人消化杂志 2006; 14(7): 693-696
Revised: January 5, 2006
Accepted: January 14, 2006
Published online: March 8, 2006
AIM: To investigate the expression and distribution of osteopontin (OPN) in hepatic hydatid cyst and its significances.
METHODS: Proteins extracted from 60 surgically excised hydatid cyst tissues were subjected to polyacrylamide gel electrophoresis followed by Western blotting, using polyclonal antibodies directed against OPN; the distribution of OPN was also observed by immunohistochemical techniques.
RESULTS: OPN expression was detected in 48(80%) cases of cysts by Western blotting. OPN was mainly distributed in the side of pericystic layer near the parasite, which was significantly higher than that distributed near the liver (75% vs 8.3%, P < 0.05).
CONCLUSION: OPN plays a regulated role in the granuloma reaction of the pericystic layer of hepatic hydatid cyst.
- Citation: Li JH, Peng XY, Tang J, Wu XW, Zhang SJ, Niu JH, Sun H, Niu SX, Lv Y. Analysis of osteopontin in pericystic layer of hepatic hydatid cyst by Western blotting and immunohistochemical technique. Shijie Huaren Xiaohua Zazhi 2006; 14(7): 693-696
- URL: https://www.wjgnet.com/1009-3079/full/v14/i7/693.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i7.693
骨桥蛋白(osteopontin, OPN)是一个磷酸化的钙结合蛋白, 为骨的有机基质[1,2]. 最初发现OPN 与骨病理生理、一些肿瘤及心血管疾病的发生、发展相关, 近来一些学者研究发现OPN参与结核病、矽肺、血吸虫卵肉芽肿病灶的形成过程[3-11]. 前期研究初步证实肝包虫纤维囊壁分层且形成机制不同: 近肝侧外层纤维囊壁为受挤压的Glisson系统和肝静脉系统纤维化所致, 并初步认为近虫体侧内层纤维囊壁为肉芽肿反应的产物, 这一研究结果为"肝包虫外膜内完整摘除术"提供了初步的理论基础[12-17]. 我们采用免疫印记和免疫组化方法检测OPN在肝包虫周围纤维囊壁中的表达和分布, 旨在进一步探讨肝包虫周围纤维囊壁的形成机制.
电泳仪, 垂直电泳槽以及电泳转移槽(Bio-Rad公司), 低温高速离心机(Backman公司). 脱脂奶粉(伊犁牌产品), 三氨基甲烷(Tris), 丙烯酰胺、甲叉双丙烯酰胺(分析纯)、β2巯基乙醇、十二烷基硫酸钠(SDS)、低分于量标准蛋白和硝酸纤维素膜, 二硫苏糖醇(DTT)、苯甲基磺酰氟化物(PM SF)、B-巯基乙醇, Tween 20(上海生物工程有限公司); 兔抗人OPN多克隆抗体(效价为1∶200, 美国NeoMarkers公司, 福洲迈新生物技术有限公司提供); 辣根过氧化物酶标记的羊抗兔二抗(北京中杉生物有限公司). 二氨基联苯胺(DAB)(美国Sigma公司), EnVision免疫组化试剂盒(Dako, 美国). 我院2002/2005行肝包虫外膜内完整摘除术的肝包虫病患者60(男36, 女24)例, 年龄5-82岁.
标本来源及取材: 收集新鲜手术切除肝包虫囊肿60例, 实验标本均从囊壁多部位取材, 并包括肝包虫周围纤维囊壁及其邻近肝实质组织. 标本用40 g/L福尔马林固定, 石蜡包埋, 制成厚4-5 μm连续切片, 用于病理学检查. 同时一部分新鲜标本取材后立即置于液氮, 于-80℃冰箱保存, 用于免疫印记分析.
1.2.1 免疫印记分析: 样品缓冲液含100 mmoL/L Tris-HCI pH 6.8, 200 mL/L甘油, 2.5 g/L溴酚蓝, 200 mmol/L DTT. 取手术切除肝包虫周围纤维囊壁及周围正常肝组织分别称质量, 用冰生理盐水冲洗干净, 盛放在一干净培养皿中. 用经酒精消过毒的剪刀将组织块剪碎, 转移至组织研磨器中. 向研磨器中加入5倍组织块体积的生理盐水和苯甲基磺酰胺(PMSF)溶液, 将组织块研磨, 制成匀浆, 12 000 r/min离心10 min, 取上清为待检蛋白样品, -20℃保存. 沸水浴加热上清液, 使样品变性, 经SDS聚丙烯酰胺凝胶电泳(浓缩胶浓度150 g/L, 分离胶浓度100 g/L, 上样量每孔分别按20 mL). 电泳完毕, 小心剥下凝胶, 将凝胶在中央位置切为左右两半, 一半用于考马斯亮蓝染色, 脱色后拍照分析; 另一半用于下步实验. 将切好的另一半凝胶转膜至硝酸纤维膜(NC膜)上, NC膜经丽春红染色, 用防水性印度墨汁标出标准分子质量位置, 50 g/L脱脂奶粉PBS 溶液4℃封闭2 h, 兔抗人OPN多克隆抗体(1∶500)4℃缓摇孵育过夜, PBS洗膜3次, 每次15 min, 羊抗兔IgG-HRP(1∶1 000)室温缓摇2 h, PBS溶液清洗3次, 每次10 min, 加入DAB显色清晰后用EDTA缓冲液终止反应, PBS 和水冲洗薄膜后拍照分析, 室温下将膜晾干永久保存[18].
1.2.2 免疫组织化学定位: 采用免疫组织化学二抗-酶标多聚体(EnVision)二步法. 兔抗人骨桥蛋白(1∶100), 每批染色以磷酸盐缓冲液(PBS)代替一抗作阴性空白对照. 结果判断: 细胞质、膜、间质出现棕黄色颗粒为OPN表达阳性; 根据显色深浅划分为4级, 呈棕褐色或棕黄色反应分别为强阳性(+++)或阳性(++), 呈浅黄色反应为弱阳性(+), 无着色为阴性(-)[15-17].
统计学处理 统计学处理采用χ2检验, P<0.05为有统计学差异.
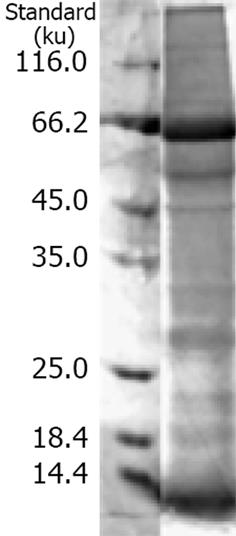
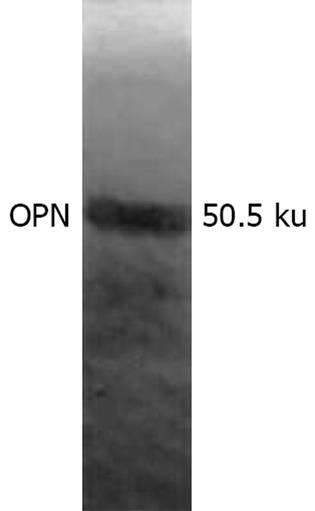
蛋白质电泳(SDS-PAGE)后, 考马斯亮蓝染色, 呈现清晰显色条带, 这些条带与转移到NC膜上的丽春红染色带相对应, 说明转移电泳成功(图1). 经抗人OPN多克隆抗体, 免疫印记结果显示48例(80%)内层纤维囊壁出现分子量约50.5 ku的特异阳性条带(图2, 结合电泳图经Quantity One软件初步确定分子质量), 相邻正常肝组织及近肝侧外层纤维囊壁未见该蛋白明确表达.
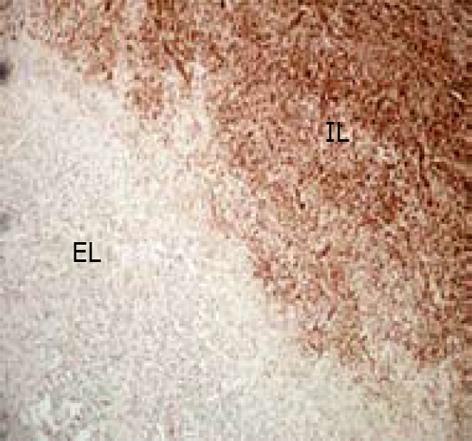
45例(75%)囊壁中观察到不同程度的OPN表达, OPN表达呈棕黄色片状, 集中分布于近虫体侧纤维性囊壁(内层), 近肝侧纤维性囊壁(外层)表达甚少, 二者比较有显著差异(P<0.05), 内外层交界处浸润细胞胞质亦有散在表达, 肝细胞未见明确表达(图3).
彭心宇在外科实践中发现肝包虫周围纤维性囊壁可分为内层和外层, 两层之间有可分离间隙存在, 沿此间隙可完整摘除包虫-"肝包虫外膜内完整摘除术"[12-14]. 该术式在达到根治目的同时, 极大减少了手术并发症, 明显优于其他根治性术式[19,20]. 基于这一发现, 我们对肝包虫周围纤维性囊壁形成机制的阶段性实验结果表明: 肝包虫周围纤维性囊壁分层, 且形成机制不同, 近肝侧外层纤维性囊壁主要以受挤压和纤维化的Glisson系统和肝静脉系统为主; 并观察到内层纤维性囊壁为肉芽肿反应为主[15-17]. 骨桥蛋白(osteopontin, OPN)是一个磷酸化的钙结合蛋白[1-2]. 最初发现OPN 与骨病理生理、一些肿瘤及心血管疾病发生、发展相关, 近来一些学者研究发现OPN可能通过调节巨噬细胞聚集, 参与结核病、矽肺、血吸虫卵肉芽肿病灶的形成过程[3-11]. 因电泳条件及蛋白表达翻译后修饰等因素, 文献报道OPN分子质量为45-75 ku[21,22].
本实验用免疫印记的方法检测到80%肝细粒棘球蚴周围纤维囊壁有OPN表达, 其分子量约为50.5 ku; 免疫组化染色观察OPN集中分布于近虫体侧纤维性囊壁(内层), 与近肝侧纤维性囊壁(外层)比较有显著差异(P<0.05). 其中3例免疫组化观察阴性的囊壁, 经免疫印记可检测到OPN的表达, 分析可能与实验方法检测灵敏度有关. OPN这种选择性分布的特点进一步证实肝包虫周围纤维性囊壁的分层, 且形成机制不同, 内层纤维性囊壁为肉芽肿反应的结果.
许多寄生虫感染都可引起宿主的肉芽肿反应, 但关于肉芽肿的定义与分类一直不十分明确. James[23]对肉芽肿的定义解释为"肉芽肿是一种由于非降解产物引起机体持续性超敏反应, 主要由炎症细胞, 单核细胞聚集形成的局限性病灶. Warren[24]根据肉芽肿的形成机制是否为免疫反应, 将肉芽肿分为免疫学的与非免疫学的二类. 沈一平[25]在Warren分类的基础上分为免疫性肉芽肿, 非特异炎症性肉芽肿及原因不明(包括未研究)的肉芽肿三类. 结合本实验及前期研究[15-17], 我们认为肝包虫内层纤维囊壁为特殊类型的肉芽肿反应的结果: 一方面作为宿主对致病因子的一种免疫应答, 该肉芽肿反应将虫体局限, 并能隔离和清除虫卵释放的抗原[26]; 另一方面, 由于其内部虫体不断生长导致该肉芽肿组织随之受压、膨大并逐渐增厚, 最终形成一层纤维囊壁(内层), 在内层纤维囊壁膨胀性形成过程中, 囊周Glisson系统和肝静脉系统受挤压并不断纤维化, 形成另一层纤维囊壁(外层).
本实验有12例未检测到囊壁中OPN的表达, 在相同样本进行的其他实验中表明, 该12例囊壁均未观察到明显钙盐沉积, OPN表达阳性的样本均合并有不同程度的钙化, 提示作为一种钙结合蛋白[27], OPN亦参与囊壁钙化的调节; 其表达与内层纤维囊壁形成进程某一阶段有关(未发表数据). 目前对肝包虫肉芽肿的形成机制及免疫调控的研究较少. 我们检测到OPN在囊壁中的表达, 虽然其生物学意义仍然需要进一步验证, 但为阐明肝包虫周围纤维囊壁形成机制提供了依据和新的线索. 深入研究将有助于了解虫体宿主免疫作用机制, 并对于开辟新的治疗途径具有潜在的理论意义和实用价值.
石河子大学医学院病理教研室, 李洪安, 蒋金芳两位研究员在本实验过程中给予的支持与帮助.
肝细粒棘球蚴病是一种在我国西北部牧区广泛流行的人畜共患寄生虫病. 由于目前尚无特效药物, 外科治疗仍为首选. 彭心宇在外科实践中发现肝包虫周围纤维性囊壁的病理组织结构与传统理论不符, 外囊可分为内层和外层, 两层之间有可分离间隙存在, 沿此间隙可完整摘除包虫-"肝包虫外膜内完整摘除术". 我们对肝包虫周围纤维性囊壁形成机制的阶段性实验结果表明: 肝包虫周围纤维性囊壁分层, 且形成机制不同, 近肝侧外层纤维性囊壁主要以受挤压和纤维化的Glisson系统和肝静脉系统为主; 并观察到内层纤维性囊壁以肉芽肿反应为主.
骨桥蛋白(osteopontin, OPN)是一个磷酸化的钙结合蛋白. 最初发现OPN与骨病理生理、一些肿瘤及心血管疾病发生、发展相关, 近来一些学者研究发现OPN参与结核病、矽肺、血吸虫卵肉芽肿病灶的形成过程, 研究表明在肉芽肿病理方面OPN可能调节巨噬细胞聚集, 而参与正常的肉芽肿形成.
在我们前期研究之基础上, 本研究进一步证实肝包虫周围纤维性囊壁可分为内外两层, 且形成机制不同, 内层为肉芽肿反应的结果, 为临床开展"肝包虫外膜内完整摘除术"提供新的理论依据.
本研究首次检测到肝包虫周围纤维性囊壁中有骨桥蛋白(OPN)表达, 为阐明肝包虫周围纤维囊壁形成机制提供了依据和新的线索, 深入研究将有助于了解虫体宿主免疫作用机制, 对于开辟新的治疗途径具有潜在的理论意义和实用价值.
肝包虫病属于自然疫源性疾病, 人类作为中间宿主而受害. 绝大多数细粒棘球绦虫(犬绦虫)的幼虫, 少数由泡状棘球绦虫的幼虫入侵肝后致病, 以形成寄生虫性肝包囊为特征, 故又分别称作肝棘球蚴病或肝泡球蚴病. 我国主要流行于西北、内蒙、西藏等牧畜地区, 20-40岁的青壮年就诊率较高, 男女之比约为2∶1. 该病已见于世界上许多国家,成为日趋严重的全球性问题.
本文为国家自然科学基金攻关项目的一部分, 学术价值较好, 有一定创新.
电编: 李琪 编辑:潘伯荣
| 1. | Oldberg A, Franzen A, Heinegard D. Cloning and sequence analysis of rat bone sialoprotein (osteopontin) cDNA reveals an Arg-Gly-Asp cell-binding sequence. Proc Natl Acad Sci USA. 1986;83:8819-8823. [PubMed] [DOI] |
| 2. | Mazzali M, Kipari T, Ophascharoensuk V, Wesson JA, Johnson R, Hughes J. Osteopontin-a molecule for all seasons. QJM. 2002;95:3-13. [PubMed] [DOI] |
| 3. | O'Regan A, Berman JS. Osteopontin: a key cytokine in cell-mediated and granulomatous inflammation. Int J Exp Pathol. 2000;81:373-390. [PubMed] [DOI] |
| 4. | O'Regan AW, Hayden JM, Body S, Liaw L, Mulligan N, Goetschkes M, Berman JS. Abnormal pulmonary granuloma formation in osteopontin-deficient mice. Am J Respir Crit Care Med. 2001;164:2243-2247. [PubMed] [DOI] |
| 5. | O'Brien KD, Kuusisto J, Reichenbach DD, Ferguson M, Giachelli C, Alpers CE, Otto CM. Osteopontin is expressed in human aortic valvular lesions. Circulation. 1995;92:2163-2168. [PubMed] [DOI] |
| 6. | Nau GJ, Guilfoile P, Chupp GL, Berman JS, Kim SJ, Kornfeld H, Young RA. A chemoattractant cytokine associated with granulomas in tuberculosis and silicosis. Proc Natl Acad Sci USA. 1997;94:6414-6419. [PubMed] [DOI] |
| 7. | Nau GJ, Chupp GL, Emile JF, Jouanguy E, Berman JS, Casanova JL, Young RA. Osteopontin expression correlates with clinical outcome in patients with mycobacterial infection. Am J Pathol. 2000;157:37-42. [PubMed] [DOI] |
| 8. | Diaz A, Willis AC, Sim RB. Expression of the proteinase specialized in bone resorption, cathepsin K, in granulomatous inflammation. Mol Med. 2000;6:648-659. [PubMed] |
| 9. | Harada K, Ozaki S, Sudo Y, Tsuneyama K, Ohta H, Nakanuma Y. Osteopontin is involved in the formation of epithelioid granuloma and bile duct injury in primary biliary cirrhosis. Pathol Int. 2003;53:8-17. [PubMed] [DOI] |
| 10. | Tanaka K, Morimoto J, Kon S, Kimura C, Inobe M, Diao H, Hirschfeld G, Weiss JM, Uede T. Effect of osteopontin alleles on beta-glucan-induced granuloma formation in the mouse liver. Am J Pathol. 2004;164:567-575. [PubMed] [DOI] |
| 11. | Morimoto J, Inobe M, Kimura C, Kon S, Diao H, Aoki M, Miyazaki T, Denhardt DT, Rittling S, Uede T. Osteopontin affects the persistence of beta-glucan-induced hepatic granuloma formation and tissue injury through two distinct mechanisms. Int Immunol. 2004;16:477-488. [PubMed] [DOI] |
| 16. | Wu XW, Peng XY, Zhang SJ, Niu JH, Sun H, Xi Y. Formation mechanisms of the fibrous capsule around hepatic and splenic hydatid cyst. Zhongguo Jishengchongxue Yu Jishengchongbing Zazhi. 2004;22:1-4. [PubMed] |
| 17. | 吴 向未, 陈 雪玲, 彭 心宇, 张 示杰, 牛 建华, 孙 红. TGF-β1、TNF-α mRNA在肝包虫囊肿周围人体纤维囊壁中的特异性分层表达. 中国地方病学杂志. 2004;23:311-313. |
| 19. | Buttenschoen K, Carli Buttenschoen D. Echinococcus granulosus infection: the challenge of surgical treatment Langenbecks. Arch Surg. 2003;388:218-230. [PubMed] [DOI] |
| 20. | Cirenei A, Bertoldi I. Evolution of surgery for liver hydatidosis from 1950 to today: analysis of a personal experience. World J Surg. 2001;25:87-92. [PubMed] [DOI] |
| 21. | Rittling SR, Feng F. Detection of mouse osteopontin by western blotting. Biochem Biophys Res Commun. 1998;250:287-292. [PubMed] [DOI] |
| 22. | Johnson GA, Burghardt RC, Joyce MM, Spencer TE, Bazer FW, Gray CA, Pfarrer C. Osteopontin is synthesized by uterine glands and a 45-kDa cleavage fragment is localized at the uterine-placental interface throughout ovine pregnancy. Biol Reprod. 2003;69:92-98. [PubMed] [DOI] |
| 23. | James DG. A clinicopathological classification of granulomatous disorders. Postgrad Med J. 2000;76:457-465. [PubMed] [DOI] |
| 24. | Warren KS. The secret of the immunopathogenesis of schistosomiasis: in vivo models. Immunol Rev. 1982;61:189-213. [PubMed] [DOI] |
| 26. | Vuitton DA. The ambiguous role of immunity in echinococcosis: protection of the host or of the parasite? Acta Trop. 2003;85:119-132. [PubMed] [DOI] |
| 27. | Makiishi-Shimobayashi C, Tsujimura T, Iwasaki T, Kakihana M, Shimano K, Terada N, Sakagami M. Localization of osteopontin at calcification sites of cholesteatoma: possible role as a regulator of deposition of calcium phosphate in the middle ear. Auris Nasus Larynx. 2004;31:3-9. [PubMed] [DOI] |