修回日期: 2005-12-20
接受日期: 2005-11-25
在线出版日期: 2006-02-28
目的: 检测其肠组织中巨噬细胞移动抑制因子(MIF), 核因子-κB(NF-κB)的表达, 探讨两者与溃疡性结肠炎(UC)的关系及MIF在UC发病机制中的作用.
方法: 采用三硝基苯磺酸(TNBS)溶液诱导大鼠溃疡性结肠炎模型,动物分为正常组, 轻、重模型组共三组. 每天观察各组疾病活动指数(DAI); 采用逆转录-聚合酶链式反应(RT-PCR)技术,对肠组织MIF的表达水平进行半定量测定; 应用免疫组织化学染色检测肠组织NF-κB的表达; 生化法检测髓过氧化物酶(MPO)活性.
结果: 正常组MPO活性, DAI, NF-κB及MIF mRNA的表达水平依次为0.38±0.18 U/g, 0.51±0.28, 0.18±0.05, 0.11±0.03; 模型Ⅰ组1.68±0.45 U/g, 5.04±0.73, 0.62±0.08, 0.65±0.04;模型Ⅱ组2.70±0.35 U/g, 8.13±0.71, 0.78±0.11, 0.81±0.05. 与正常组相比,模型组肠组织中MIF mRNA的表达显著增强(P<0.05), NF-κB和MPO活性及DAI也显著增高(P<0.05), 且在病情严重组增高尤为明显.
结论: MIF参与了溃疡性结肠炎的发病过程, 其机制可能与激活NF-κB, 诱导炎症细胞因子的过量表达有关.
引文著录: 黄超, 邓长生. 大鼠溃疡性结肠炎模型肠组织中MIF的表达和NF-κB的激活. 世界华人消化杂志 2006; 14(6): 621-625
Revised: December 20, 2005
Accepted: November 25, 2005
Published online: February 28, 2006
AIM: To detect the expression of macrophage migration inhibitory factor (MIF) and nuclear factor-κB (NF-κB) in the colon tissues of rats with ulcerative colitis, and investigate the role of MIF in pathogenesis of ulcerative colitis.
METHODS: Twenty-four Sprague-Dawley rats were randomly divided into three groups: normal group (n = 8), model groupⅠ(n = 8), model groupⅡ(n = 8); The rat in model groupⅠ and Ⅱ treated with 50 and 100 mg/kg 2,4,6-trinitrobenzene sulfonic acid (TNBS), respectively, to establish light and severe colitis model. The disease activity index (DAI) was calculated every day, and the expression of MIF in colon tissues was detected by semi-quantitative reverse transcription chain reaction (RT-PCR). The expression of NF-κB was examined by immunohistochemistry, and the myeloperoxidase (MPO) activity was detected by biochemistry.
RESULTS: In normal group, the MPO activity, DAI, NF-κB and MIF mRNA level were 0.38 ± 0.18 U/g, 0.51 ± 0.28, 0.18 ± 0.05 and 0.11 ± 0.03, respectively; in model groupⅠthey were 1.68 ± 0.45 U/g, 5.04 ± 0.73, 0.62 ± 0.08 and 0.65 ± 0.04, respectively; in model groupⅡthey were 2.70 ± 0.35 U/g, 8.13 ± 0.71, 0.78 ± 0.11 and 0.81 ± 0.05, respectively. In comparison with that in the normal controls, the expression of MIF mRNA increased significantly (P < 0.05), and the activity of NF-κB and MPO and DAI also increased significantly (P < 0.05) in model group, especially in model groupⅡ.
CONCLUSION: MIF may be involved in the pathogenesis of TNBS-induced ulcerative colitis and the mechanism may be correlated with NF-κB activation and excessive expression of inflammatory cytokine.
- Citation: Huang C, Deng CS. Expression of macrophage migration inhibitory factor and activation of nuclear factor-κB in colon tissues of rats with ulcerative colitis. Shijie Huaren Xiaohua Zazhi 2006; 14(6): 621-625
- URL: https://www.wjgnet.com/1009-3079/full/v14/i6/621.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i6.621
溃疡性结肠炎(ulcerative colitis, UC)是一种非特异性的肠道炎症性疾病, 其发病与免疫功能紊乱有关已得到普遍认同, 而具有免疫调节作用的细胞因子在UC的发病过程中起重要作用. 巨噬细胞移动抑制因子(macroPhage migration inhibitory factor, MIF)是较早发现的淋巴细胞因子之一. 现今认为, MIF是集细胞因子、生长因子、激素和酶特性于一身的多效能蛋白分子[1-2], 他具有多种生物活性, 如抑制活化的巨噬细胞游走、激活淋巴细胞、杀伤肿瘤细胞等, 并可诱导巨噬细胞等产生多种促炎因子, 以及抑制糖皮质激素的抗炎作用[3]. MIF在炎症性疾病的发生发展过程中起着不可忽视的作用, 近年来,国外研究[4-6]发现MIF与人类炎症性肠病(inflammatory bowel disease, IBD)的发病过程有关, 但具体发病机制不明. 在UC发生、发展过程中, 细胞因子扮演了重要角色, 且认为与基因启动子结合的核因子-κB(nuclear factor-κB, NF-κB)的异常活化有关, MIF与这些信号转导因子之间的关系如何, 我们通过建立大鼠UC模型, 初步探讨了MIF在UC发病过程中的可能机制.
24只成年SD♀大鼠, 体质量约150-200 g, 武汉大学动物实验中心提供; 2, 4, 6-三硝基苯磺酸(TNBS)、DEPC, 美国Sigma公司产品; NF-κB P65单克隆抗体, 北京中山试剂公司产品; MPO检测试剂盒, 南京建成生物工程公司产品; Trizol Reagent, 美国GIBCO公司产品; TaqDNA聚合酶、AMV逆转录酶、dNTP, 北京中山生物技术有限公司产品.
1.2.1 大鼠处理: 24只大鼠正常喂养, 随机分为正常组, 模型Ⅰ、Ⅱ组共3组, 每组8只: 正常对照组一直自由饮用蒸馏水, 模型组按照参考文献建立大鼠溃疡性结肠炎模型, 模型Ⅰ、Ⅱ组分别以含50 mg/kg、150 mg/kg TNBS的500 mL/L乙醇溶液缓慢推入结肠, 诱导轻重不同的溃疡性结肠炎模型, 灌肠后2 wk, 大鼠经水合氯醛麻醉后取出全结肠, 纵向剪开, 冲洗掉污物, 在病变严重处剪取一块, 甲醛固定, 石蜡包埋、切片、HE染色, 光镜下观察病理组织学变化, 再剪取病变范围内一块约500 mg的组织, 测定生化指标, 同时取30-50 mg肠黏膜提取RNA.
1.2.2 疾病活动指数(DAI)的评估: 每日观察大鼠的体质量, 大便性状和隐血情况, 按表1进行评分[7], 将体质量下降、大便性状和隐血情况的评分相加, 得出每只大鼠的DAI, 以评估疾病活动情况. 大便性状评分标准: (1)正常大便: 成形大便; (2)松软大便: 不黏附于肛门的糊状、半成形大便; (3)稀便: 可黏附于肛门的稀水样便.
| 体质量下降 (%) | 大便性状 | 大便隐血/肉眼血便 | 计分 |
| 0 | 正常 | 正常 | 0 |
| 1-5 | 松散 | 隐血阳性 | 1 |
| 5-10 | 2 | ||
| 10-15 | 稀便 | 肉眼血便 | 3 |
| >15 | 4 |
1.2.3 结肠黏膜MPO活性测定: 采用生化方法, 具体操作按试剂盒说明书进行.
1.2.4 肠组织NF-κB的表达: 采用免疫组织化学(SP法)染色, 严格按照试剂盒说明书要求操作, NF-κB P65抗体的稀释浓度为1:100, 已知阳性标本作为阳性对照, 以PBS缓冲液代替一抗作空白对照. 阳性细胞为细胞质或细胞核中出现棕黄色颗粒沉淀. 每张切片均应用医学彩色图像分析系统进行扫描分析, 每张切片随机取5个不重复的视野, 取其光密度的均值作为该切片的实验结果, 留待统计分析.
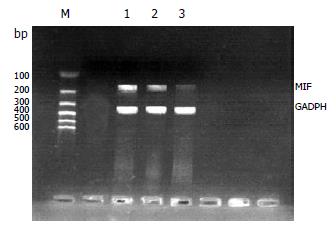
1.2.5 RNA提取和逆转录-聚合酶链式反应(RT-PCR): 按Trizol试剂盒说明书的要求提取总RNA, RNA样品的纯度用分光光度计根据在260 nm及280 nm吸光度的比值来判断, 确保比值在1.8-2.0之间. MIF引物由软件设计合成, 以GADPH为内参照, 引物序列及PCR产物如下: GADPH(330 bP), 上游引物: 5'-GATGGGTGTGAACCACGAGAAA 3', 下游引物: 5'-ACGGATACATTGGG-GGTAGGAA 3'; MIF(178 bP), 上游引物: 5'-TCTCCGCCACCATGCCTATG 3', 下游引物: 5'-GGGTCGCTCGTGCCACTAAA 3'. RT-PCR方法: 10×Buffer 2.5 μL, 2.5 mmol/L dNTP 1 μL, 上、下游引物各0.5 μL, DNA摸板1 μL, 三蒸水19 μL, Taq酶0.5 μL, 总反应体系25 μL. 在PCR扩增仪上完成. 反应条件为: 94 ℃预变性3 min后, 进入循坏, 94 ℃变性30 s, 55 ℃退火30 s, 72 ℃延伸45 s, 重复25个循环, 72 ℃延伸7 min, 终止反应. 取5 μL扩增产物常规进行2.5 g/L琼脂糖凝胶电泳. 用凝胶分析仪拍照, 并以MIF和GADPH DNA条带的光密度比值来表示MIF mRNA的表达水平.
统计学处理 所有数据经SPSS统计软件处理, 各组资料以mean±SD表示, 采用单因素方差分析, 组间差异采用q检验, P<0.05认为有统计学意义.
模型Ⅰ、Ⅱ组大鼠每天体质量增加值均小于正常对照组, 灌肠后第2 d出现大便松软, 有部分大鼠隐血试验阳性, 第6 d大部分出现腹泻及肉眼血便, 至处死仍不见减轻. 正常对照组无上述异常变化. 同正常对照组相比, 模型Ⅰ、Ⅱ组的DAI评分明显增加, 且在模型Ⅱ组更为明显(P<0.05), 各组的DAI评分结果见表2.
NF-κB表达阳性细胞主要为黏膜上皮细胞, 单核细胞及巨噬细胞. 阳性细胞胞质和胞核都含有棕色颗粒, 但以胞核为主. 正常组仅见少量的NF-κB表达, 而模型组表达水平明显增加, 且在模型Ⅱ组更为明显(P<0.05), 模型组MPO的活性也明显增加(P<0.05)(表2).
近年来, 越来越多的证据表明, 溃疡性结肠炎的发病机制可能与肠道黏膜对微生物抗原不正常免疫反应而造成的慢性炎症、遗传和环境因素有关. 其中免疫系统是引起肠道炎症与损伤的重要因素[8], 而细胞因子在调节肠道免疫中起重要作用. MIF是一种特殊的细胞因子, 他不属于目前已发现的任何细胞因子家族, 最近的研究显示, MIF由免疫系统的大多数细胞类型产生, 包括淋巴细胞、巨噬细胞、中性粒细胞、嗜酸性粒细胞、树突状细胞, 此外, MIF在很多组织中表达, 并可参与多种病理生理过程[9-10]. 在溃疡性结肠炎患者中, MIF可能具有促进巨噬细胞在局部肠黏膜浸润, 并通过这些巨噬细胞产生炎症细胞因子诱导肠黏膜损害的作用[11].
MPO主要存在于炎症细胞, 尤其是中性粒细胞的细胞质中, 其活性反映了组织中炎症细胞的浸润程度, 即炎症的活动程度, 被认作是量化炎症的一项重要指标[12]. DAI评分是用来评估疾病活动情况的指标. 我们采用TNBS/乙醇诱导形成大鼠溃疡性结肠炎, 并以不同剂量TNBS制备病情轻重不同的疾病模型, 本研究结果显示, 大鼠溃疡性结肠炎的DAI与MPO活性的检测结果呈一致性, 腹泻、便血越重, MPO活性越高, 且均具有显著差异性(P<0.05), 故根据症状可以推断疾病的严重程度. 本实验还显示随着大鼠病情程度的加重, 大鼠溃疡性结肠炎MPO活性, DAI评分等炎症指标与NF-κB及MIF mRNA表达同时增高, 提示NF-κB和MIF mRNA的表达与炎症程度相关.
Ohkawara et al[13]研究发现葡聚糖硫酸钠(DSS)诱导的MIF转基因小鼠, 其结肠黏膜MIF mRNA表达水平和血清MIF蛋白较DSS诱导的野生型小鼠明显增加, MPO活性也显著增强, 在克罗恩病和溃疡性结肠炎患者血浆MIF水平也较正常组明显增高, Ohkawara et al[5]通过免疫组化的方法, 在小鼠结肠炎肠组织的上皮细胞和渗出的免疫细胞可以观察到MIF的强阳性染色, 且中和MIF生物活性的抗MIF抗体明显减少小鼠结肠TNF-α、IFN-γ及基质金属蛋白酶的表达. 我们的实验结果表明, 与正常对照组相比, UC大鼠肠组织中MIF mRNA的表达明显增强(P<0.05), 且在大剂量TNBS的模型Ⅱ组尤为明显. 以上结果均提示MIF在UC的发病过程中起重要作用. 但MIF究竟是通过什么机制参与UC的发病过程, 目前仍不清楚.
NF-κB是一种具有基因转录调节作用的核蛋白, 可以调控多种炎性细胞因子的表达. 而在UC中能激活NF-κB的刺激尚未完全明确. 促进和抑制炎症细胞因子分泌失衡在UC的发病机制中起枢纽性的作用已得到公认. 而MIF可通过抑制糖皮质激素对胞液IκBα表达的上调, 拮抗糖皮质激素在NF-κB/IκBα信号转换通路中的效应, 促使NF-κB进入核内和相应DNA序列结合, 诱导大量炎性因子释放[14]. 研究发现[13]MIF加重DSS诱导的小鼠结肠炎, 可能部分经由中性粒细胞聚集和对糖皮质激素生物活性的抑制作用.
TOLL样受体4(TLR4)是脂多糖(LPS)的信号转换分子, 是LPS复合受体中的关键成分, 可活化NF-κB, 且发现TLR4/NF-κB信号传导通路是IBD发病过程中的重要环节. 有研究发现[15], 用MIF反义mRNA 质粒转染小鼠巨噬细胞RAW26417, 其MIF表达明显减少, TLR4 mRNA 和蛋白质的基线水平极度降低, NF-κB活性下降. 而我们的研究发现在UC大鼠结肠黏膜内, MIF的表达较对照组显著增加, 同时NF-κB的表达也明显增强(P<0.05), 这就从反方向证实了MIF可以调控NF-κB的表达, 而激活的NF-κB又可调控多种炎症细胞因子的释放. NF-κB是否调节MIF基因的表达还不清楚. 因此推测MIF在UC中的发病机制可能部分与活化NF-κB有关, 其可能的机制系通过抑制糖皮质激素诱导IκBα的合成, 促使NF-κB进入核内和相应DNA序列结合, 从而诱导大量炎性因子释放; 或通过LPS信号传导通路, 上调TLR4的表达, 导致NF-κB过度激活, 引起炎症因子的级联放大反应.
总之, 我们推测MIF与UC的发病关系密切, 对NF-κB的调控可能是其机制之一. 此外, 本研究显示在UC大鼠的肠黏膜内, MIF mRNA的表达与UC的炎症程度相关, 随着炎症程度的加重, MIF mRNA的表达逐渐增强, 提示该细胞因子的mRNA可作为临床上判断疾病严重程度和疗效的指标, 有潜在的临床实用价值. 业已证实[4], 抗MIF抗体可抑制小鼠实验性结肠炎的发展. 因此, 将MIF作为靶点有望成为治疗UC的新途径.
IBD病因和发病机制复杂, 涉及到免疫学、遗传学、内分泌学以及环境因素等多方面的问题. 目前免疫因素在IBD发病中的作用已经得到肯定且研究日益深入, 而细胞因子在炎症性肠病免疫发病过程中扮演重要角色, 他能诱导或激活T细胞和B细胞, 并能诱导多种致炎因子的产生, 使炎症局部的中性粒细胞和巨噬细胞聚集, 损害肠黏膜. 现已证实IBD中NF-κB具有调节细胞因子产生的作用.
1 IBD肠组织MIF的表达量可以反映肠组织的病理损害程度,对于IBD病情的评估, 可能具有潜在的指导意义.
2 为寻找有效药物治疗IBD提供新的途径: 应用抗MIF抗体或MIF反义mRNA以及MIF受体拮抗剂以阻止MIF的作用, 可能有治疗作用, 但需进一步探索.
国内对MIF的研究主要在系统性红斑狼疮, 狼疮性肾炎, 鼻咽癌等疾病方面, 而MIF参与IBD发病过程的研究尚未见报道. MIF在IBD中确切的发病机制还不清楚, 本文通过研究MIF和NF-kB在实验性大鼠结肠炎组织的表达及其相互关系, 探讨MIF介导IBD的致病作用.
该研究目的明确, 方法可行, 结果可靠, 对探讨溃疡性结肠炎的发病机制有一定帮助, 有一定创新性及可读性.
电编: 韩江燕 编辑:张海宁
| 1. | Ross R. Atherosclerosis - AN inflammatory disea-se. N Engl Med. 1999;340:115-126. |
| 2. | Meyer-Siegler KL, Leifheit EC, Vera PL. Inhibit-ion of macrophage migration inhibitory factor decreases proliferation and cytokine expression in bladder cancer cells. BMC Cancer. 2004;4:34. [PubMed] |
| 3. | Lue H, Kleemann R, Calandra T, Roger T, Bern-hagen J. Macrophage migration inhibitory factor (MIF): mechanisms of action and role in disease. Microbes Infect. 2002;4:449-460. [PubMed] |
| 4. | de Jong YP, Abadia-Molina AC, Satoskar AR, Clarke K, Rietdijk ST, Faubion WA, Mizoguchi E, Metz CN, Alsahli M, ten Hove T. Development of chronic colitis is dependent on the cytokine MIF. Nat Immunol. 2001;2:1061-1066. [PubMed] |
| 5. | Ohkawara T, Nishihira J, Takeda H, Hige S, Kato M, Sugiyama T, Iwanaga T, Nakamura H, Mizue Y, Asaka M. Amelioration of dextran sulfate sodium-induced colitis by anti-macrophage migration inh-ibitory factor antibody in mice. Gastroenterology. 2002;123:256-270. [PubMed] |
| 6. | Murakami H, Akbar SM, Matsui H, Onji M. Mac-rophage migration inhibitory factor in the sera and at the colonic mucosa in patients with ulcerat-ive colitis: clinical implications and pathogenic significance. Eur J Clin Invest. 2001;31:337-343. [PubMed] |
| 7. | Murano M, Maemura K, Hirata I, Toshina K, Nishikawa T, Hamamoto N, Sasaki S, Saitoh O, Katsu K. Therapeutic effect of intracolonically administered nuclear factor kappa B (p65) antisense oligonucleotide on mouse dextran sulphate sodium (DSS)-induced colitis. Clin Exp Immunol. 2000;120:51-58. [PubMed] |
| 8. | Targan SR, Karp LC. Defects in mucosal immunity leading to ulcerative colitis. Immunol Rev. 2005;206:296-305. [PubMed] |
| 9. | Murakami H, Akbar SM, Matsui H, Horiike N, Onji M. Macrophage migration inhibitory factor activates antigen-presenting dendritic cells and induces inflammatory cytokines in ulcerative colitis. Clin Exp Immunol. 2002;128:504-510. [PubMed] |
| 10. | Baugh JA, Bucala R. Macrophage migration inhi-bitory factor. Crit Care Med. 2002;30:S27-S35. [PubMed] |
| 11. | Donnelly SC, Bucala R. Macrophage migration inhi-bitory factor: a regulator of glucocorticoid activity with a critical role in inflammatory disease. Mol Med Today. 1997;3:502-507. [PubMed] |
| 12. | Opavsky MA, Martino T, Rabinovitch M, Penninger J, Richardson C, Petric M, Trinidad C, Butcher L, Chan J, Liu PP. Enhanced ERK-1/2 activation in mice susceptible to coxsackievirus-induced myoc-arditis. J Clin Invest. 2002;109:1561-1569. [PubMed] |
| 13. | Ohkawara T, Miyashita K, Nishihira J, Mitsuyama K, Takeda H, Kato M, Kondo N, Yamasaki Y, Sata M, Yoshiki T. Transgenic overexpression of macrophage migration inhibit-ory factor renders mice markedly more susceptible to experimental colitis. Clin Exp Immunol. 2005;140:241-248. [PubMed] |
| 14. | Daun JM, Cannon JG. Macrophage migration inhibit-ory factor antagonizes hydrocortisoneinduced incre-ases in cytosolic IkappaBalpha. Am J Physiol Regul Integr Comp Physiol. 2000;279:R1043-R1049. [PubMed] |