修回日期: 2006-01-01
接受日期: 2006-01-03
在线出版日期: 2006-02-28
目的: 观察并分析肝细胞生长因子(HGF)及其受体c-Met与表皮生长因子受体(EGFR)在溃疡性结肠炎(UC)活动和非活动阶段患者结肠黏膜的表达情况, 探讨其表达的临床意义.
方法: 根据改良Williams 疾病活动指数(DAI)将42例UC患者分为活动期(n = 25)和非活动期(n = 17)2组, 对照组(n = 20)为门诊健康体检者或肠易激综合征患者. 结肠镜下活检各组患者结肠黏膜组织, 采用免疫组化SABC法检测各组患者结肠黏膜HGF及c-Met表达; SP法检测EGFR及增殖细胞核抗原(PCNA)表达.
结果: 对照组、活动期UC患者、非活动期UC患者HGF阳性表达率分别为22%, 88%, 100%(χ2 = 62.84, P<0.01); c-Met阳性表达率分别为25%, 92%, 100%(χ2 = 62.34, P<0.01); EGFR阳性表达率分别为25%, 92%, 100%(χ2 = 54.34, P<0.01); PCNA过表达率分别为0, 36%, 100%(χ2 = 67.50, P<0.01), 组间比较差异显著. HGF, c-Met和EGFR在UC患者结肠黏膜表达与PCNA过表达正相关(r = 0.648, 0.645, 0.565, P<0.01).
结论: HGF, c-Met, EGFR及PCNA在非活动期UC患者结肠黏膜中的表达较活动期UC患者和对照组明显增加. HGF及其受体c-Met与EGFR在UC患者结肠炎症黏膜修复过程中可能起一定作用.
引文著录: 陈凡, 林琳, 张红杰, 叶晓霞, 赵伟志, 王涛, 杨希宁. 溃疡性结肠炎结肠黏膜修复中HGF, c-Met, EGFR的作用. 世界华人消化杂志 2006; 14(6): 594-599
Revised: January 1, 2006
Accepted: January 3, 2006
Published online: February 28, 2006
AIM: To investigate the expression of hepatocyte growth factor (HGF), c-Met and epidermal growth factor receptor (EGFR) in colonic mucosa from patients with active or inactive ulcerative colitis and their clinical significances.
METHODS: Forty-two patients with ulcerative colitis were divided into 2 groups (active: n = 25; inactive: n = 17) according to the modifi-ed Williams Disease Activity Index (DAI). Health examinees from outpatient department or patients hospitalized for irritable bowel syndrome were selected as controls. All colon-ic mucosa specimens were obtained from colonoscopic examination. SABC immuno-histochemistry was used to evaluate the expres-sion of hepatocyte growth factor and c-Met, and SP immunohistochemistry was used to evaluate the expression of epidermal growth factor recep-tor and proliferating cell nuclear antigen.
RESULTS: In control group, active and inactive ulcerative colitis group, the positive rates of HGF expression were 25%, 88% and 100%, respectively, and those of c-Met expression were 25%, 92% and 100%, respectively. There were significant differences among the above three groups (HGF: χ2 = 62.84, P < 0.01; c-Met: χ2 = 62.34, P < 0.01). The expression of EGFR in control group, active and inactive ulcerative colitis group were 25%, 92% and 100%, respect-ively, and those of PCNA were 0, 36%, and 100%, respectively. There also existed significant differences among the above three groups (χ2 = 54.34, P < 0.01; χ2 = 67.50, P <0.01). In addition, the expression of HGF, c-Met and EGFR in ulcerative colitis were significantly correlated with the over-expression of PCNA (r = 0.648, P < 0.01; r = 0.645, P < 0.01; r = 0.565, P < 0.01, respectively).
CONCLUSION: HGF, c-Met and EGFR may be involved in the repair process of inflamed mucosa in ulcerative colitis.
- Citation: Chen F, Lin L, Zhang HJ, Ye XX, Zhao WZ, Wang T, Yang XN. Roles of hepatocyte growth factor, c-Met and epidermal growth factor receptor in repair of colonic mucosa from patients with ulcerative colitis. Shijie Huaren Xiaohua Zazhi 2006; 14(6): 594-599
- URL: https://www.wjgnet.com/1009-3079/full/v14/i6/594.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i6.594
溃疡性结肠炎(ulcerative colitis, UC)确切发病机制迄今未完全阐明, 可能与黏膜上皮免疫反应异常以及黏膜损伤后保护重建功能失调有关. 关于UC结肠黏膜修复机制鲜有报道. 肝细胞生长因子(hepatocyte growth factor, HGF)能促进各种上皮细胞增殖, 包括胃肠道上皮细胞的重 建[1-4], HGF受体是原癌基因c-Met编码的酪氨酸激酶. 表皮生长因子受体(epidermal growth fa-ctor receptor, EGFR)是原癌基因erbB1编码的蛋白产物, 其配体表皮生长因子(epidermal growth factor, EGF)及转化生长因子-α(transforming growth factor-α, TGF-α)等与EGFR结合, 使其磷酸化激活, 调节细胞的分裂、分化和增殖[5]. 研究发现UC患者结肠炎症黏膜HGF, c-Met基因表达增强[6], EGFR表达亦增强[7], 增殖细胞核抗原(proliferating cell nuclear antigen, PCNA)反映细胞的增殖活性[8], 我们用免疫组织化学方法检测溃疡性结肠炎活动阶段和非活动阶段患者及对照组结肠黏膜组织中HGF, c-Met, EGFR, PCNA的表达, 分析UC结肠黏膜组织中HGF, c-Met, EGFR的表达与PCNA表达的相关性, 探讨这两种生长因子与受体在UC结肠炎症黏膜修复中的作用.
2001-05/2005-05在马钢医院消化科住院符合2000年成都会议溃疡性结肠炎诊断标准[9], 经电子结肠镜检查全部结肠并于结肠病变处活检, 病理学确诊的UC患者42例, 男31例, 女11例, 平均年龄42.3±15.7岁. 平均病程18.5±37.9 mo. 病变累及全结肠21例, 左半结肠5例, 直乙结肠9例, 直肠7例. 对照组(健康体检或肠易激综合征患者) 20例, 男12例, 女8例, 平均年龄48.6±15.2岁. 根据改良Williams疾病活动指数(diseased activity index, DAI)[10]将UC患者分为活动期和非活动期2组, 大于9分为活动期, 小于或等于8分为非活动期, 分组后活动阶段患者25例, 非活动阶段患者17例. 对照组与UC组患者的性别构成、平均年龄比较无统计学意义, 2组资料具有可比性.
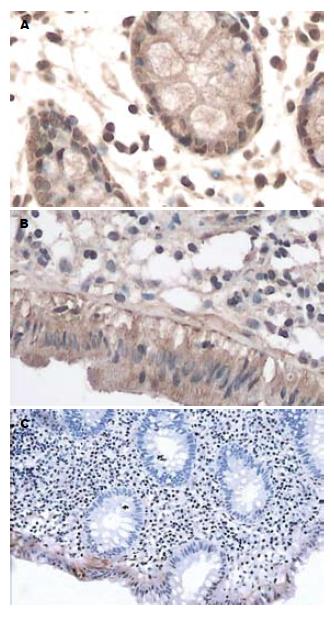
电子结肠镜下UC组在结直肠黏膜炎症最明显处, 对照组在直乙交界处取肠黏膜组织2-3块, 以40 g/L甲醛固定, 送病理检查. 常规石蜡包埋, 每块组织均作连续4 μm厚切片, 经HE染色再次确诊. HGF及c-Met检测采用免疫组化SABC法, HGF及c-Met一抗工作液浓度为1:100, DAB显色, 阳性对照用己知HGF及c-Met阳性的肝癌组织切片, 用PBS代替一抗作为阴性对照. 兔抗人HGF、c-Met多克隆抗体、SABC试剂盒购自武汉博士德生物工程有限公司. 严格按照试剂盒说明书操作. EGFR和PCNA检测采用免疫组化SP法, DAB显色, 阳性对照用己知EGFR及PCNA阳性的鳞癌组织切片, 用PBS代替一抗作为阴性对照. 即用型鼠抗人EGFR、PCNA mAb、SP试剂盒、DAB显色试剂盒购自福州迈新生物技术开发有限公司. 严格按试剂盒说明书操作. 阳性反应物呈棕黄色颗粒, HGF, c-Met及EGFR免疫阳性反应位于胞质及胞膜; PCNA免疫阳性反应位于胞核. 每张切片随机选取5个高倍镜视野, 盲法观察计数阳性反应的上皮细胞. HGF, c-Met或EGFR阳性细胞数/所有上皮细胞数≤5%时记为0, ≤50%为1, >50%为2; 根据染色强度记为不着色0, 黄色为1, 棕色为2; 两者相加: 0-1为阴性、2-3为阳性、4为强阳性. PCNA阳性核染色细胞数/所有上皮细胞数≤25%时为Ⅰ级, 26%-50%为Ⅱ级, 51%-75%为Ⅲ级, ≥76%为Ⅳ级, Ⅲ级和Ⅳ级为PCNA过表达.
统计学处理 所有数据用SPSS 13统计软件分析, HGF, c-Met, EGFR, PCNA在对照组、活动期UC患者和非活动期UC患者结肠黏膜组织表达阳性率之间比较用χ2检验或Fisher精确概率计算法检验; 等级资料分析: 2组之间的比较用非参数检验中Krushal-Wallis检验, 3组间等级资料之间的比较用非参数检验中Mann-Whitney检验, HGF, c-Met, EGFR, PCNA在UC结肠黏膜组织中表达的相关性用相关性检验中Spearman进行分析, 检验水准P≤0.05认为差异有统计学意义.
对照组HGF, c-Met, EGFR阳性表达频率为4/20, 5/20, 5/20; 活动期UC患者结肠黏膜组织中HGF, c-Met, EGFR阳性表达频率为22/25, 23/25, 23/25; 非活动期UC结肠黏膜组织中HGF, c-Met, EGFR全部表达为阳性. 对照组、活动期UC组、非活动期UC组HGF, c-Met, EGFR阳性表达率逐渐上升, 组间比较差异显著(P<0.01, 表1, 图1).
对照组结肠黏膜增殖活性最低, 16例PCNA表达Ⅰ级; 活动期UC结肠黏膜增殖活性增强, PCNA过表达频率为9/25; 非活动期UC结肠黏膜组织PCNA全部为过表达. 对照组、活动期UC患者、非活动期UC患者结肠黏膜组织PCNA过表达率依次上升, 组间比较差异显著(P<0.01, 表2).
UC的特征是黏膜上皮的损伤和破坏导致细菌及食物抗原直接侵入黏膜的免疫系统引起炎症反应[11], 结肠黏膜炎症持续活动以及黏膜修复功能失调, 是造成UC治疗困难的主要原因. 生长因子及其受体在细胞增殖、运动、损伤修复、细胞外基质形成、溃疡愈合及免疫调节等方面起重要作用. 正常情况下, 胃肠道表面细胞脱落造成的细胞缺失由细胞的不断更新而达到动态平衡, 这种动态平衡与生长因子的作用有关. HGF可刺激胃肠道上皮细胞增殖, 促进胃肠道黏膜损伤的愈合[1,12,13]. 本研究结果显示活动期UC患者结肠黏膜组织HGF及其受体c-Met表达较对照组增高, 非活动期UC患者结肠黏膜组织较活动期UC患者结肠黏膜组织表达亦增高, 提示HGF、c-Met可能参与UC结肠炎症黏膜的修复. Oh et al[14]用人HGF cDNA转染实验性结肠炎大鼠后诱导出肠道c-Met酪氨酸磷酸化, 抑制凋亡, 促进肠上皮细胞有丝分裂和重建功能, 表明HGF通过与受体c-Met结合发挥作用; HGF cDNA转染还明显抑制Th1细胞因子mRNA的表达, 如IL-12, IL-1β, TNF-α, INF-γ等, 调节促炎细胞因子与抗炎细胞因子之间的平衡. Ortega-Cava et al[15]研究发现用5%DSS饲养大鼠7 d, 大鼠出现腹泻、血便、体质量下降等严重的大肠炎症状, 停止DSS喂养后大肠炎症状逐渐减轻, HGF, IL-1β, TNF-α, Cox-2的表达明显增加, 并伴随结肠增殖上皮细胞数目增加, 由此得出结论: 促炎细胞因子和Cox-2可能启动结肠炎症黏膜中HGF基因表达, 通过增加HGF的产生, 在UC炎症黏膜修复中起作用.
促炎细胞因子IL-1, IL-6, IL-8, TNF-α在UC结肠炎症黏膜表达增加[16-17], IL-1, TNF-α能刺激纤维原细胞产生HGF[18], HGF mRNA在UC患者结肠黏膜的水平与结肠黏膜中炎症细胞特别是中性粒细胞浸润程度相关[6]; 离体实验中, c-Met基因表达由IL-1、IL-6、TNF-α等上调[19], 表明UC结肠炎症黏膜中HGF基因及c-Met基因表达是由炎症因子介导并启动的. 重组人HGF静脉注射或腹腔灌注治疗大鼠实验性UC, 均可加速结肠黏膜c-Met酪氨酸磷酸化作用, 结肠上皮细胞重建加快, 减轻炎症细胞浸润, 减轻症状及黏膜损伤, PCNA免疫染色证实结肠上皮细胞增殖明显增强[20-21]. HGF-Met系统可加快结肠黏膜的修复, 尽快恢复结肠上皮屏障功能, 减少黏膜上皮接触肠腔内造成炎症持续的各种抗原, 减轻炎症反应而起到治疗作用.
Babyatsky et al[22]发现TGF-α在非活动期UC患者结肠黏膜中表达较活动期UC患者及对照组增高2-3倍, 且随病程的延长表达增加. EGF可促进UC溃疡修复[23-24]. EGF和TGF-α需要与他们共同的受体EGFR结合, 激活EGFR发挥作用. 研究显示UC结肠黏膜损伤的早期阶段EGFR表达即增加, 支持EGF、TGF-α和EGFR在结肠黏膜保护及修复过程中起重要作用这一观点[7]. 本研究显示活动阶段UC患者结肠黏膜EGFR表达比对照组增高, 非活动阶段UC患者结肠黏膜EGFR表达比活动阶段UC增高, 与上述文献结论一致, 提示EGFR在UC结肠炎症黏膜修复过程中起一定作用. 近来研究发现EGFR可激活肠黏膜上皮细胞的离子通道, 促进钠离子的吸收, 减轻UC的腹泻症状[25]. PCNA反映细胞的增殖活性. 本研究发现PCNA在UC患者活动阶段的结肠组织中表达增加, 而在UC非活动阶段较活动阶段结肠组织中表达明显增强, 证实结肠黏膜上皮细胞增殖可促进结肠黏膜损伤的修复. 本实验还显示: HGF, c-Met和EGFR阳性表达强度与PCNA过表达明显正相关, 表明生长因子及其受体的酪氨酸磷酸化作用有助于结肠上皮增殖及黏膜修复.
慢性持续型溃疡性结肠炎病程中, 活动性炎症往往持续存在, 结肠黏膜的损伤和修复不断重复进行, 增加发生结肠癌的风险[26-28]. Kitamura et al[6]证实UC患者结肠炎症部位的黏膜HGF及c-Met表达增加, 而发生在UC基础上的结肠癌病变部位c-Met过表达, 提示c-Met在UC病人结肠炎症组织中, 可能兼有炎症黏膜修复和发生结直肠癌的双重作用.
Malecka-Panas et al[29]研究缓解期UC、腺瘤型结肠息肉及结肠腺癌3组患者以及对照组结肠黏膜PCNA指数及EGFR酪氨酸激酶活性时发现前两组患者表达比对照组增高, 在结肠腺癌表达更明显增高, 表明EGFR酪氨酸激酶的磷酸化作用可能是了解结肠黏膜癌变倾向的一个早期信号. EGFR受体信号通路不仅促进细胞增殖, 且抑制细胞凋亡, 在损伤修复和癌症发生机制中均起一定的作用[30].
由此可见, 适当的HGF/c-Met系统和EGFR表达在UC结肠黏膜组织损伤修复中起关键作用, 过度不恰当的表达可能在细胞的恶性转化中起作用, 促进溃疡性结肠炎相关性结直肠癌的发生. 溃疡性结肠炎是一种慢性炎症性疾病, 也是公认的癌前病变; 炎症反复发作, 结肠黏膜不断破坏和修复, 可能导致HGF/c-Met和erbB1基因突变及表达产物的积聚[6,31], 上皮细胞出现无限制增殖并向恶性细胞转化发生癌变, 其病理机制未完全阐明.
临床上常用结肠镜监控慢性溃疡性结肠炎相关性结直肠癌变的发生, 需要长期定期检查, 患者依从性较差. 我们设想若能找出HGF/c-Met系统和EGFR在溃疡性结肠炎结肠黏膜损伤修复与结肠上皮细胞恶性转化之间的关系及机制, 结合结肠镜随访, 可能早期发现和干预溃疡性结肠炎相关性结直肠癌的发生, 值得进一步研究.
溃疡性结肠炎(UC)近年来在我国乃至亚洲发病率逐渐上升, 部分患者可发生溃疡性结肠炎相关性大肠癌变. UC发病机制迄今未完全阐明, 治疗棘手, 探讨生长因子在UC结肠黏膜损伤后修复重建机制, 对于开发生长因子类药物治疗UC提供一定的理论依据.
1 Kitamura S, Kondo S, Shinom-ura Y, Isozaki- K, Kanayama- S, Higashim-oto Y, Minami T, Kiyohara T, Ya-sunaga Y, Ishi-kawa H, Ohtani T, Ishiguro S, Ma-tsuzawaY. Ex-pression of he-patocyte growth factor and cmet in ulcerative colitis. InflammRes 2000; 49: 320-324
2 Hoffmann P, Reinshagen M, Zeeh JM, Laksh-manan J, Wu VS, Goebell, Gerk-en G, Eysselein VE. Increased expression of epidermal growth factor-receptor in an experimental model of colitis in rats. Scand J Gastroenter-ol 2000; 35: 1174-1180
相关文章多为用外源性生长因子治疗UC, 本文将确诊的UC患者分为结肠黏膜炎症活动期和非活动期2组, 检测结肠黏膜HGF, c-Met, EGFR的阳性表达差异, 了解内源性生长因子及受体在UC结肠黏膜炎症修复中的作用.
进一步分析研究UC相关性大肠癌患者结肠黏膜HGF, c-Met, EGFR表达, 找出HGF/c-Met系统和EGFR在UC结肠黏膜损伤修复与结肠上皮细胞恶性转化之间的关系及机制, 结合结肠镜随访, 可能早期发现和干预UC相关性结直肠癌的发生.
UC相关性大肠癌: 是UC严重并发症, 指发生在慢性反复发作UC基础上的结直肠癌变, 发病机制不同于散发性结直肠癌.
HGF, c-Met, EG-FR在UC结肠黏膜修复中的作用已有类似报道, 本文通过观察上述指标UC活动和非活动阶段患者结肠黏膜的表达差异, 提出内源性生长因子及受体在UC结肠炎症修复中具有一定的作用和临床意义, 有一定参考价值.
电编: 韩江燕 编辑:潘伯荣
| 1. | Kuenzler KA, Pearson PY, Schwartz MZ. Hepat-ocyte growth factor pretreatment reduces apo-ptosis and mucosal damage after intestinal is-chemiareperfusion. J Pediatr Surg. 2002;37:1093-1097;. [PubMed] |
| 2. | Hanawa T, Suzuki K, Kawauchi Y, Takamura M, Yoneyama H, Han GD, Kawachi H, Shimizu F, Asakura H, Miyazaki JI. Attenuation of mouse acute colitis by naked hepa-tocyte growth factor gene transfer into the liver. J Gene Med. 2006;. [PubMed] |
| 3. | Jones MK, Tomikawa M, Mohajer B, Tarnawski AS. Gastrointestinal mucosal regeneration: role of growth factors. Front Biosci. 1999;4:D303-D309. [PubMed] |
| 4. | Ido A, Numata M, Kodama M, Tsubouchi H. Mucosal repair and growth factors: recombinant human hepatocyte growth factor as an innovative therapy for inflammatory bowel disease. J Gastroent-erol. 2005;40:925-931. [PubMed] |
| 5. | Sutter AP, Hopfner M, Huether A, Maaser K, Scherubl H. Targeting the epidermal growth factor receptor by erlotinib (Tarcevatrade mark) for the treatment of esophageal cancer. Int J Cancer. 2006;118:1814-1822. [PubMed] |
| 6. | Kitamura S, Kondo S, Shinomura Y, Isozaki K, Kanayama S, Higashimoto Y, Minami T, Kiyohara T, Yasunaga Y, Ishikawa H. Expression of hepatocyte growth factor and c-met in ulcerative colitis. Inflamm Res. 2000;49:320-324. [PubMed] |
| 7. | Hoffmann P, Reinshagen M, Zeeh JM, Lakshma-nan J, Wu VS, Goebell H, Gerken G, Eysselein VE. Increased expression of epidermal growth factor-receptor in an experimental model of colitis in rats. Scand J Gastroenterol. 2000;35:1174-1180. [PubMed] |
| 8. | Furihata T, Kawamata H, Kubota K, Fujimori T. Evaluation of the malignant potential of aberrant crypt foci by immunohistochemical staining for beta-catenin in inflammation-induced rat colon carcinogenesis. Int J Mol Med. 2002;9:353-358. [PubMed] |
| 12. | Mukoyama T, Kanbe T, Murai R, Murawaki Y, Shimomura T, Hashiguchi K, Saeki T, Ichiba M, Yoshida Y, Tanabe N. Therapeutic effect of adenoviral-mediated hepato-cyte growth factor gene administration on TNBS-induced colitis in mice. Biochem Biophys Res Commun. 2005;329:1217-1224. [PubMed] |
| 13. | Kuroiwa T, Kakishita E, Hamano T, Kataoka Y, Seto Y, Iwata N, Kaneda Y, Matsumoto K, Nakamura T, Ueki T. Hepatocyte growth factor ameliorates acute graft-versus-host disease and promotes hematopoietic function. J Clin Invest. 2001;107:1365-1373. [PubMed] |
| 14. | Oh K, Iimuro Y, Takeuchi M, Kaneda Y, Iwasaki T, Terada N, Matsumoto T, Nakanishi K, Fujimoto J. Ameliorating effect of hepatocyte growth factor on inflammatory bowel disease in a murine model. Am. J Physiol Gastrointest Liver Physiol. 2005;288:G729-G735. [PubMed] |
| 15. | Ortega-Cava CF, Ishihara S, Kawashima K, Ru-mi MA, Kazumori H, Adachi K, Kinoshita Y. Hepa-tocyte growth factor expression in dextran sodium sulfate-induced colitis in rats. Dig Dis Sci. 2002;47:2275-2285. [PubMed] |
| 16. | Autschbach F, Giese T, Gassler N, Sido B, Heuschen G, Heuschen U, Zuna I, Schulz P, Weckauf H, Berg-er I. Cytokine/chemokine mes-enger-RNA expression profiles in ulcerative col-itis and Crohn's disease. Virchows Arch. 2002;441:500-513. [PubMed] |
| 17. | Kwon KH, Murakami A, Hayashi R, Ohigashi H. Interleukin-1beta targets interleukin-6 in progre-ssi-ng dextran sulfate sodium-induced experimental colitis. Biochem Biophys. Res Commun. 2005;337:647-654. [PubMed] |
| 18. | Tamura M, Arakaki N, Tsubouchi H, Takada H, Daikuhara Y. Enhancement of human hepat-ocyte growth factor production by interleukin-1 alpha and -1 beta and tumor necrosis factoralpha by fibroblasts in culture. J Biol Chem. 1993;268:8140-8145. [PubMed] |
| 19. | Moghul A, Lin L, Beedle A, Kanbour-Shakir A, DeFrances MC, Liu Y, Zarnegar R. Modulation of c-MET proto-oncogene (HGF receptor) mRNA ab-undance by cytokines and hormones: evidence for rapid decay of the 8 kb c-MET transcript. Oncogene. 1994;9:2045-2052. [PubMed] |
| 20. | Tahara Y, Ido A, Yamamoto S, Miyata Y, Uto H, Hori T, Hayashi K, Tsubouchi H. Hepatocyte growth factor facilitates colonic mucosal repair in experimental ulcerative colitis in rats. J Pharmacol Exp Ther. 2003;307:146-151. [PubMed] |
| 21. | Numata M, Ido A, Moriuchi A, Kim I, Tahara Y, Yamamoto S, Hasuike S, Nagata K, Miyata Y, Uto H. Hepatocyte growth factor facilitates the repair of large colonic ulcers in 2, 4, 6-trinit-robe-nzene sulfonic acid-induced colitis in rats. Inflamm Bowel Dis. 2005;11:551-558. [PubMed] |
| 22. | Babyatsky MW, Rossiter G, Podolsky DK. Expres-sion of transforming growth factors alpha and beta in colonic mucosa in inflammatory bowel disease. Gastroenterology. 1996;110:975-984. [PubMed] |
| 23. | Sinha A, Nightingale J, West KP, Berlanga-Acosta J, Playford RJ. Epidermal growth factor enemas with oral mesalamine for mild-to-moderate left-sided ulcerative colitis or proctitis. N Engl J Med. 2003;349:350-357. [PubMed] |
| 24. | Castagliuolo I, Morteau O, Keates AC, Valenick L, Wang CC, Zacks J, Lu B, Gerard NP, Pothoulakis C. Protective effects of neurokinin-1 receptor during colitis in mice: role of the epidermal growth factor receptor. Br J Pharmacol. 2002;136:271-279. [PubMed] |
| 25. | McCole DF, Rogler G, Varki N, Barrett KE. Epi-de-rmal growth factor partially restores colonic ion transport responses in mouse models of chronic colitis. Gastroenterology. 2005;129:591-608. [PubMed] |
| 26. | Watanabe T, Nagawa H. Epidemiology of ulcerative colitis-comparison between Japan and western countries. Nippon Rinsho. 2005;63:750-756. [PubMed] |
| 27. | Chambers WM, Warren BF, Jewell DP, Mortensen NJ. Cancer surveillance in ulcerative colitis. Br J Surg. 2005;92:928-936. [PubMed] |
| 28. | Rosman-Urbach M, Niv Y, Birk Y, Morgenstern S, Schwartz B. Relationship between nutritional habits adopted by ulcerative colitis relevant to cancer development patients at clinical remission stages and molecular-genetic parameters. Br J Nutr. 2006;95:188-195. [PubMed] |
| 29. | Malecka-Panas E, Kordek R, Biernat W, Tureaud J, Liberski PP, Majumdar AP. Differential activation of total and EGF receptor (EGF-R) tyrosine ki-nase (tyr-k) in the rectal mucosa in patients with adenomatous polyps, ulcerative colitis and colon cancer. Hepatogastroenterology. 1997;44:435-440. [PubMed] |
| 31. | Trzcinski R, Bry M, Krajewska W, Kulig M, Dzyiki A. ErbB-1 expression in experimental model of inf-lammatory bowel disease in rats. Acta Chir Iugosl. 2004;51:85-89. [PubMed] |