修回日期: 2005-09-29
接受日期: 2005-09-30
在线出版日期: 2006-02-28
目的: 研究间隙连接蛋白Cx32, Cx43表达水平对胃癌侵袭转移潜能的影响.
方法: 采用免疫组化SP法和间接免疫荧光方法分别检测Cx32, Cx43在正常胃组织及不同病理分型的胃癌组织和不同分化程度胃癌细胞株中的表达, 并分析该蛋白表达对胃癌侵袭转移潜能的影响.
结果: 免疫组化SP法结果显示: Cx32, Cx43阳性棕黄色颗粒位于细胞膜和细胞质内, 在正常胃组织中的阳性表达率显著高于胃癌组织(Cx32: χ2 = 23.1, P<0.05, Cx43: χ2 = 11.6, P<0.05), Cx32, Cx43在高中分化胃癌的阳性表达率显著高于低分化胃癌(Cx32: χ2 = 32.1, P<0.05; Cx43: χ2 = 22.6, P<0.05). 间接免疫荧光法结果显示: 在转化的人胃细胞系(GES-1)、胃高分化腺癌细胞系(N87)中Cx32, Cx43的表达均为阳性, 但表达率和表达部位有显著差异. 在GES-1中Cx32, Cx43绿色荧光沿其细胞膜呈颗粒状或细线状分布, 其阳性表达率均为100%; 在N87中, Cx32绿色荧光沿其细胞膜呈颗粒状或细线状分布, 其阳性表达率为49%, 而Cx43荧光分布在其细胞质中, 其阳性表达率为55%; 在BGC-823中Cx32, Cx43的表达均为阴性.
结论: Cx32, Cx43是影响胃癌转移潜能的一个重要因素.
引文著录: 吴瑾, 王翠华, 周红凤, 刘丹, 王雯, 张波, 隋广杰. 间隙连接蛋白32, 43的表达对胃癌侵袭转移潜能的影响. 世界华人消化杂志 2006; 14(6): 557-562
Revised: September 29, 2005
Accepted: September 30, 2005
Published online: February 28, 2006
AIM: To investigate the relationship between the expression of connexin (Cx) 32 and 43 and metastatic potential of gastric cancer.
METHODS: Indirect immunofluorescent method and SP immunohistochemistry were used to examine the expression of Cx32 and Cx43 in gastric tissues from normal controls and patients with carcinoma of variously differentiated grades as well as in the gastric cancer cells of variously differentiated degree, and the relations of Cx expression with metastatic potential of gastric cancer were analyzed.
RESULTS: Immunohistochemistry showed that the positive staining of Cx32 and Cx43 was located at cell membrane and cytoplasm, and the positive rate of Cx expression was significantly higher in normal gastric tissues than that in cancer tissues (Cx32: χ2 = 23.1, P < 0.05; Cx43: χ2 = 11.6, P <0.05). The positive rate of Cx expression was markedly higher in well-differentiated gastric cancer tissues than that in poorly-differentiated cancer ones (Cx32: χ2 = 32.1, P < 0.05, Cx43: χ2 = 22.6,P < 0.05). Indirect immunofluorescence showed that the expression of Cx32 and Cx43 were both positive in human gastric mucosal epithelial cell line (GES-1) and human well-differentiated gastric cancer cell line (N87), but the distributions and positive rates were significantly different between the two kinds of cell lines. Cx32 and Cx43 distributed granularly or linearly along the cell membrane with positive rates of both 100% in GES-1 cells. However, Cx32 located granularly or linearly along the membrane with a positive rate of 49%, and Cx43 was found in the cytoplasm with a positive rate of 55% in N87 cells. Cx32 and Cx43 were negatively expressed in the lowly-differentiated gastric cell line (BGC-823).
CONCLUSION: Cx32 and Cx43 are important factors in influencing the occurrence, development and metastatic potential of gastric cancer.
- Citation: Wu J, Wang CH, Zhou HF, Liu D, Wang W, Zhang B, Sui GJ. Relations of connexin 32 and 43 expression with metastatic potential of gastric cancer. Shijie Huaren Xiaohua Zazhi 2006; 14(6): 557-562
- URL: https://www.wjgnet.com/1009-3079/full/v14/i6/557.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i6.557
侵袭与转移是恶性肿瘤基本特征之一, 他涉及肿瘤细胞与宿主间一系列复杂多步骤相互作用的过程. 任何一种恶性肿瘤都具有侵袭转移潜能, 而其侵袭转移潜能的高低受多方面因素的影响, 连接通讯功能减弱就是一个重要的因素. 间隙连接(gap junction, GJ)是普遍存在动物组织中的一种连接方式, 由间隙连接蛋白(connexin, Cx)所构成. 相邻细胞间通过间隙连接所介导的细胞间隙连接通讯(gap junction intercellular communication, GJIC)进行着信息和能量物质的交换, 参与细胞间物质交换的代谢偶联和电信号传递的电偶联, 对细胞的新陈代谢、内环境稳定、增殖和分化等生理过程起着重要的调控作用[1-3].
恶性肿瘤的侵袭转移潜能与肿瘤的分化程度密切相关. 大量研究表明: 高分化肿瘤细胞的转移潜能低, 低分化肿瘤细胞的转移潜能高. 随着对连接蛋白及基因研究的深入, 发现连接蛋白与恶性肿瘤的发生、发展关系密切, 但连接蛋白在肿瘤侵袭转移方面的作用还有待于进一步研究. Cx32, Cx43在胃癌组织中的表达已有报道, 但在细胞系方面的报道甚少. 本实验应用免疫组化SP法和间接免疫荧光方法分别检测Cx32, Cx43在正常胃组织及不同病理分型的胃癌组织和不同分化程度胃癌细胞株中的表达, 探讨该蛋白在组织与细胞中表达是否具有一致性, 并分析该蛋白表达对胃癌侵袭转移潜能的影响, 为以后利用细胞系进行体外抗癌转移的研究提供理论依据, 为肿瘤的基因治疗提供新的靶点.
哈尔滨医科大学附属肿瘤医院1997/1999手术切除且资料完整的胃腺癌58例(高中分化28例, 低分化30例), 所有病例均经组织学诊断, 术前未经放化疗. GES-1细胞株由北京市肿瘤防治研究所提供; N87细胞株由上海瑞金医院外科消化研究所馈赠; BGC-823细胞株由哈医大肿瘤研究所提供. RPMI 1640、DMEM购自GIBCO公司, 兔抗人Cx43多克隆抗体购自Zymed公司, Cx32山羊抗人多克隆抗体购自Santa公司, 488 nm山羊抗兔IgG购自Invitrogens公司, FITC-兔抗山羊IgG、兔SP试剂盒、山羊SP试剂盒、DAB显色试剂盒均购自北京中杉公司. SV40病毒转化的可传代人胃黏膜上皮细胞系(GES-1)用含150 mL/L灭活胎牛血清和适量抗生素的DMEM培养液, 在含50 mL/L CO2、37 ℃条件下培养; 高分化胃腺癌细胞株N87、低分化胃腺癌细胞株 BGC-823, 用含150 mL/L灭活胎牛血清和适量抗生素的RPMI 1640培养液, 在含50 mL/L CO2、37 ℃条件下培养.
石蜡标本连续切片, 石蜡切片经修复抗原后进行免疫组织化学SP法染色, 染色步骤按试剂盒说明进行, DAB显色后苏木素复染. 以细胞膜、细胞质出现棕黄色颗粒为阳性细胞, 已知阳性片作阳性对照, PBS替代一抗作阴性对照. 每张切片随机抽取10个高倍视野计数阳性细胞, 进行半定量评分, A项按切片中细胞显色有无及深浅计分: 0分细胞无显色; 1分显色为浅黄色; 2分为棕黄色; 3分为棕褐色; B项按显色细胞的比例评分: 0分, <5%; 1分, 5%-15%; 2分, 16%-50%; 3分, 51%-75%; 4分, 76%-100%. 根据这两项指标的积分分为: 阴性(-)积分为0分; 弱阳性(+)积分为1-4分; 强阳性(6)积分>4分.
在24孔板中每孔均放置5 mm×5 mm的盖玻片一块, 并加入对数期的GES-1, N87, BGC-823细胞分别为4×104, 6×104, 10×104个, 贴壁生长至占盖玻片面积70%时, 进行固定、间接免疫荧光法染色. (1)用吸管将孔中的培养液弃去, 滴加0.01 mol/L, pH7.4的PBS 1 mL冲洗标本3次, 每次5 min, 轻微震荡; (2)40 g/L多聚甲醛室温固定30 min; (3)用0.01 mol/L, pH7.4的PBS冲洗10次, 轻微震荡; (4)50 g/L BSA封闭30 min(室温); (5)取出玻片, 用滤纸吸去多余水分, 但不使标本干燥, 滴加用0.01 mol/L, pH7.4的PBS 1:200稀释的I级抗体, 覆盖已知抗原标本片.将玻片置于湿盒内, 4 ℃过夜; (6)用0.01 mol/L, pH7.4的PBS冲洗10次, 不时振荡; (7)取出玻片, 用滤纸吸去多余水分, 但不使标本干燥, 滴加1:200稀释的488 nm山羊抗兔IgG或1:100稀释的FITC-兔抗山羊IgG II级抗体(在暗室中进行); (8)将玻片平放在湿盒内, 室温, 2 h; (9)取出玻片, 用滤纸吸去多余水分, 在荧光显微镜高倍视野下观察. 设2组阴性对照: 一组不加Ⅰ抗和Ⅱ抗, 用于荧光强度的基线校正; 一组仅加Ⅱ抗, 用于非特异性结合对照. 用荧光显微镜在蓝色激发光下观察结果: 抗体结合处呈现绿色荧光, 说明该处有连接蛋白的存在, 判定为阳性表达细胞, 如无绿色荧光呈现, 判定为阴性表达细胞. 每张玻片随机抽取10个高倍视野(×200), 先计视野中荧光细胞数(阳性细胞), 再在普通光源下计同视野的细胞总数, 计算200个普通光源下细胞中阳性细胞所占的比例[4]. 重复实验三次, 取平均值.
统计学处理 组间比较应用SPSS10.0统计软件进行χ2检验, P<0.05有统计学意义.
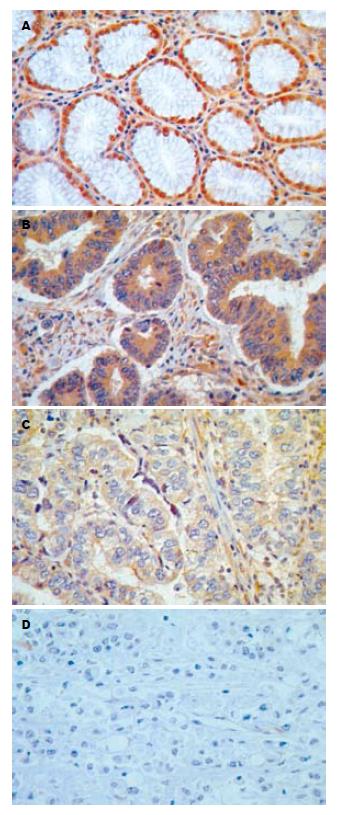
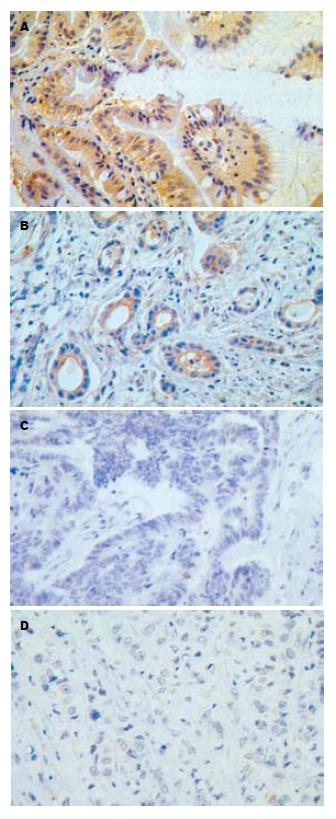
Cx32, Cx43在正常胃黏膜呈强阳性表达, 阳性表达于细胞膜和细胞质, 为棕黄色颗粒(图1A, 2A). Cx32, Cx43在高中分化的胃黏膜中表达普遍降低, 呈淡黄色(图1B, 2B, 图1C, 2C), 部分病例不表达. 30例原发性低分化胃癌Cx32完全不表达(图1D); 23例Cx43完全不表达, 7例原发性低分化胃癌表达减低, 细胞质呈浅黄色染色(图2D)(表1).
| 分组 | n | Cx32 | Cx43 | ||||||
| - | + | ++ | +++-++++ | - | + | ++ | +++-++++ | ||
| 正常胃 | 19 | 0 | 1(5.3) | 5 (26.3) | 13(68.4) | 0 | 9(47.3) | 7 (36.8) | 3 (15.9) |
| 高中分化胃癌 | 28 | 7(25.0) | 12(42.8) | 9 (32.2) | 0 | 5 (17.8) | 17(60.7) | 6 (21.4) | 0 |
| 低分化胃癌 | 30 | 30(100.0) | 0 | 0 | 0 | 23 (76.7) | 7(23.3) | 0 | 0 |
Cx32, Cx43阳性棕黄色颗粒位于细胞膜和细胞质内(图1A, 图2A), 在正常胃组织中的阳性表达率显著高于胃癌组织(Cx32: χ2 = 23.1, P<0.05, Cx43: χ2 = 11.6, P<0.05), Cx32、Cx43在高中分化胃癌的阳性表达率显著高于低分化胃癌(Cx32: χ2 = 32.1, P<0.05, Cx43: χ2 = 22.6, P<0.05, 表2).
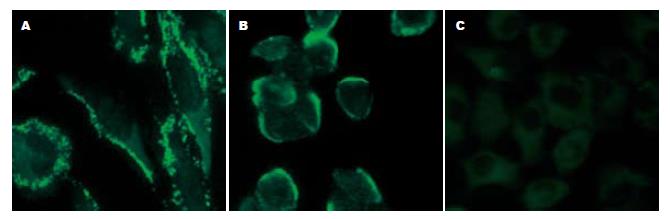
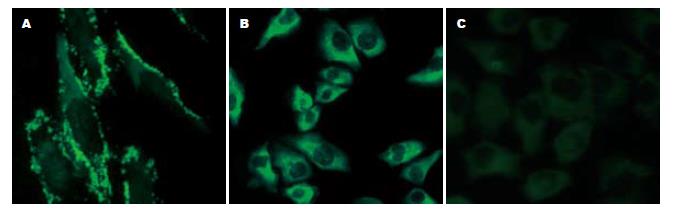
Cx32, Cx43在转化的人胃细胞系(GES-1)、胃高分化腺癌细胞系(N87)中的表达均为阳性, 但是表达部位有差异. Cx32, Cx43在GES-1的绿色荧光沿其细胞膜呈颗粒状或细线状分布(图3A, 4A); 在N87中, Cx32阳性染色沿其细胞膜呈颗粒状或细线状分布(图3B); Cx43荧光分布在细胞质中(图4B); 在BGC-823中Cx32, Cx43均为阴性(图3C, 4C, 表3).
转移是恶性肿瘤最基本的生物学特征之一. 恶性肿瘤细胞具有比相应的正常组织更低的黏着性, 这种黏着力降低是由于瘤细胞之间失去了间隙连接或间隙连接通讯减弱所致. 间隙连接能增强细胞之间的结合力, 使细胞不易脱落. 如连接通讯功能减弱, 则可引起肿瘤细胞之间失去正常的调控信息, 接触抑制和密度依赖性生长作用丧失并失去器官整体调控作用, 这样肿瘤细胞就会异常生长, 引起局部张力增加, 容易导致肿瘤细胞的脱落并向张力低的基质间隙侵袭[5-6]. Nicolson在比较肿瘤细胞转移能力时发现, 高转移潜能细胞系间的间隙连接通讯功能明显低于低转移潜能细胞系间的间隙连接通讯功能, 他首次提出了肿瘤细胞连接通讯功能降低与肿瘤的转移有关. 随后他又对一系列不同转移能力的大鼠乳腺癌细胞系应用划痕标记染料示踪技术检测其间隙连接通讯功能, 实验结果进一步证实了上述观点. Brmsl基因是最近发现的一个肿瘤转移相关基因, 他的产物可以抑制肿瘤转移. Brmsl基因的缺失以及伴随的细胞间隙连接(GJ)的缺失, 可以导致乳腺癌细胞转移能力的增强[7]. 本结果显示, Cx32, Cx43在正常胃黏膜组织和转化的人胃细胞系(GES-1)中呈强阳性表达且阳性率均为100%, 阳性表达于细胞膜和细胞质(图1A, 2A, 3A, 4A), 而Cx32, Cx43 在高中分化的胃癌组织和高分化腺癌细胞N87中虽有一定程度的细胞连接蛋白表达, 但表达的阳性率和表达部位与正常胃黏膜组织和正常胃上皮细胞存在明显差异(图1B, 2B, 3B, 4B, 1C, 2C, 表1, 2), 因而导致GJIC功能下降, 细胞脱离正常分化、繁殖的轨道, 具备了恶性和转移的潜能, 但因仍存在部分GLIC功能, 受一定的正常调控信息的控制, 故转移潜能低. 低分化胃癌组织和低分化腺癌细胞BGC-823中连接蛋白Cx32的表达完全缺失(图1D, 3C), 23例低分化胃癌组织中Cx43的表达完全缺失, 7例低分化胃癌组织中Cx43低水平表达(图2D), 造成肿瘤特异性抗原呈递缺损、免疫细胞不能识别肿瘤细胞; 同时伴随GJIC的完全关闭, 不能向免疫细胞提供cAMP、蛋白激酶、IP3等信息物质, 免疫细胞不能被激活及使来自正常细胞的生长调控信息不能到达肿瘤细胞, 肿瘤细胞逃避正常生长控制及免疫监视, 更易于生长扩散和转移. 上述结果提示, 间隙连接蛋白Cx32, Cx43表达量及表达部位的差异导致GJIC功能障碍, 从而影响了胃癌细胞的转移潜能. Eghbali et al将编码Cx32的cDNA导入缺乏GJIC的肝细胞系SKHepl, 发现细胞系可形成功能性GJ. 随后, 使交流缺陷的鼠突变肝细胞系aBI转染Cx43基因后, 其GJIC也得到恢复. 由此我们想到将Cx基因转染到胃低分化腺癌细胞使Cx表达增强, GJIC功能恢复, 从而控制胃癌的转移, 为胃癌的基因治疗开辟了新的靶点. 另外, 寻找能够上调Cx基因表达和改善GJIC的药物对肿瘤的预防和治疗将有重要的意义.
在肿瘤和转化细胞普遍存在间隙连接蛋白表达的异常和间隙连接通讯功能的缺陷[8-11]. 在本实验中GES-1是SV40病毒转化的可传代人胃黏膜上皮细胞系, 实验结果显示在GES-1中Cx32和Cx43均阳性, 且阳性率100%, 这可能与GES-1在体外培养中虽获得永生性, 但在裸鼠体内无致瘤性有关[12]. 已有研究证实: GES-1细胞间隙连接通讯功能与正常胃黏膜相同[13]. 本实验结果证实胃黏膜组织与GES-1细胞中Cx32, Cx43表达一致. 国外一些研究者发现许多肿瘤细胞中连接蛋白基因表达明显降低或消失, 而且表达的连接蛋白的量和肿瘤恶性程度之间呈负相关. 如Wilgenbus et al用人肿瘤组织的冰冻切片, 以免疫组织化学方法研究了连接蛋白基因Cx26、Cx32 和Cx43的表达情况, 发现在乳癌、肾细胞癌和肉瘤组织中, Cx水平显著下降. 而有关胃癌细胞系方面的研究未见报道, 但在其他细胞系中有报道. Murray et al[5]应用免疫组化比较正常肾上腺、良恶性肾上腺皮质肿瘤及肾上腺癌细胞株(H295)中Cx43蛋白的水平, 在正常和良性肿瘤中可检测到Cx43, 在恶性肿瘤和H295中少或无Cx43的表达, 与正常细胞比较, 肾上腺癌细胞中GJ斑进行性减少. 国内有关组织中Cx的表达情况报道很多[14-18]. 沈守荣 et al[18]研究表明, Cx32和Cx43在正常胃黏膜上皮细胞中高水平表达, 在癌旁细胞中表达水平下降; Cx32在癌细胞及癌细胞株(低分化腺癌细胞株MGC-803)均不表达; Cx43在癌细胞中有低水平表达, 在癌细胞株(低分化腺癌细胞株MGC-803)中无表达. 本实验结果与上述结果相符, 提示可以应用细胞系在体外进行抗癌转移的研究, 这为以后利用细胞系进行体外抗癌转移的研究开辟了新的领域, 为肿瘤的分化诱导治疗提供新的可能.
总之, 本实验结果证实Cx在恶性肿瘤的转移中具有重要作用, 而肿瘤细胞Cx基因的转染可抑制肿瘤的发展, 逆转其恶性表型. Cx基因抑制恶性肿瘤转移的作用的研究对肿瘤的临床治疗可能有重要意义. 目前的工作还处于探索阶段, 但却具有广阔的应用前景, 在不久的将来有可能作为肿瘤治疗的辅助手段而应用于临床.
细胞间隙连接由膜上的连接子结构单位构成, 其蛋白成分称为连接蛋白(connexin, Cx), 在细胞间信息调控信号传导方面起重要作用,构成细胞间通讯(CJIC)功能. 不同的连接蛋白由位于不同染色体上的连接蛋白基因编码, 连接蛋白基因的异常可导致间隙连接功能的异常, 从而引起肿瘤细胞之间失去正常的调控信息, 肿瘤细胞就会异常生长, 引起局部张力增加, 导致肿瘤细胞的脱落并向张力低的基质间隙侵袭, 从而发生转移.
现国内外在该领域研究的热点主要是连接蛋白及其基因在恶性肿瘤发生、发展中的作用.
目前国外关于连接蛋白主要在心肌、神经等组织的表达研究较多, 在肿瘤组织中仅限于生长、分化、增殖方面的作用的研究, 而国内关于连接蛋白在组织中表达方面的研究较多, 但在细胞系方面的报道甚少, 并且研究内容主要是连接蛋白与肿瘤发生、发展的关系, 而与肿瘤转移关系的研究未见涉猎. 本文通过对细胞连接蛋白(connexin)在人正常胃组织及不同病理分级的胃癌组织和不同分化的胃癌细胞株中表达的差异, 探讨连接蛋白与胃癌转移潜能的关系, 为以后利用细胞系进行体外抗癌转移的研究提供理论依据, 为肿瘤的基因治疗提供新的靶点.
本实验结果证实Cx在恶性肿瘤的转移中具有重要作用, 虽然目前的工作还处于探索阶段, 但却具有广阔的应用前景, 在不久的将来有可能作为肿瘤治疗的辅助手段而应用于临床.
转移潜能: 恶性肿瘤具有潜在的侵袭转移的能力. 大量研究表明: 其与肿瘤的分化程度密切相关, 高分化肿瘤细胞的转移潜能低, 低分化肿瘤细胞的转移潜能高.
本文研究的内容对了解Cx32、Cx43表达与胃上皮细胞的分化程度,推测其与转移潜能有一定的理论价值, 提供了一定的有意义的信息. 研究具有一定的新颖性, 符合伦理学要求.
电编: 张敏 编辑:张海宁
| 1. | Krutovskikh VA, Troyanovsky SM, Piccoli C, Tsuda H, Asamoto M, Yamasaki H. Differential effect of subcellular localization of communication impairing gap junction protein connexin43 on tumor cell growth in vivo. Oncogene. 2000;19:505-513. [PubMed] |
| 2. | Nishitani A, Hirota S, Nishida T, Isozaki K, Hashimoto K, Nakagomi N, Matsuda H. Differential expression of connexin 43 in gastrointestinal stromal tumours of gastric and small intestinal origin. J Pathol. 2005;206:377-82. [PubMed] |
| 3. | Mine T. Role of gap junction in the stomach. Nippon Shokakibyo Gakkai Zasshi. 1998;95:865-871. [PubMed] |
| 4. | 杨 景山. 医学细胞化学与细胞生物技术. 第1版. 北京: 北京医科大学中国协和医科大学联合出版社 1992; 100-101. |
| 5. | Murray SA, Davis K, Fishman LM, Bornstein SR. Alpha1 connexin 43 gap junctions are decreased in human adrenocortical tumors. J Clin Endocrinol Metab. 2000;85:890-895. [PubMed] |
| 6. | Habermann H, Ray V, Habermann W, Prins GS. Alterations in gap junction protein expression in human benign prostatic hyperplasia and prostate cancer. J Urol. 2001;166:2267-2272. [PubMed] |
| 7. | Suzuki M, Kobayashi H, Kanayama N, Nishida T, Takigawa M, Terao T. CD44 stimulation by fragmented hyaluronic acid induces upregulation and tyrosine phosphorylation of c-Met receptor protein in human chondrosarcoma cells. Biochim Biophys Acta. 2002;1591:37-44. [PubMed] |
| 8. | 邱 元正, 田 勇, 肖 健云. 连接蛋白基因与肿瘤研究进展. 国外医学耳鼻咽喉科学分册. 1999;23:290-293. |
| 9. | Levin M. Isolation and community: a review of the role of gap-junctional communication in embryonic patterning. J Membr Biol. 2002;185:177-192. [PubMed] |
| 10. | Kanczuga-Koda L. Gap junctions and their role in physiology and pathology of the digestive tract. Postepy Hig Med Dosw (Online). 2004;58:158-165. [PubMed] |
| 11. | Mesnil M, Crespin S, Avanzo JL, Zaidan-Dagli ML. Defective gap junctional intercellular communication in the carcinogenic process. Biochim Biophys Acta. 2005;1719:125-145. [PubMed] |
| 16. | 王 宪远, 任 景丽, 曾 艳丽. 胃癌组织Cx43表达的研究. 中国现代普通外科进展. 2004;7:60. |