修回日期: 2005-10-19
接受日期: 2005-11-04
在线出版日期: 2006-02-28
目的: 研究COX-2在胃癌中的表达及其与血管生成的关系, 探讨其在胃癌转移中的作用及与胃癌病理生物学行为的关系.
方法: 采用EnVision方法检测胃癌组织芯片中COX-2的表达, 用CD34进行微血管内皮细胞染色, 计算微血管密度(MVD), 分析其相关性.
结果: COX-2在胃癌中的表达明显高于正常胃黏膜(P = 0.001). COX-2的高表达与胃癌的转移(P = 0.019)和胃壁浸润深度(0.031)呈正相关, 与胃癌的组织病理分型无关(P = 0.495), 与Borrmann分型无关(P = 0.109)组织MVD (65.49±20.64)明显高于正常胃黏膜组织(36.21±18.47, P = 0. 001). MVD值与胃癌的组织病理分型(P = 0.003)和转移有关(P = 0.043), 与胃癌胃壁浸润深度(P = 0.627)和Borrmann分型(P = 0.634)无明显相关性. COX-2表达阳性组的MVD指数明显高于COX-2表达阴性组(68.59±19.8 vs 25.82±7.76, P<0.05), COX-2表达与MVD呈正相关(P = 0.001).
结论: 组织芯片技术对于快速检测胃癌及其他肿瘤的分子病理学改变是一个强有力的工具. COX-2表达可能通过促进血管形成对胃癌的发生、发展起重要作用, 其可作为判断预后和指导治疗的有效指标.
引文著录: 吕晓君, 毛晓韵, 李锦毅, 韩琤波, 吴东瑛, 张淑敏, 辛彦. 利用组织芯片技术研究COX-2在胃癌中的表达及其与血管生成的关系. 世界华人消化杂志 2006; 14(6): 550-556
Revised: October 19, 2005
Accepted: November 4, 2005
Published online: February 28, 2006
AIM: To explore the expression and clinical-pathological significance of cyclooxygenase-2 (COX-2) as well as its relations with the angioge-nesis in the carcinogenesis and metastasis of gastric cancer.
METHODS: The expression of COX-2 was detected by EnVision immunohistochemical method in tissue microarray prepared from gastric cancer patients. The microvessel density (MVD) was calculated after CD34 staining for microvessel endothelium. Their correlations were analyzed.
RESULTS: The expression of COX-2 in gastric cancer was significantly higher than that in normal controls (P = 0.001). The over-expression of COX-2 in gastric cancer was positively related to the metastasis and the depth of invasion (P = 0.031), while it was not related with the histological types (P = 0.495) and Borrmann types (P = 0.328). The MVD in gastric cancer tissues (65.49 ± 20.64) was notably higher than that in normal controls (36.21 ± 18.47, P = 0.001). MVD was correlated with the histological types (P = 0.003) and metastasis (P = 0.043), while it was not correlated with the depth of invasion (P = 0.627) and Borrmann types (P = 0.634). The MVD of COX-2 positive group was higher than that of COX-2 negative one (68.59 ± 19.8 vs 25.82 ± 7.76, P < 0.05), and the expression of COX-2 and MVD were positively correlated (P = 0.001).
CONCLUSION: Tissue microarray is a powerful tool for rapid identification of the molecular alterations in gastric cancer and other pathological types. The expression of COX-2 may play an important role in gastric carcinogenesis by promotion of angiogenesis. It may serve as a marker in the prognosis of gastric cancer.
- Citation: Lv XJ, Mao XY, Li JY, Han CB, Wu DY, Zhang SM, Xin Y. Study of cyclooxygenase-2 expression in gastric cancer and its relationship with angiogenesis by tissue microarray. Shijie Huaren Xiaohua Zazhi 2006; 14(6): 550-556
- URL: https://www.wjgnet.com/1009-3079/full/v14/i6/550.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i6.550
胃癌是消化道发病率很高的恶性肿瘤之一, 且发病率和死亡率呈上升趋势, 肿瘤细胞生长的无限性和浸润转移是肿瘤的最重要的特征, 是胃癌治疗失败导致死亡的主要原因, 而肿瘤细胞生长及浸润转移受多种因子的调控[1-2]. 新近发现的组织微阵列/组织芯片技术是将多个细小组织片整齐排列于同一载体而成的缩微组织切片, 具有体积小、信息含量高的特点, 能大大提高实验效率, 且可以根据需要灵活设计, 所得结果均一可靠、可比性强[3-6]. 近年来多项研究表明组织微阵列/组织芯片技术在肿瘤病理研究和临床病理诊断中有广泛而特殊的用途. COX-2是前列腺素合成中一个重要的限速酶. 许多研究表明COX-2在结肠癌等肿瘤中高表达[7-11], 能抑制COX-2的非甾体类抗炎药(NSAIDs), 可以作为结肠癌动物模型的有效化学预防剂[12-14]. 肿瘤的生长须经历一个血管形成过程, 我们用免疫组化方法和组织芯片技术的研究COX-2在胃癌中的表达及其与血管生成的关系, 探讨其在胃癌转移中的作用及与胃癌病理生物学行为和预后的关系.
中国医科大学和辽宁省肿瘤医院2003-12/2004-05手术切除胃癌标本104例, 另取其中79例距肿瘤边缘大于5 cm处的正常胃黏膜上皮作为对照, 标本经40 g/L福尔马林固定, 常规石蜡包埋, 制作成4 mm厚的切片HE染色供定位用. 即用型兔抗人COX-2单克隆抗体(福州迈新公司), 即用型鼠抗人CD34单克隆抗体(福州迈新公司), PV-9000试剂(北京中山生物技术有限公司). 组织芯片仪及其1 mm组织穿刺针(Beecher Instruments), 免疫组化配套仪器.
1.2.1 组织芯片制作: 组织载玻片经过夜泡酸、充分清洗并烘干, 用多聚赖氨酸行防脱片处理. 对每一组织标本, 观察HE切片确定癌、肠上皮化生、不典型增生及远癌正常组织等, 选取目标组织并在HE切片及其相应石蜡组织块(供体蜡块)上标记. 莱卡石蜡(leica histowax, 上海华灵)与蜂蜡(东大蜂场)混合(比例为1:1), 制成2.2 cm×3.5 cm×1 cm大小的空白蜡块(受体蜡块). 在该蜡块上设计14×9和16×7共248点组织列阵, 用组织芯片仪打孔制成带孔空白蜡块. 将蜡块放在39-42 ℃水浴中软化后, 用组织芯片仪从供体蜡块标记部位逐个取出直径1 mm, 高4 mm的组织柱, 推入空白蜡块预先设计的相应孔内. 这样将225个组织芯片整齐有序地安插在空白蜡块1和2中, 对蜡块进行连续切片, 裱于防脱片处理的载玻片上.
1.2.2 组织芯片免疫组化染色: 采用EnVision方法对胃癌及其癌前病变组织芯片进行免疫组化染色, 并利用PBS(pH 7.4)代替一抗作为阴性对照, 已知阳性切片作为阳性对照. COX-2蛋白阳性反应颗粒定位于胞质和胞膜, 每例标本选择2个有代表性的高倍视野, 数200个肿瘤细胞, 取平均值. 阳性细胞数<5%为阴性(-), 5%-25%为弱阳性(+), 25%-50%为中度阳性(++), >50%为强阳性(+++). CD34表达于血管内皮细胞膜, 每一个染成棕黄色的、可与周围血管、肿瘤细胞和其他结缔组织区分开来的明显微小血管腔或含3个以上内皮细胞的内皮细胞簇, 不论管腔和红细胞出现与否, 均作为一个单一的、可计数的微血管. 管腔面积>8个红细胞直径, 带有较厚的肌层的微血管均不计数[15-16]. 先于低倍光镜下确定3个血管着色最密集区域, 然后在高倍视野下计数微血管的数目, 取2个视野的均值作为微血管密度(MVD). 结果判定在双盲法下进行, 每张切片由两位病理医师分别判定、计数.
统计学处理 利用χ2检验比较率的差异. P<0.05视为差异有统计学意义, 用SPSS 12.0统计分析软件处理.
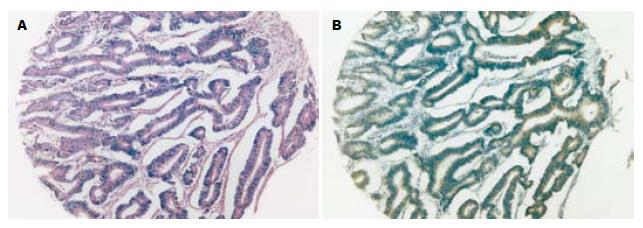
胃癌及其癌前病变组织芯片常规HE染色切片芯片组织形态好, 有代表性(图1). 胃癌组织芯片在免疫组织化学染色中有部分脱落, 其余组织阳性信号清晰, 背景清洁.
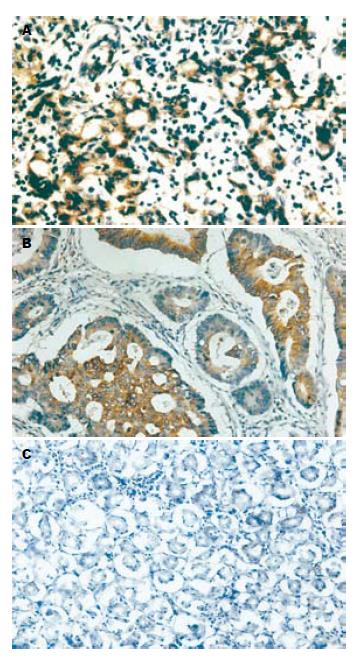
COX-2免疫组化染色最终可用芯片组织为胃癌87例、远癌基本正常胃黏膜37例. COX-2的阳性染色主要为胞质和胞膜, 大多分布在癌组织中. COX-2在胃癌中的表达明显高于正常胃黏膜(P<0.05). COX-2在转移组的阳性率高于无转移组阳性率(P<0.05). COX-2表达与胃癌胃壁浸润深度呈正相关(P<0.05), 与胃癌的组织病理分型无关(P<0.05), 与Borrmann分型无关(P<0.05, 表1, 图2).
| 组别 | n | COX-2蛋白表达 | 阳性率 (%) | χ2 | P | |
| - | +-+++ | |||||
| 组织性质 | 12.191 | 0.000 | ||||
| 正常胃黏膜 | 37 | 15 | 22 | 59.46 | ||
| 胃癌 | 87 | 11 | 76 | 87.36 | ||
| 组织病理分型 | 5.391 | 0.495 | ||||
| 乳头状腺癌 | 2 | 0 | 2 | 100.00 | ||
| 高分化管状腺癌 | 8 | 2 | 6 | 75.00 | ||
| 中分化管状腺癌 | 28 | 4 | 24 | 85.71 | ||
| 低分化腺癌 | 29 | 2 | 27 | 91.10 | ||
| 黏液腺癌 | 12 | 0 | 12 | 100.00 | ||
| 印戒细胞癌 | 6 | 2 | 4 | 66.67 | ||
| 未分化癌 | 2 | 1 | 1 | 50.00 | ||
| 转移与否 | 5.502 | 0.019 | ||||
| 无转移 | 21 | 6 | 15 | 71.43 | ||
| 转移 | 66 | 5 | 61 | 92.42 | ||
| 胃壁浸润深度 | 6.997 4 | 0.031 | ||||
| 肌层 | 4 | 2 | 2 | 50.00 | ||
| 浆膜下 | 57 | 8 | 49 | 85.96 | ||
| 穿出浆膜 | 26 | 1 | 25 | 96.15 | ||
| Borrman分型 | 4.428 6 | 0.109 | ||||
| BorrmanⅡ | 7 | 0 | 7 | 100.00 | ||
| BorrmanⅢ | 75 | 9 | 66 | 88.00 | ||
| Borrman Ⅳ | 5 | 2 | 3 | 60.00 | ||
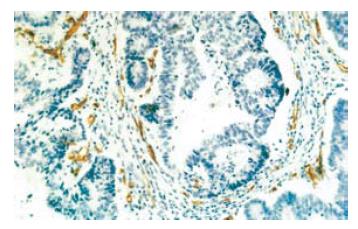
CD34表达免疫组化染色最终可用芯片组织为胃癌92例、远癌基本正常胃黏膜38例. CD34主要表达于血管内皮细胞胞膜. 微血管染色呈棕黄色, 在92例胃癌组织中MVD从16到100不等, 均数为65.5. 在胃癌组织中的MVD明显高于在正常胃黏膜组织(P<0.05). MVD值与胃癌的组织病理分型有关, 在分化差的胃癌其MVD明显高于分化好的胃癌(P<0.05). 另外MVD值与是否转移明显相关(P<0.05); 与胃壁浸润深度和Borrmann分型无明显相关性(P>0.05, 表2, 图3).
| 组别 | n | MVD | t | P |
| 组织性质 | 7.53 | 0.000 | ||
| 正常胃黏膜 | 38 | 36.21±18.47 | ||
| 胃癌 | 92 | 65.49±20.64 | ||
| 组织病理分型 | 3.68 | 0.003 | ||
| 乳头状腺癌 | 2 | 39.50±7.78 | ||
| 高分化管状腺癌 | 9 | 42.56±20.35 | ||
| 中分化管状腺癌 | 28 | 56.79±20.97 | ||
| 低分化腺癌 | 31 | 72.65±20.49 | ||
| 黏液腺癌 | 14 | 63.64±23.02 | ||
| 印戒细胞癌 | 5 | 74.40±33.56 | ||
| 未分化癌 | 3 | 44.67±20.23 | ||
| 分化程度 | 4.83 | 0.000 | ||
| 中高分化 | 39 | 54.68±19.78 | ||
| 分化差或未分化 | 53 | 73.88±17.25 | ||
| 转移与否 | 4.214 | 0.043 | ||
| 无转移 | 26 | 54.08±24.42 | ||
| 转移 | 66 | 65.08±22.63 | ||
| 转移部位 | 1.140 | 0.355 | ||
| 淋巴结转移 | 66 | 65.08±22.63 | ||
| 肝转移 | 4 | 82.00±10.61 | ||
| 卵巢转移 | 1 | 100.00 | ||
| 腹膜转移 | 9 | 68.44±26.16 | ||
| 胃壁浸润深度 | 0.583 | 0.627 | ||
| 肌层 | 4 | 68.00±19.13 | ||
| 浆膜下 | 64 | 60.33±24.28 | ||
| 穿出浆膜 | 24 | 65.96±22.68 | ||
| Borrman分型 | 0.459 | 0.634 | ||
| BorrmanⅡ | 7 | 55.71±17.17 | ||
| BorrmanⅢ | 79 | 62.92±23.89 | ||
| Borrman Ⅳ | 6 | 61.97±23.55 |
组织芯片技术是将数十个甚至上千个不同个体的临床组织标本按预先设计的顺序排列在一张玻片进行分析研究, 是一种高通量、多样本的分析工具. 其克服了传统病理技术只能逐个组织切片进行研究的落后方式, 提高实验效率, 同时能平行地研究组织细胞形态及一个特异性基因、蛋白在几百乃至上千种疾病样本中的表达及功能状态, 平行性好、对比性和重复性强. 组织芯片技术可以与DNA、RNA、蛋白质、抗体等技术相结合, 在基因、基因转录和相关表达产物生物学功能多个层面上进行研究[17-21]. Moch et al[22]用cDNA从肾癌细胞株中筛选出89个潜在基因, 其中一个过度表达的基因与Vimentin有关, 其用组织芯片作免疫组化检测, 证实了大多数肾癌Vimentin过度表达, 其过度表达的病例预后差, 基因芯片能筛选出有潜在性的生物标记, 而组织芯片可迅速测试其临床价值. 二者互补能迅速筛选基因和评估其生物学作用, 助于建立诊断、治疗、预后相关的参数. Schraml et al[23]用源于17种不同肿瘤共397个肿瘤样本制成一个组织芯片, 用FISH法检测了3CCND1、c-myc、erbB 3个癌基因的扩增情况, 结果发现CCDD1在乳腺、肺、头颈部肿瘤和膀胱癌肿瘤、黑色素瘤等检测到; c-myc扩增在乳腺、大肠、胃、肺、卵巢、膀胱、头颈部和子宫颈癌等检测到; erbB扩增在膀胱癌、乳腺癌、大肠癌、胃癌、肺癌、睾丸癌中存在, 这与文献报道的结论一致, 而且其还首次提示了在睾丸癌中有erb-B2的扩增. 在肿瘤研究领域中, 组织芯片对于肿瘤易感因素判断、病因学及发病机制、诊断和鉴别诊断、治疗及预后评估等方面均起到重要作用. 目前有研究认为组织芯片由于所取组织量少, 在信息量上有一定的局限性, 但本人认为通过在组织芯片制作过程中, 对目标组织有精确定位可将这个局限性减小. 本研究构建了包含104例胃癌及正常黏膜的225个组织样本的组织芯片, 检测COX-2和CD34的表达情况, 所得实验结果与大多数研究较为一致.
COX是非甾体类消炎药的靶目标之一, 是催化花生四烯酸产生前列腺素(prostaglandin, PG)的关键酶, 在人体内主要存在两种亚型: 结构型COX-1和诱导型COX-2. COX-2基因则位于染色体1q25.2-25.3上, 由11个外显子和10个内含子组成, 约8.3 kb. 其mRNA转录产物为4.5 kb[12-14]. COX-1被认为是"看家基因", 在大多数正常组织中都呈稳定的表达, 维持一些正常的生理功能; 而COX-2被认为是"快速反应基因", 仅在细胞受到刺激时迅速从头合成, 参与多种病理生理过程, 包括炎症过程及肿瘤的发生、发展, 静息时并不表达[24]. COX-2表达的调控主要为在转录水平的调控, 即细胞受到细胞内外的各种刺激后, 经过一系列的信号转导促进COX-2转录, 诱导COX-2的表达. 近年来众多研究表明COX-2参与了癌症的发生、进展[25-26]. 一般认为COX-2高表达是癌症发生的早期事件[27]. 对于COX-2表达与胃癌的类型、分级、分化和淋巴结转移的关系许多学者进行了相关研究. Murata et al[28]发现COX-2表达促进胃癌淋巴管侵犯和淋巴结转移, 而与胃癌原发灶大小、组织病理类型、静脉侵犯等因素无关. Fosslien et al[29]研究发现新生血管在COX-2表达的区域显著增生, 而COX-2抑制剂可显著抑制血管生成, 提示COX-2在血管生成中起重要作用. COX-2的过表达在肿瘤局部产生过多PGs, 可促进新生血管的生成, 可能是肿瘤组织生长、侵袭和转移的基础. Ohno et al[30]用RT-PCR法测定33例胃癌手术标本中COX-1和COX-2的表达量, 对标本中COX-2 抗体同时行免疫组化染色和常规组织学测定, 发现胃癌中COX-2表达指数明显高于正常黏膜(3.4-0.7 vs 2.2-0.7, P<0.05), COX-2指数随着胃癌组织的浸润深度而升高. 免疫组化显示COX-2 蛋白弥散于肿瘤细胞的胞质中, 而不存在于细胞间质或非癌性黏膜中. Lim et al[31]用斑点杂交测定了104例胃癌手术标本中的COX-2蛋白表达情况, 同样证实COX-2在胃癌组织中的表达上调. 本研究显示COX-2在胃癌中的表达明显高于正常胃黏膜, 其在转移组的阳性率高于无转移组, COX-2表达与胃癌胃壁浸润深度呈正相关, 提示COX-2的过表达与胃癌的侵袭和转移能力密切相关. COX-2表达与胃癌的组织病理分型无关, 与Borrmann分型无关.
胃癌组织MVD(65.49±20.64)明显高于正常胃黏膜组织(36.21±18.47). MVD值与胃癌的组织病理分型(在低分化癌中高于高中分化癌)、转移有关, 与远处转移部位、胃壁浸润深度及Borrmann分型无明显相关. 肿瘤细胞的浸袭不仅依赖于其增殖, 且与肿瘤内新生血管的形成密切相关. 肿瘤内新生血管为肿瘤生长提供了必需的营养成分及其远处转移的通道, 同时可通过内皮细胞分泌的生长因子来促进肿瘤细胞的增殖. 肿瘤新生血管不成熟, 结构缺乏完整性、穿透性较高, 肿瘤血管化使间质内压力增高, 也加快了淋巴回流[32-34]. 血管丰富的肿瘤有更高的转移率, 因此胃癌组织内MVD的检测, 在某种程度上可反映胃癌的生长和转移能力.
近年来的研究表明, COX-2在胃癌组织中有异常的高表达, 除可促进肿瘤细胞的增殖外, 还与肿瘤内新生血管的形成有关, 并认为COX-2的高表达可通过刺激肿瘤细胞释放血管源性的前列腺素, 而后者刺激内皮细胞迁移和管腔形成, 此乃血管生成的初始步骤, 对调节肿瘤新生血管的形成有重要的作用. 本研究也发现COX-2的表达在胃癌的发展过程中发挥重要作用, 可能与参与胃癌组织内新生血管形成有关. 目前研究认为, COX-2对肿瘤血管形成的调控机制可能有以下几种原因[35-36]: (1)上调VEGF的表达; (2)通过刺激bcl-2而抑制血管内皮细胞的凋亡; (3)花生四稀酸的代谢产物血栓素A2、PGE2和PG12可刺激内皮细胞迁移, 生长, 诱导血管生成. 其确切的机制还有待进一步研究. 流行病学研究表明, 使用COX-2抑制剂可使胃肠道肿瘤的发生率和死亡率下降40%. 本研究表明, COX-2的表达在胃癌的血管生成过程中可能起着重要的作用, 与胃癌细胞的增殖、浸润密切相关, 其表达可作为判断胃癌预后的一个指标.
组织芯片(Tissue microarray)是将多个细小组织整齐排列于同一载体而成的缩微组织切片, 具有体积小、信息含量高的特点, 能提高实验效率, 可灵活设计, 所得结果可比性强. 他为一种高通量、大样本以及快速的分子水平分析的工具, 其在肿瘤病理研究和临床病理诊断中有广泛而特殊的用途. 本文用免疫组化法和组织芯片技术研究COX-2在胃癌转移中的作用及与胃癌病理生物学行为和预后的关系.
本文利用组织芯片技术研究了COX-2在胃癌中的表达, 发现COX表达可能通过促进血管形成对胃癌的发生、发展起重要作用.
组织芯片技术可用于快速检测胃癌及其他肿瘤的分子病理学改变, COX-2可作为临床判断预后和指导治疗的有效指标.
电编: 张敏 编辑:张海宁
| 1. | Han CB, Mao XY, Xin Y, Wang SC, Ma JM, Zhao YJ. Quantitative analysis of tumor mitochondrial RNA using microarray. World J Gastroenterol. 2005;11:36-40. [PubMed] |
| 2. | Han CB, Ma JM, Xin Y, Mao XY, Zhao YJ, Wu DY, Zhang SM, Zhang YK. Mutations of mitochondrial 12S rRNA in gastric carcinoma and their significan-ce. World J Gastroenterol. 2005;11:31-35. [PubMed] |
| 3. | Xie D, Sham JS, Zeng WF, Che LH, Zhang M, Wu HX, Lin HL, Wen JM, Lau SH, Hu L. Oncogenic role of cluster in overexpression in mul-tistage colorectal tumorigenesis and progression. World J Gastroenterol. 2005;11:3285-3289. [PubMed] |
| 4. | Liu K, Lei XZ, Zhao LS, Tang H, Liu L, Feng P, Lei BJ. Tissue microarray for high-throughput analysis of gene expression profiles in hepatocellular carci-noma. World J Gastroenterol. 2005;11:1369-1372. [PubMed] |
| 5. | Zheng M, Simon R, Kononen J, Sauter G, Mihatsch MJ, Moch H. Analysis of gene expression profiles among 3 epithelial ovarian tumor subtypes using cDNA and tissue microarrays. Aizheng. 2004;23:771-776. [PubMed] |
| 6. | Andersen CL, Monni O, Wagner U, Kononen J, Barlund M, Bucher C, Haas P, Nocito A, Bissig H, Sauter G. High-throughput copy number analysis of 17q23 in 3520 tissue specimens by fluorescence in situ hybridization to tissue microarrays. Am J Pathol. 2002;161:73-79. [PubMed] |
| 7. | Gamradt SC, Feeley BT, Liu NQ, Roostaeian J, Lin YQ, Zhu LX, Sharma S, Dubinett SM, Lieberman JR. The effect of cyclooxygenase-2 (COX-2) inhibition on human prostate cancer induced osteoblastic and osteolytic lesions in bone. Anticancer Res. 2005;25:107-115. [PubMed] |
| 8. | Hasegawa K, Ohashi Y, Ishikawa K, Yasue A, Kato R, Achiwa Y, Nishio E, Udagawa Y. Expression of cyclooxygenase-2 in uterine endometrial cancer and anti-tumor effects of a selective COX-2 inhibitor. Int J Oncol. 2005;26:1419-1428. [PubMed] |
| 9. | Block KI. Inflammation, COX-2 inhibitors, and cancer. Integr Cancer Ther. 2005;4:3-4. [PubMed] |
| 10. | Wendum D, Masliah J, Trugnan G, Flejou JF. Cyclooxygenase-2 and its role in colorectal cancer development. Virchows Arch. 2004;445:327-333. [PubMed] |
| 11. | Koehne CH, Dubois RN. COX-2 inhibition and colorectal cancer. Semin Oncol. 2004;31:12-21. [PubMed] |
| 12. | Wu AW, Gu J, Li ZF, Ji JF, Xu GW. COX-2 express-ion and tumor angiogenesis in colorectal cancer. World J Gastroenterol. 2004;10:2323-2326. [PubMed] |
| 14. | Evans JF, Kargman SL. Cancer and cyclooxyge-nase-2 (COX-2) inhibition. Curr Pharm Des. 2004;10:627-634. [PubMed] |
| 15. | Boxer GM, Tsiompanou E, Levine T, Watson R, Begent RH. Immunohistochemical expression of vascular endothelial growth factor and microvessel counting as prognostic indicators in node-negative colorectal cancer. Tumour Biol. 2005;26:1-8. [PubMed] |
| 16. | Preziosi R, Sarli G, Paltrinieri M. Prognostic value of intratumoral vessel density in cutaneous mast cell tumors of the dog. J Comp Pathol. 2004;130:143-151. [PubMed] |
| 17. | Li H, Sun Y, Kong QY, Zhang KL, Wang XW, Chen XY, Wang Q, Liu J. Combination of nucleic acid and protein isolation with tissue array construction: using defined histologic regions in single frozen tissue blocks for multiple research purposes. Int J Mol Med. 2003;12:299-304. [PubMed] |
| 18. | Cui DX, Zhang L, Yan XJ, Zhang LX, Xu JR, Guo YH, Jin GQ, Gomez G, Li D, Zhao JR. A microarray-based gastric carcinoma prewarning system. World J Gastroenterol. 2005;11:1273-1282. [PubMed] |
| 19. | Dan HL, Zhang YL, Zhang Y, Wang YD, Lai ZS, Yang YJ, Cui HH, Jian YT, Geng J, Ding YQ. A novel method for preparation of tissue microarray. World J Gastroenterol. 2004;10:579-582. [PubMed] |
| 20. | Lusis EA, Chicoine MR, Perry A. High throughput screening of meningioma biomarkers using a tissue microarray. J Neurooncol. 2005;73:219-223. [PubMed] |
| 21. | Sun Y, Li JY, He JS, Zhou LX, Chen K. Tissue microarray analysis of multiple gene expression in intestinal metaplasia, dysplasia and carcinoma of the stomach. Histopathology. 2005;46:505-514. [PubMed] |
| 22. | Moch H, Schraml P, Bubendorf L, Mirlacher M, Kononen J, Gasser T, Mihatsch MJ, Kallioniemi OP, Sauter G. High- throughput tissue microarray analysis to evaluate genes uncovered by cDNA microarray screening in renal cell carcinoma. Am J Pathol. 1999;154:981-986. [PubMed] |
| 23. | Schraml P, Kononen J, Bubendorf L, Moch H, Bissig H, Nocito A, Mihatsch MJ, Kallioniemi OP, Sauter G. Tissue microarrays for gene amplification surveys in many different tumor types. Clin Cancer Res. 1999;5:1966-1975. [PubMed] |
| 24. | Mohammed NA, Abd El-Aleem SA, El-Hafiz HA, McMahon RF. Distribution of constitutive (COX-1) and inducible (COX-2) cyclooxygenase in postviral human liver cirrhosis: a possible role for COX-2 in the pathogenesis of liver cirrhosis. J Clin Pathol. 2004;57:350-354. [PubMed] |
| 25. | Singh B, Berry JA, Shoher A, Ramakrishnan V, Lucci A. COX-2 overexpression increases motility and invasion of breast cancer cells. Int J Oncol. 2005;26:1393-1399. [PubMed] |
| 26. | Eibl G, Takata Y, Boros LG, Liu J, Okada Y, Reber HA, Hines OJ. Growth stimulation of COX-2-negat-ive pancreatic cancer by a selective COX-2 inhibitor. Cancer Res. 2005;65:982-990. [PubMed] |
| 27. | Yazawa K, Tsuno NH, Kitayama J, Kawai K, Okaji Y, Asakage M, Sunami E, Kaisaki S, Hori N, Watanabe T. Selective inhibition of cyclooxygenase-2 inhibits colon cancer cell adhesion to extracellular matrix by decreased expression of beta1 integrin. Cancer Sci. 2005;96:93-99. [PubMed] |
| 28. | Murata H, Kawano S, Tsuji S, Tsuji M, Sawaoka H, Kimura Y, Shiozaki H, Hori M. Cyclooxygenase-2 overexpression enhances lymphatic invasion and metastasis in human gastric carcinoma. Am J Gastro-enterol. 1999;94:451-455. [PubMed] |
| 29. | Fosslien E. Review: molecular pathology of cycloo-xygenase-2 in cancer-induced angiogenesis. Ann Clin Lab Sci. 2001;31:325-348. [PubMed] |
| 30. | Ohno R, Yoshinaga K, Fujita T, Hasegawa K, Iseki H, Tsunozaki H, Ichikawa W, Nihei Z, Sugihara K. Depth of invasion parallels increased cyclooxy-genase-2 levels in patients with gastric carcinoma. Cancer. 2001;91:1876-1881. [PubMed] |
| 31. | Lim HY, Joo HJ, Choi JH, Yi JW, Yang MS, Cho DY, Kim HS, Nam DK, Lee KB, Kim HC. Increased expression of cyclooxygenase-2 protein in human gastric carcinoma. Clin Cancer Res. 2000;6:519-525. [PubMed] |
| 32. | Arbiser JL. Implications of Epstein-Barr Virus (EBV)-induced carcinogenesis on cutaneous inflam-mation and carcinogenesis: evidence of recurring patterns of angiogenesis and signal transduction. J Invest Dermatol. 2005;124:xi-xii. [PubMed] |
| 33. | Yoshiji H, Noguchi R, Kuriyama S, Yoshii J, Ikenaka Y. Combination of interferon and angiotensin-converting enzyme inhibitor, perindopril, suppre-sses liver carcinogenesis and angiogenesis in mice. Oncol Rep. 2005;13:491-495. [PubMed] |
| 34. | Onizuka S, Kawakami S, Taniguchi K, Fujioka H, Miyashita K. Pancreatic carcinogenesis: apoptosis and angiogenesis. Pancreas. 2004;28:317-319. [PubMed] |
| 35. | Chu AJ, Chou TH, Chen BD. Prevention of colorec-tal cancer using COX-2 inhibitors: basic science and clinical applications. Front Biosci. 2004;9:2697-2713. [PubMed] |
| 36. | Tatsuguchi A, Matsui K, Shinji Y, Gudis K, Tsukui T, Kishida T, Fukuda Y, Sugisaki Y, Tokunaga A, Tajiri T. Cyclooxygenase-2 expression correlates with angiogenesis and apoptosis in gastric cancer tissue. Hum Pathol. 2004;35:488-495. [PubMed] |