修回日期: 2005-12-12
接受日期: 2005-12-19
在线出版日期: 2006-02-18
目的: 研究丹酚酸B的抗氧化性对大鼠肝星状细胞(HSC)的影响.
方法: 采用原位灌注法消化大鼠肝脏, 108 g/L Nycodenz密度梯度离心, 分离肝星状细胞, 分别以不同浓度MDA/SAB处理细胞, MTT法观察细胞的增殖能力, 2', 7'-二氯二氢荧光素(DCFH)掺入反映细胞内氧化水平, Western blot检测增殖细胞核抗原(PCNA)蛋白含量, 免疫组化法检测PDGFR含量.
结果: MDA刺激后, 细胞增殖明显增强, MTT结果显示, 吸光度与对照组相比显著升高(0.253±0.016 vs 0.213±0.004, P< 0.05), 而1 μmol/L SAB(0.182±0.006, P< 0.01)和10 μmol/L SAB(0.179±0.006, P<0.01)均可以显著抑制MDA刺激的HSC增殖. Western blot显示, PCNA蛋白在MDA刺激后明显增加(1.72±0.026 vs 1.223±0.025, P< 0.01), 而1和10 mmol/L SAB可显著抑制PCNA蛋白表达的升高(分别是1.080±0.040和1.066±0.025, P<0.01). MDA可明显刺激细胞PDGF受体的表达(5.5±0.653 vs 对照组3.3±0.616, P<0.01), 提高HSC细胞内氧化水平(荧光强度: 4.721±0.385 vs 对照组2.413±0.662, P< 0.01), 10 mmol/L SAB则可抑制PDGF受体的表达(2.723±0.326)和降低细胞内的氧化水平(3.324±0.264)(P<0.01).
结论: 丹酚酸B可通过影响PDGF信号通路而抑制体外培养HSC的增殖, 且这种抑制作用与丹酚酸B的抗氧化作用有关.
引文著录: 王晓玲, 刘平, 崔云华, 胡旭东, 李伯勤, 应馨萍. 丹酚酸B对MDA刺激的肝星状细胞增殖的抑制作用. 世界华人消化杂志 2006; 14(5): 476-480
Revised: December 12, 2005
Accepted: December 19, 2005
Published online: February 18, 2006
AIM: To investigate the inhibitory effects of salvianolic acid B (SAB) on the proliferation of rat hepatic stellate cells stimulated by malondial-dehyde (MDA).
METHODS: Hepatic stellate cells were derived from normal rat by in situ perfusion, digestion and density gradient centrifugation with 108 g/L Nycodenz. Then the cells were stimulated by MDA (200 mmol/L) for 2 h, and then treated with various concentrations of SAB (1 and 10 mmol/L). The proliferation of cells was assayed by MTT incorporation, and the level of intracellular oxidation was reflected by 2', 7'-dichlorodihydrofluorescein (DCFH). The protein expression of proliferating cell nuclear antigen (PCNA) was determined by Western blot and the expression of platelet-derived growth factor receptor (PDGFR) was detected by immunohistochemistry.
RESULTS: After MDA stimulation, the optical density by MTT was significantly increased in comparison with that of control cells (0.253 ± 0.016 vs 0.213 ± 0.004, P < 0.05). However, after treatment with SAB, the optical density was markedly decreased (1 μmol/L: 0.182 ± 0.006, P < 0.01; 10 μmol/L: 0.179 ± 0.006, P < 0.01). The protein expression of PCNA was notably elevated after MDA stimulation (1.72 ± 0.026 vs 1.223 ± 0.025, P < 0.01), while it was significantly down-regulated by 1 and 10 mmol/L SAB (1.080 ± 0.040 and 1.066 ± 0.025, respectively, P < 0.01). MDA increased the expression of PDGFRb (optical density: 5.5 ± 0.653 vs control, 3.3 ± 0.616, P < 0.01) and intracellular oxidative level (fluorescence intensity: 4.721 ± 0.385 vs control, 2.413 ± 0.662, P < 0.01), but 10 mmol/L SAB suppressed this effect (2.723 ± 0.326, 3.324 ± 0.264 vs MDA, P < 0.01).
CONCLUSION: SAB can inhibit MDA-stimulated proliferation of rat hepatic stellate cells in vitro by affecting PDGF signal transduction, which is associated with the antioxidant effect of SAB.
- Citation: Wang XL, Liu P, Cui YH, Hu XD, Li BQ, Ying XP. Inhibitory effect of salvianolic acid B on malondialdehyde-stimulated proliferation of rat hepatic stellate cells in vitro. Shijie Huaren Xiaohua Zazhi 2006; 14(5): 476-480
- URL: https://www.wjgnet.com/1009-3079/full/v14/i5/476.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i5.476
肝纤维化是肝脏对各种慢性损伤的修复应答过程, 肝星状细胞(hepatic stellate cell, HSC)获得增殖能力并活化为肌成纤维细胞样细胞(myofibroblast-like cell)被认为是肝纤维化形成的关键, 因此HSC常作为肝纤维化治疗的靶细胞[1-5]. 在众多刺激HSC活化的因素中, 氧化应激的作用受到人们的广泛关注. 研究表明, 在四氯化碳[6]、酒精[7]、二甲基亚硝胺[8]、肝炎病毒[9]及铁过载[10]等引起的肝纤维化中, 均存在氧化应激的作用. 体外细胞培养研究结果也发现, 丙二醛(malonialdehyde, MDA)[11]、超氧阴离子[12,13]、乙醛[14,15]等可直接刺激HSC使其活化, 促进胶原基因的表达. 丹酚酸B(又称丹参酸乙, salvianolic-acid B, SAB)是丹参的主要水溶性成分之一, 具有强大的抗氧化作用[16,17]. 体外研究发现他可抑制人皮肤成纤维细胞分泌胶原蛋白[18], 也可以抑制传一代培养的HSC(代表已活化的HSC)的增殖及胶原生成[19], 以及抑制转化生长因子b1在HSC中的信号转导[20,21]. 临床研究显示, SAB的抗肝纤维化效果与g干扰素的结果相似[22] , 为了深入研究SAB抗肝纤维化及影响HSC的机制, 我们曾以SAB作用于原代培养, 处于静止期的HSC, 发现SAB也可抑制静止期HSC的增殖. 在此基础上我们研究了SAB的抗氧化性与抑制原代培养的HSC(代表正在活化的HSC)增殖之间的关系, 以期明确SAB的对正在活化的大鼠HSC增殖的影响.
Wistar♂大鼠, 购自上海中医药大学实验动物中心, 普通级, 550 g左右, 普通饲料喂养, 自由饮水. SAB由中国科学院上海药物研究所从上海崇明人工栽培丹参中分离、提取、鉴定, 所用SAB均为同一批号来源. 单克隆小鼠抗大鼠增殖细胞核抗原(proliferating cell nuclear antigen, PCNA)抗体、多克隆兔抗大鼠PDGFR-b抗体CALBIOCHEM公司产品; 辣根过氧化物酶标记羊抗小鼠抗体、增强化学发光显影剂ECL, 购自Amersham Pharmacia Biotech公司. 辣根过氧化物酶标记羊抗兔抗体、液体DAB酶底物显色试剂盒, 购自Antibody Diagnostica Inc公司; 其余试剂均为国产或进口分析纯.
肝星状细胞的分离方法及培养方法: 肝脏原位灌流消化、Nycodenz密度梯度离心. 新分离的HSC接种于96孔培养板中, 随机分正常对照组、200 μmoL/L MDA处理组、1 μmoL/L SAB组和10 μmo/L SAB组, MDA作用2 h后换不同浓度的SAB温育48 h, 加入MTT贮存液(5 g/L)10 μL/孔, 继续温育4 h. 显微镜下见密集微小蓝黑色结晶. 吸弃培养上清液, 加入酸性(含0.04 mol HCL)异丙醇0.1 mL/孔, 轻柔振荡溶解黑色结晶物, 酶标仪检测. 将蛋白样品50 μg经SDS-PAGE电泳, 转膜、封闭, 一抗、二抗温育后, ECL显影、曝光. 收集细胞爬片以0.01 mol/L PBS冲洗, 40 g/L甲醛固定, 3 mL/L H2O2断内源性过氧化物酶, 加PDGFR-b抗体, 加二抗工作液, 显色, 镜下观察, 水洗终止, 晾干. 每个样本随机选择6个视野, 显微摄像及图像分析. 新分离的HSC接种于24孔培养板, 24 h后换液并加药继续培养48 h后加10 mol/L DCFH[23], 37 ℃温育60 min, 吸弃培养液, PBS冲洗培养孔3次, 荧光显微摄影, 观察细胞内氧化程度. 每个样本随机选择6个视野, 显微摄像及图像分析.
统计学处理 数值以均数±标准差(mean±SD)表示, 双侧t检验.
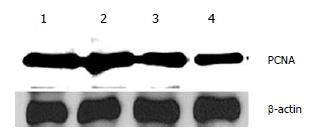
MTT结果显示, 与对照组(n = 4, 0.213±0.004)相比, MDA(n = 4, 0.253±0.016, P< 0.05)MTT的吸光值明显增加, 表明MDA可刺激星状细胞的增殖, 1 μmol/L丹酚酸B(n = 4, 0.182±0.006, P< 0.01)和10 μmol/L丹酚酸B(n = 4, 0.179±0.006, P<0.01)组吸光值显著降低, 表明对经MDA刺激的肝星状细胞增殖均有显著的抑制效果. Western blot结果显示, 与对照组相比(n = 3, 1.223±0.025)经MDA作用后细胞表达PCNA的量明显增加(n = 3, 1.72±0.026, P< 0.01), 1 μmol/L SAB(n = 3, 1.080±0.040, P< 0.01)和10 μmol/L SAB(n = 3, 1.066±0.025, P<0.01)均可抑制HSC PCNA的表达(图1), 即抑制细胞的增殖, 与MTT结果一致.
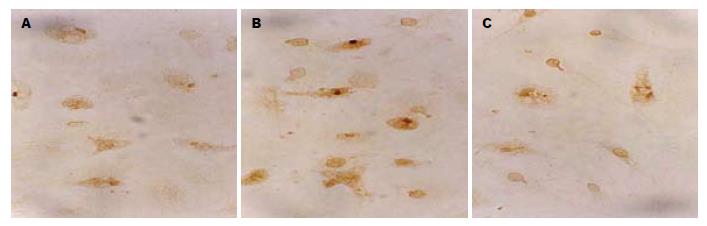
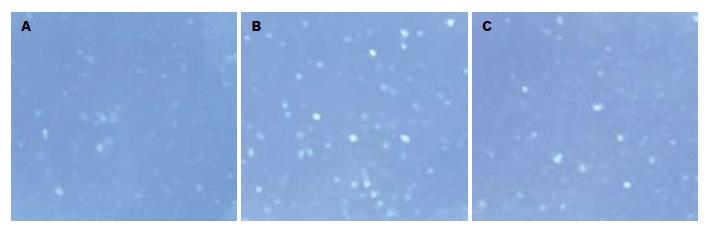
MDA刺激组(n = 6, 4.721±0.385, P<0.01)与正常对照组(n = 6, 2.413±0.662, P<0.01)比较, 荧光发光较多、较强; 经10 μmol/L SAB(n = 6, 3.324±0.264, P<0.01)作用后, 荧光减少、变暗(图2). 表明SAB可抑制细胞内氧化应激, 对于MDA引起的氧化应激有一定的拮抗作用. MDA刺激组(n = 6, 5.5±0.653)PDGFR-b的光密度较正常组(n = 6, 3.3±0.616, P<0.01)的光密度显著增加; 10 μmol/L SAB(n= 6, 2.723±0.326 vs MDA组P<0.01)的光密度明显减少(图3).
丹酚酸B(SAB)是丹参的主要水溶性成分之一, 是一种酚性酸成分, 具有良好的抗D-半乳糖胺急性肝损伤和四氯化碳肝纤维化的作用, 对四氯化碳体外损伤肝细胞有保护作用, 也可抑制传一代培养的HSC(代表已活化的HSC)增殖及胶原的生成[19]. 对脂质过氧化有很强的抑制作用, 并对自由基有一定的清除作用[16,17]. 临床上已初步显示出具有一定的抗肝纤维化作用[22].
SAB结构式中的酚羟基, 可释放活性氢阻断剂阻断脂质过氧化反应[24]. 本实验中, 脂质过氧化产物MDA刺激后的HSC增殖明显, PCNA的表达增加, SAB可抑制MDA刺激后HSC的增殖并抑制PCNA的表达(P<nm), 测定荧光强度, 可相对定量细胞内氧化水平 0.01); 2', 7'-二氯二氢荧光素双乙酸盐(DCFH-DA)可自由进入细胞内, 在细胞内DCFH-DA被氧化成2', 7'-二氯二氢荧光素(DCF), 产生绿色荧光(510-550[23]. 在培养的人成纤维细胞中加入MDA可增加前胶原aⅠ基因表达和胶原产生水平[25]. Lee et al[11]的研究表明MDA或脂质过氧化反应诱导物能明显激活静息状态的HSC, 刺激HSC进入S期. MDA刺激后的HSC, DCFH-DA在细胞内被氧化而产生荧光强度增加, SAB可以拮抗MDA刺激产生的细胞内氧化. PDGF是刺激HSC增殖的最强的细胞因子[26,27], 其增殖信号通过细胞表面的受体传递到细胞内, 本实验中MDA可促进PDGF受体b的表达, 而SAB可拮抗这种作用. 这些研究结果表明SAB可降低细胞内氧化水平减少MDA的产生, 并因此通过抑制PDGF受体的表达而抑制细胞增殖.
总之, SAB通过减少HSC细胞内的过氧化, 抑制了PDGF信号通路从而抑制了体外培养的原代大鼠HSC的增殖.
肝纤维化是慢性肝炎向肝硬化发展的关键, 也是治疗的关键. 目前的研究认为, 肝纤维化是可以逆转的而肝硬化则不可逆转. 因此, 对肝纤维化的治疗研究是肝脏病学研究的一个热点.
肝星状细胞获得增殖能力并活化为肌成纤维细胞是肝纤维化形成的关键. 因此, 星状细胞常常作为肝纤维化形成的关键机制研究的重点和药物治疗的靶点.
1 王晓玲, 崔云华, 胡旭东, 刘平. 丹酚酸B对大鼠肝星状细胞增殖周期的抑制作用. 中华消化杂志 2004; 24: 59
2 崔云华, 王晓玲等. 丹参酸乙的抗氧化作用对大鼠肝星状细胞增殖的影响. 世界华人消化杂志 2002; 10: 317-319
3 崔云华, 王晓玲等. 丹参酸乙对大鼠肝星状细胞内氧化水平及增殖细胞核抗原的影响. 中西医结合肝病杂志 2003; 13: 210-212
本文以从大鼠肝脏分离培养的原代星状细胞为研究对象, 从细胞的整体水平研究丹参有效成分--丹酚酸B对细胞周期的调节作用, 发现其通过影响PDGF信号通路而抑制体外培养HSC的增殖, 且这种抑制作用与丹酚酸B的抗氧化作用有关.
丹参作为临床常用且有效的抗肝纤维化药物, 其有效成分的研究也是一个重要方面, SAB是丹参的主要水溶性成分之一, 研究发现有较好的抗肝纤维化效果, 对其机制的充分研究, 有望成为抗肝纤维化新药, 而进入临床应用.
氧化应激(oxida-tive stress)是指"促氧化与抗氧化之间的平衡失调而倾向于前者,导致可能的损害". 促氧化是由体内的各种氧化剂来实现的, 而最主要的氧化剂是活性氧(reactive oxygen species, ROS). ROS是指一组含有化学性质活泼的含氧功能基团的化合物; 包括含氧自由基、氧的非自由基衍生物、对氧化物、氢过氧化物、脂质过氧化物、环氧代谢物等.
研究丹酚酸B对星状细胞增殖的抑制是发展中医药抗肝纤维化的重要基础研究. 本文研究了丹酚酸B对脂质过氧化产物MDA刺激的肝星状细胞增殖的抑制作用, 并初步探讨了其可能的机制是下调MDA诱导的PDGFR的表达增强, 有一定的新颖性.
电编: 张敏 编辑:张海宁
| 1. | Bataller R, Brenner DA. Hepatic stellate cells as a target for the treatment of liver fibrosis. Semin Liver Dis. 2001;21:437-451. [PubMed] |
| 2. | Iredale JP. Hepatic stellate cell behavior during resolution of liver injury. Semin Liver Dis. 2001;21:427-436. [PubMed] |
| 3. | Benyon RC, Arthur MJ. Extracellular matrix degra-dation and the role of hepatic stellate cells. Semin Liver Dis. 2001;21:373-384. [PubMed] |
| 4. | Sato M, Suzuki S, Senoo H. Hepatic stellate cells: unique characteristics in cell biology and pheno-type. Cell Struct Funct. 2003;28:105-112. [PubMed] |
| 5. | Safadi R, Friedman SL. Hepatic fibrosis-role of hepatic stellate cell activation. MedGenMed. 2002;4:27. [PubMed] |
| 6. | Tirkey N, Pilkhwal S, Kuhad A, Chopra K. Hesper-idin, a citrus bioflavonoid, decreases the oxidative stress produced by carbon tetrachloride in rat liver and kidney. BMC Pharmacol. 2005;5:2. [PubMed] |
| 7. | Zhou Z, Sun X, Lambert JC, Saari JT, Kang YJ. Metallothionein-independent zinc protection from alcoholic liver injury. Am J Pathol. 2002;160:2267-2274. [PubMed] |
| 8. | Lu G, Shimizu I, Cui X, Itonaga M, Tamaki K, Fuku-no H, Inoue H, Honda H, Ito S. Antioxidant and antiapoptotic activities of idoxifene and estradiol in hepatic fibrosis in rats. Life Sci. 2004;74:897-907. [PubMed] |
| 9. | Shackel NA, McGuinness PH, Abbott CA, Gorrell MD, McCaughan GW. Insights into the pathobio-logy of hepatitis C virus-associated cirrhosis: analy-sis of intrahepatic differential gene expression. Am J Pathol. 2002;160:641-654. [PubMed] |
| 10. | Brown KE, Dennery PA, Ridnour LA, Fimmel CJ, Kladney RD, Brunt EM, Spitz DR. Effect of iron overload and dietary fat on indices of oxidative stress and hepatic fibrogenesis in rats. Liver Int. 2003;23:232-242. [PubMed] |
| 11. | Lee KS, Buck M, Houglum K, Chojkier M. Activation of hepatic stellate cells by TGF alpha and collagen type I is mediated by oxidative stress through c-myb expression. J Clin Invest. 1995;96:2461-2468. [PubMed] |
| 12. | Galli A, Svegliati-Baroni G, Ceni E, Milani S, Ridolfi F, Salzano R, Tarocchi M, Grappone C, Pellegrini G, Benedetti A. Oxidative stress stimulates proliferation and invasiveness of hepatic stellate cells via a MMP2-mediated mechanism. Hepatology. 2005;41:1074-1084. [PubMed] |
| 13. | Novo E, Marra F, Zamara E, Valfre di Bonzo L, Caligiuri A, Cannito S, Antonaci C, Colombatto S, Pinzani M, Parola M. Dose dependent and diver-gent effects of superoxide anion on cell death, proli-feration, and migration of activated human hepatic stellate cells. Gut. 2006;55:90-97. [PubMed] |
| 14. | Chen A, Davis BH. The DNA binding protein BTEB mediates acetaldehyde-induced, jun N-terminal kinase-dependent alphaI(I) collagen gene expression in rat hepatic stellate cells. Mol Cell Biol. 2000;20:2818-2826. [PubMed] |
| 15. | Svegliati-Baroni G, Inagaki Y, Rincon-Sanchez AR, Else C, Saccomanno S, Benedetti A, Ramirez F, Rojkind M. Early response of alpha2(I) collagen to acetaldehyde in human hepatic stellate cells is TGF-beta independent. Hepatology. 2005;42:343-352. [PubMed] |
| 16. | Chen YH, Du GH, Zhang JT. Salvianolic acid B protects brain against injuries caused by ischemia-reperfusion in rats. Acta Pharmacol Sin. 2000;21:463-466. [PubMed] |
| 17. | Lin YL, Chang YY, Kuo YH, Shiao MS. Anti-lipid-peroxidative principles from Tournefortia sarm-entosa. J Nat Prod. 2002;65:745-747. [PubMed] |
| 18. | Shigematsu T, Tajima S, Nishikawa T, Murad S, Pinnell SR, Nishioka I. Inhibition of collagen hydroxylation by lithospermic acid magnesium salt, a novel compound isolated from Salviae miltiorr-hizae Radix. Biochim Biophys Acta. 1994;1200:79-83. [PubMed] |
| 19. | Liu P, Liu CH, Wang HN, Hu YY, Liu C. Effect of salvianolic acid B on collagen production and mitogen-activated protein kinase activity in rat hepatic stellate cells. Acta Pharmacol Sin. 2002;23:733-738. [PubMed] |
| 20. | Liu C, Liu P, Hu Y, Zhu D. Effects of salvianolic acid-B on TGF-beta 1 stimulated hepatic stellate cell activation and its intracellular signaling. Zhonghua Yixue Zazhi. 2002;82:1267-1272. [PubMed] |
| 21. | Zhao JF, Liu CH, Hu YY, Xu LM, Liu P, Liu C. Effect of salvianolic acid B on Smad3 expression in hepatic stellate cells. Hepatobiliary Pancreat Dis Int. 2004;3:102-105. [PubMed] |
| 22. | Liu P, Hu YY, Liu C, Zhu DY, Xue HM, Xu ZQ, Xu LM, Liu CH, Gu HT, Zhang ZQ. Clinical observa-tion of salvianolic acid B in treatment of liver fibro-sis in chronic hepatitis B. World J Gastroenterol. 2002;8:679-685. [PubMed] |
| 23. | Rothe G, Valet G. Flow cytometric analysis of respi-ratory burst activity in phagocytes with hydroe-thidine and 2', 7'-dichlorofluorescin. J Leukoc Biol. 1990;47:440-448. [PubMed] |
| 24. | Chojkier M, Houglum K, Solis-Herruzo J, Brenner DA. Stimulation of collagen gene expression by ascorbic acid in cultured human fibroblasts. A role for lipid peroxidation? J Biol Chem. 1989;264:16957-16962. [PubMed] |
| 25. | Pinzani M, Marra F. Cytokine receptors and signa-ling in hepatic stellate cells. Semin Liver Dis. 2001;21:397-416. [PubMed] |
| 26. | Bonner JC. Regulation of PDGF and its receptors in fibrotic diseases. Cytokine Growth Factor Rev. 2004;15:255-273. [PubMed] |
| 27. | Yang L, Zhang CZ, Zhu QJ. Kangxian ruangan keli inhibits hepatic stellate cell proliferation mediated by PDGF. World J Gastroenterol. 2003;9:2050-2053. [PubMed] |