修回日期: 2005-12-15
接受日期: 2005-12-19
在线出版日期: 2006-02-08
目的: 研究血管生成素-2(Ang-2)及基质金属蛋白酶-7(MMP-7)蛋白在人大肠癌组织中的表达及其与大肠癌临床病理特征的关系.
方法: 应用免疫组化法检测40例大肠癌及其癌旁正常组织中Ang-2及MMP-7蛋白表达水平.
结果: 大肠癌组织中Ang-2蛋白表达阳性率为77.5%(31/40), 明显高于癌旁正常组织40%(16/40)(P = 0.001); Ang-2表达水平与患者性别、年龄及癌组织的部位、大小、分化程度、淋巴结转移无关(P>0.05); 与浸润深度, 远处转移及Dukes'分期相关(分别为P = 0.007, P = 0.023, P = 0.008); 大肠癌组织MMP-7蛋白表达阳性率为85%(34/40), 明显高于癌旁正常组织35%(14/40)(P = 0.000), MMP-7蛋白表达阳性率与Ang-2的表达相关(P = 0.016).
结论: Ang-2蛋白可能通过促进MMP-7的表达从而促进了大肠癌的生长及转移.
引文著录: 李霞, 朱尤庆, 罗峻, 陶文惠, 黄超, 张金梅. 血管生成素-2与基质金属蛋白酶-7在大肠癌中的表达及意义. 世界华人消化杂志 2006; 14(4): 434-437
Revised: December 15, 2005
Accepted: December 19, 2005
Published online: February 8, 2006
AIM: To investigate the expression of angiopo-ietin-2 (Ang-2) and matrix metalloproteinase-7 (MMP-7) protein in human colorectal carcinoma, and to explore the relationship between the two proteins and clinical parameters.
METHODS: Immunohistochemical technique was used to detect the expression of Ang-2 and MMP-7 protein in 40 colorectal carcinoma and their adjacent normal tissues.
RESULTS: The positive rates of Ang-2 and MMP-7 were significantly higher in colorectal carcinoma than those in normal tissues (77.5% vs 40%, P = 0.001; 85% vs 35%, P = 0.000). The level of Ang-2 expression had no marked correlations with the sex and age of patients as well as the site, size, lymph node metastasis or histological differentiation of colorectal carcinoma (all P > 0.05), but it was notably correlated with the invasion depth (P = 0.007), distal metastasis (P = 0.023) and Dukes' staging (P = 0.008). The expression of Ang-2 and MMP-7 were also significantly correlated (P = 0.016).
CONCLUSION: High expression of Ang-2 protein may play an important role in the progression and metastasis of colorectal carcinoma through up-regulation of MMP-7 expression.
- Citation: Li X, Zhu YQ, Luo J, Tao WH, Huang C, Zhang JM. Clinical significance and expression of angiopoietin-2 and matrix metalloproteinase-7 in human colorectal carcinoma. Shijie Huaren Xiaohua Zazhi 2006; 14(4): 434-437
- URL: https://www.wjgnet.com/1009-3079/full/v14/i4/434.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i4.434
大肠癌的血道转移相当常见, 若能降低或消除血道转移, 则可明显改善大肠癌患者的预后. 新近发现血管生成素(angiopoietin, Ang)在血管新生中作用显著, 尤其是血管生成素2(angiopoietin-2, Ang-2), 特异表达于肿瘤边缘的血管重建区, 参与肿瘤血管新生的起始及延续过程, 影响肿瘤生长及转移. 我们应用免疫组化技术, 对40例大肠癌及相应癌旁组织Ang-2及MMP-7蛋白表达情况进行了检测, 旨在探讨 Ang-2在大肠癌发生、发展中的作用及可能的作用机制, 为大肠癌的靶向治疗提供理论依据.
40例标本取自武汉大学中南医院2004/2005外科手术切除经病理确诊且资料完整的原发性大肠癌病例, 所有患者术前未经放疗和化疗. 男性患者30例, 女性患者10例, 年龄36-84岁. 其中结肠癌18例, 直肠癌22例. 癌组织直径: <5 cm 30例; ≥5 cm 10例. Dukes分期: A期4例, B期4例, C期9例, D期23例. 组织学分类: 高、中分化癌31例, 低、未分化癌9例. 癌转移情况: 有淋巴结转移20例, 无淋巴结转移20例; 有血道转移23例, 无血道转移17例. 浸润深度: 浸润至肌层11例, 浸润至浆膜(包括穿透浆膜)29例.
每例取原发癌组织、切缘正常组织及淋巴结组织, 经40 g/L福尔马林固定, 石蜡包埋, 4 μm连续切片, 分别进行HE染色和免疫组化SP染色(操作按试剂盒说明书进行). 兔抗人Ang-2及MMP-7多克隆抗体为武汉博士德生物工程公司产品. SP试剂盒购自福建迈新公司. 以PBS代替一抗作阴性对照.
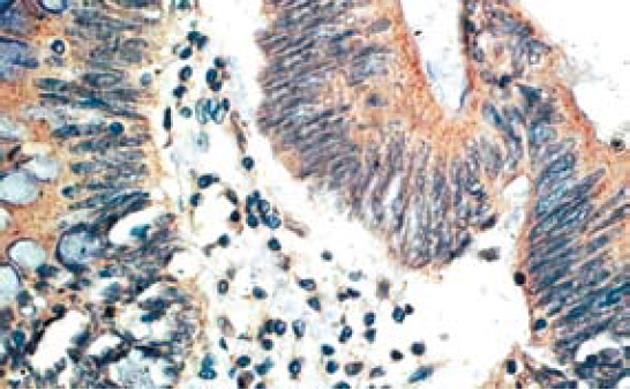
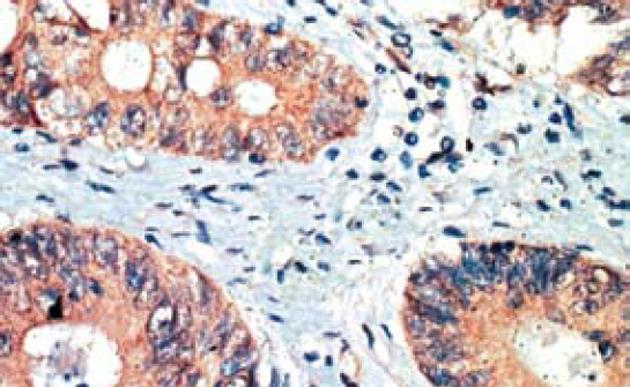
Ang-2及MMP-7染色结果判定均根据胞质染色程度和染色细胞百分比进行评分. 染色程度: 基本不着色者为0分; 着色淡者为1分; 着色适中者为2分; 着色深者为3分. 染色细胞百分比:着色细胞占计数细胞<10%为0分; 11%-30%为1分; 31%-50%为2分; 51%-100%为3分, 将每张切片着色程度和着色细胞百分比得分相乘最后得分0-2分者为阴性, ≥3分者为阳性[1].
统计学处理 采用SPSS 11.5统计软件对数据进行Fisher exact probability test检验, 检验水准α = 0.05. P<0.05表示有统计学差异性, P<0.01表示有显著差异性.
大肠癌组织Ang-2蛋白表达阳性率77.5%(31/40), 癌旁正常组织Ang-2蛋白表达阳性率40%(16/40). 结果表明, Ang-2蛋白在大肠癌组织中表达较正常组织高, 两者差异显著(P = 0.001<0.01)(图1). 大肠癌组织MMP-7蛋白表达阳性率85%(34/40), 癌旁正常组织MMP-7蛋白表达阳性率35%(14/40). 结果表明, MMP-7蛋白在大肠癌组织中表达较癌旁正常组织高, 两者差异显著(P = 0.000<0.01)(图2).
Ang-2蛋白表达水平与患者性别、年龄及癌的部位、体积、组织分化程度、淋巴结转移无关,与肠壁浸润深度、远处转移及临床分期相关(P<0.05). MMP-7蛋白表达水平与患者性别、年龄及癌的部位、体积、组织分化程度、淋巴结转移、肠壁浸润深度、远处转移及临床分期均未见统计学差异(P>0.05)(表1).
| Ang-2阳性率(%) | Ang-2统计分析结果 | MMP-7阳性率(%) | MMP-7统计分析结果 | |
| 性别 | ||||
| 男 | 80%(24/30) | P = 0.665 | 86.7%(26/30) | P = 0.629 |
| 女 | 70%(7/10) | 80%(8/10) | ||
| 年龄 | ||||
| <60岁 | 72.7%(16/22) | P = 0.473 | 81.8%(18/22) | P = 0.673 |
| ≥60岁 | 83.3%(15/18) | 88.9%(16/18) | ||
| 癌部位 | ||||
| 结肠 | 72.2%(13/18) | P = 0.705 | 88.9%(16/18) | P = 0.673 |
| 直肠 | 81.8%(18/22) | 81.8%(18/22) | ||
| 癌体积 | ||||
| <5 cm | 73.3%(22/30) | P = 0.404 | 83.3%(25/30) | P = 1.000 |
| ≥5 cm | 90%(9/10) | 90%(9/10) | ||
| 组织学分类 | ||||
| 高、中分化癌 | 80.6%(25/31) | P = 0.394 | 66.7%(6/9) | P = 0.115 |
| 低、未分化癌 | 66.7%(6/9) | 90.3%(28/31) | ||
| 浸润深度 | ||||
| 肌层 | 45.5%(5/11) | bP = 0.007 | 72.7%(8/11) | P = 0.319 |
| 浆膜(包括穿透浆膜) | 89.7%(26/29) | 89.7%(26/29) | ||
| 淋巴转移 | ||||
| 无 | 70%(14/20) | P = 0.451 | 75%(15/20) | P = 0.182 |
| 有 | 85%(17/20) | 95%(19/20) | ||
| 远处转移 | ||||
| 无 | 58.8%(10/17) | aP = 0.023 | 76.5%(13/17) | P = 0.373 |
| 有 | 91.3%(21/23) | 91.3%(21/23) | ||
| Dukes'分期 | ||||
| A/B期 | 37.5%(3/8) | bP = 0.008 | 62.5%(5/8) | P = 0.082 |
| C/D期 | 87.5%(28/32) | 90.6%(29/32) |
Ang-2阳性表达组中MMP-7阳性率为93.5% (29/31), Ang-2阴性表达组中MMP-7阳性率为55.6%(5/9), 二者差异具有统计学意义(P = 0.016<0.05). MMP-7阳性表达可能与Ang-2有关.
肿瘤血管是为肿瘤细胞输送氧及营养物质的通道, 也是实现肿瘤转移的重要通道之一. 许多因素参与肿瘤的血管生成, 如各种生长因子及其受体、多种蛋白酶、黏附分子、细胞外基质成分等[2]. 血管生成素是与血管新生密切相关的一类血管生长调节因子, 其中Ang-2可通过降低血管的稳定性, 使血管重新进入可塑性强和不稳定状态, 在有VEGF存在的情况下促进血管的生成[3,4].
目前已发现Ang-2在多种肿瘤组织中均有表达, 如胰腺癌[5], 胰腺内分泌瘤[6], 脑胶质瘤[7], 胃癌[8], 肝癌[9,10], 黑色素瘤[11]等, 但国内对Ang-2与大肠癌的研究不多. 我们应用免疫组化技术对40例大肠癌组织及其癌旁正常组织中Ang-2蛋白表达情况进行了检测, 结果表明Ang-2在大肠癌组织呈现过表达, 与癌旁正常组织相比具有显著差异性(P<0.01), 提示Ang-2可能在大肠癌的发生、发展中起着重要作用. 为了探讨Ang-2蛋白表达在大肠癌演进中的作用, 我们进一步分析了Ang-2蛋白表达与大肠癌各临床病理指标的关系. Ang-2表达水平越高, 癌组织浸润越深(P<0.01), 提示Ang-2可能增加癌细胞的侵袭能力, 这与Hu et al[7]的研究结果一致, 他们也发现Ang-2在体内外均可增加Tie-2受体缺失的胶质瘤细胞的侵袭能力. 有远处转移大肠癌Ang-2表达水平高于无远处转移者(P<0.05), Ang-2表达水平与Dukes分期相关, C/D期明显高于A/B期(P<0.01), 提示Ang-2的过表达可促进癌组织血道转移, 影响着大肠癌的发展及预后. 这与Nakayama et al的实验结果一致, 他们的实验也证明Ang-2的表达与胃癌的分期及静脉转移有关[12]. 此外, Peoch et al[13]通过小鼠脑胶质瘤模型的研究发现Ang-2的表达与血管生成呈现同步升高. Etoh et al[14]对胃癌的研究发现Ang-2转染小鼠与未转染组及空载质粒转染组比较, 转移性更强, 血管形成更多. Ang-2表达越高的胃癌患者, 则涉及更多血管生成, 肿瘤恶性度越高, 预后越差. 在对非小细胞肺癌的研究中也有人发现Ang-2与5年生成率相关[15]. 因此, Ang-2蛋白表达水平, 有可能成为判断大肠癌的恶性程度及患者预后的指标.
Ang-2的促血管生成机制目前还不太清楚, 有学者认为可能与MMPs有关. MMPs是细胞外基质降解过程中最重要的蛋白水解酶类. MMP-7是MMPs家族中唯一的由上皮肿瘤特异性表达的酶, 可降解Ⅵ型胶原、弹力素、层连蛋白等构成基底膜和ECM的成分. 为进一步探讨Ang-2的作用机制, 我们对MMP-7在大肠癌的蛋白表达情况进行了初步分析. 我们的研究数据表明癌组织MMP-7阳性表达显著高于癌旁正常组织(P<0.01), 提示MMP-7在大肠癌的发生或发展中起着重要作用. 进一步分析未显示MMP7与大肠癌各临床病理指标之间具有统计学相关性, 但有文献报道MMP-7与肿瘤浸润转移密切相关, Adachi et al[16]报告MMP-7在大肠癌浸润先端癌细胞中的高表达和淋巴结转移、肿瘤分期、预后不良呈正相关. 此差异考虑是由于本实验病例总数太少, 尤其是MMP-7阴性表达病例太少之故.
将Ang-2与MMP-7联系起来分析, 我们发现Ang-2阳性组的MMP-7阳性率高于Ang-2阴性组(P<0.05), 提示Ang-2可能通过促进MMP-7的表达, 使细胞外基质降解从而降低血管壁的稳定性. 促MMP-7表达可能是Ang-2促肿瘤血管生成的作用机制. 但Ang-2如何促进MMP-7的表达还有待进一步研究.
总之, Ang-2蛋白在大肠癌的生长转移中可能发挥重要作用, 研究Ang-2与大肠癌侵袭、转移行为间的关系及其作用机制, 有助于我们更进一步深入了解大肠癌生长转移机制, 开辟肿瘤抗血管治疗的新途径, 同时为判断预后提供有价值的分子指标.
肿瘤血管生成前期, 肿瘤靠毛细血管渗透的营养物质维持生长和代谢, 生长缓慢, 其体积不超过2 mm, 可在体内存活数月甚至数年之久. 只有在大量促血管生成因素作用下肿瘤内部血管形成, 肿瘤的生长才明显加速. 肿瘤细胞侵入血管内, 随血流至特定器官, 出现转移. 因此, 血管生成程度可作为多种肿瘤复发、转移和预后的判断标准.
血管生成刺激因子不仅能够刺激血管内皮细胞增殖、迁移、基质蛋白裂解和形成毛细血管结构, 而且也可以作用于血管周围基质细胞和血管壁的平滑肌细胞, 诱导其分泌和增殖. 目前已确定出十几种血管生成刺激因子, 包括VEGF家族, EGF/TGF-α, FGF家族, TNF-α, platelet-activatingf a c t o r (PA F), IL- 8, 血管生成素(angiopoietin, Ang)等. Ang及其受体是目前研究的热点之一.
目前已发现Ang-2在多种肿瘤组织中均有表达, 但国人对Ang-2与大肠癌的研究较少, 并且Ang-2的作用机制目前也还不明确.
本研究结果为进一步深入研究Ang-2的促血管作用机制奠定了基础, 有助于开辟肿瘤抗血管治疗的新途径, 同时为判断预后提供有价值的分子指标.
Ang-2与MMP-7均参与大肠癌的发生, 同时MMP-7在大肠癌发生中具有高度特异性. 本文从研究Ang-2与MMP-7两者关系出发, 探讨其与大肠癌的发生与转移的关系, 有一定创新性.
电编: 张敏 编辑:菅鑫妍 审读:张海宁
| 1. | Ochiumi T, Tanaka S, Oka S, Hiyama T, Ito M, Kitadai Y, Haruma K, Chayama K. Clinical sig-nificance of angiopoietin-2 expression at the dee-pest invasive tumor site of advanced colorectal car-cinoma. Int J Oncol. 2004;24:539-547. [PubMed] |
| 2. | Papetti M, Herman IM. Mechanisms of normal and tumor-derived angiogenesis. Am J Physiol Cell Physiol. 2002;282:C947-C970. [PubMed] [DOI] |
| 3. | Holash J, Wiegand SJ, Yancopoulos GD. New model of tumor angiogenesis: dynamic balance between vessel regression and growth mediated by angiopoietins and VEGF. Oncogene. 1999;18:5356-5362. [PubMed] [DOI] |
| 4. | Goede V, Schmidt T, Kimmina S, Kozian D, Augus-tin HG. Analysis of blood vessel maturation proce-sses during cyclic ovarian angiogenesis. Lab Invest. 1998;78:1385-1394. [PubMed] |
| 5. | Durkin AJ, Bloomston M, Yeatman TJ, Gilbert-Barness E, Cojita D, Rosemurgy AS, Zervos EE. Differential expression of the Tie-2 receptor and its ligands in human pancreatic tumors. J Am Coll Surg. 2004;199:724-731. [PubMed] [DOI] |
| 6. | Bloomston M, Durkin A, Yang I, Rojiani M, Rosem-urgy AS, Enkmann S, Yeatman TJ, Zervos EE. Iden-tification of molecular markers specific for pancreatic neuroendocrine tumors by genetic profiling of core biopsies. Ann Surg Oncol. 2004;11:413-419. [PubMed] [DOI] |
| 7. | Hu B, Guo P, Fang Q, Tao HQ, Wang D, Nagane M, Huang HJ, Gunji Y, Nishikawa R, Alitalo K. Angiopoietin-2 induces human glioma invasion through the activation of matrix metalloprotease-2. Proc Natl Acad Sci USA. 2003;100:8904-8909. [PubMed] [DOI] |
| 8. | Sun XD, Liu XE, Wu JM, Cai XJ, Mou YP, Li JD. Ex-pression and significance of angiopoietin-2 in gas-tric cancer. World J Gastroenterol. 2004;10:1382-1385. [PubMed] |
| 9. | Mitsuhashi N, Shimizu H, Ohtsuka M, Wakabaya-shi Y, Ito H, Kimura F, Yoshidome H, Kato A, Nukui Y, Miyazaki M. Angiopoietins and Tie-2 expre-ssion in angiogenesis and proliferation of human hepatocellular carcinoma. Hepatology. 2003;37:1105-1113. [PubMed] [DOI] |
| 10. | Tanaka S, Mori M, Sakamoto Y, Makuuchi M, Sugimachi K, Wands JR. Biologic significance of angiopoietin-2 expression in human hepatocellular carcinoma. J Clin Invest. 1999;103:341-345. [PubMed] [DOI] |
| 11. | Pomyje J, Zivny JH, Stopka T, Simak J, Vankova H, Necas E. Angiopoietin-1, angiopoietin-2 and Tie-2 in tumour and non-tumour tissues during growth of ex-perimental melanoma. Melanoma Res. 2001;11:639-643. [PubMed] [DOI] |
| 12. | Nakayama T, Yoshizaki A, Kawahara N, Ohtsuru A, Wen CY, Fukuda E, Nakashima M, Sekine I. Expression of Tie-1 and 2 receptors, and angiopoie-tin-1, 2 and 4 in gastric carcinoma; immunohisto-chemical analyses and correlation with clinicopa-thological factors. Histopathology. 2004;44:232-239. [PubMed] [DOI] |
| 13. | Peoch M, Farion R, Hiou A, Le Bas JF, Pasquier B, Remy C. Immunohistochemical study of VEGF, angiopoietin 2 and their receptors in the neovascu-larization following microinjection of C6 glioma cells into rat brain. Anticancer Res. 2002;22:2147-2151. [PubMed] |
| 14. | Etoh T, Inoue H, Tanaka S, Barnard GF, Kitano S, Mori M. Angiopoietin-2 is related to tumor angio-genesis in gastric carcinoma: possible in vivo regula-tion via induction of proteases. Cancer Res. 2001;61:2145-2153. [PubMed] |
| 15. | Tanaka F, Ishikawa S, Yanagihara K, Miyahara R, Kawano Y, Li M, Otake Y, Wada H. Expression of angiopoietins and its clinical significance in non-small cell lung cancer. Cancer Res. 2002;62:7124-7129. [PubMed] |