修回日期: 2005-12-05
接受日期: 2005-12-24
在线出版日期: 2006-02-08
目的: 探讨骨髓间充质干细胞在胰腺生理更新和病理再生中的作用.
方法: 将60只SD大鼠随机分为5组, 每组12只. A组为正常阴性对照组, 不作任何处理, B组为自体骨髓回输对照组, C组为雨蛙肽致轻度胰腺炎(MAP)模型组, D组为L-精氨酸致重度胰腺炎(SAP)模型组, E组为粒细胞集落因子(G-CSF)预处理组(SAP+GSF): 在造模前3 d, sc G-CSF 40 μg/(kg•d), 共3 d, 其余处理同D组. 造模前3 d用核染料Hoechst33258标记自体骨髓间充质干细胞(MSC), 并回输到自体骨髓腔. 于骨髓干细胞回输后的2 wk和8 wk, 分批处死大鼠, 采集胰腺, 立即进行冰冻切片, 荧光显微镜下直接观察胰腺组织中是否有呈现黄绿色荧光的细胞, 选择有上述黄绿色荧光的冰冻切片进行免疫荧光染色, 观察有无Cytokeratin 19、胰岛素和胰高血糖素染色呈阳性的细胞.
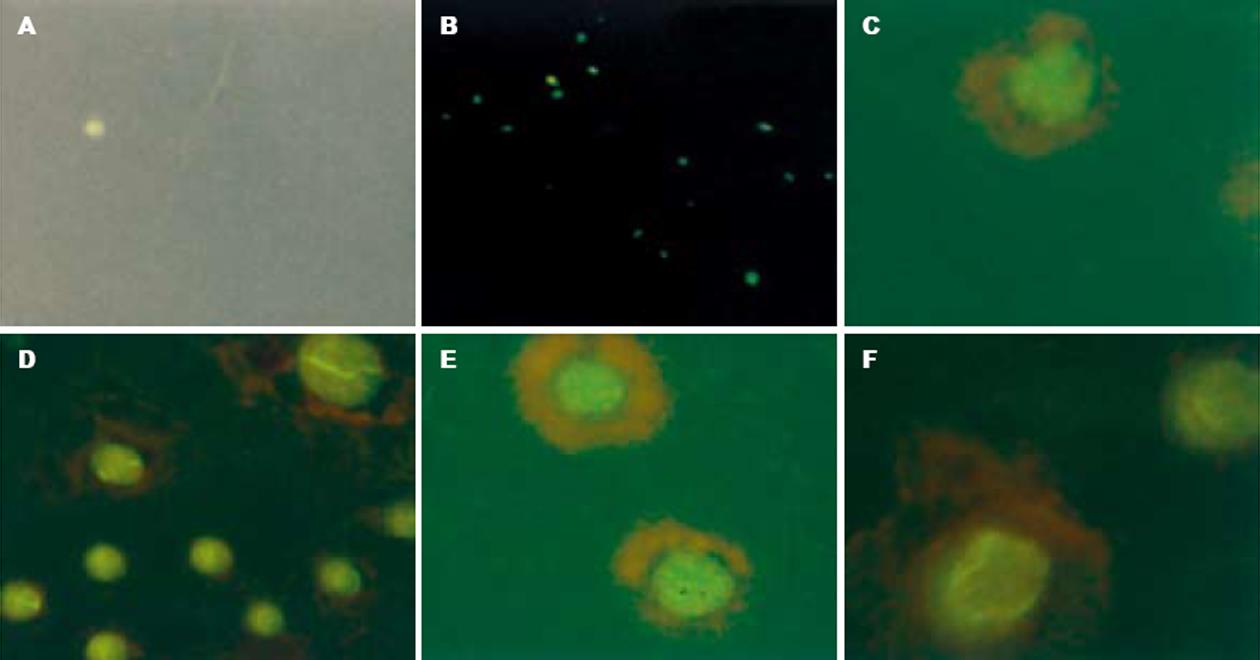
结果: A组的胰腺冰冻切片未见有黄绿色荧光. 造模后2 wk, B、C、E和D组存活大鼠可见标记的MSC出现在正常胰腺组织和损伤胰腺组织中, 在正常胰腺组织中偶见, 而在损伤胰腺组织中多见, 尤以GSF预处理组最多见, C、D、E组一直持续到8 wk仍可见到黄绿色荧光. A和D组死亡大鼠未见Cytokeratin 19、胰岛素和胰高血糖素染色呈阳性的细胞. 造模后2 wk, B、C、E和D组存活大鼠掺入损伤胰腺中的MSC均有分化为Cytokeratin 19染色阳性的细胞, 未见胰岛素和胰高血糖素染色呈阳性的细胞. 造模后8 wk, 胰岛素和胰高血糖素染色呈阳性的细胞在C、D组偶见, E组散见.
结论: 自体骨髓间充质干细胞参与胰腺的生理更新和病理再生.
引文著录: 江学良, 李兆申, 崔慧斐. 骨髓间充质干细胞在胰腺生理更新和病理再生中的作用. 世界华人消化杂志 2006; 14(4): 398-404
Revised: December 5, 2005
Accepted: December 24, 2005
Published online: February 8, 2006
AIM: To investigate the role of bone marrow mesenchymal stem cells (MSC) in pancreatic self-restoration and pathological regeneration.
METHODS: Sixty Sprague-Dawley (SD) rats were randomly assigned into 5 groups (n = 12). Group A acted as the normal negative control without any treatment, and group B received labeled autologous bone marrow MSC only. Group C was induced mild acute pancreatitis by subcutaneous injection of caerulein 20 mg/(kg·h) 4 times, and group D was induced severe acute pancreatitis by intraperitoneal injection of L-arginine (2 g/kg) twice. Group E was the stem cell mobilized group treated by injection of granulocyte-colony stimulating factor (G-CSF) into rats for 3 d at a dose of 40 mg/(kg·d) 3 d before the induction of SAP. MSC were stained with Hoechst33258 and transplanted into their original cavity. Two and eight weeks after transplantation, the rats were sacrificed, and pancreatic tissues were harvested. Samples were snap-frozen and sectioned on a cryostat. The presence of labeled MSC in the cryostat prepared was examined directly by fluorescent microscopy. The positive sections were selected for further immunofluorescence assay. Anti-Cytokeratin(CK)19, anti-glucagon and anti-insulin immunofluorescence staining were performed on the pancreatic sections to determine whether incorporated MSC differentiated into mature pancreatic cells.
RESULTS: Frozen section of pancreas in group A didn't appear yellow-green fluorescence. The labeled MSC were detected in normal pancreatic tissues in group B and in injured pancreatic tissues in group C, D and E, especially in group E, which lasted 8 wk. The results of immunofluorescence analysis were as follows: All tests were negative in controls, including spontaneous fluorescence control, fluorescence antibody control and inhibitory control. No positive cells with CK19, insulin and glucagons were visualized in group A and D (died rats). Positive cells with CK19, which differentiated from the labeled MSC, were found in normal pancreas in group B and injured pancreatic models in group C, E and D (survival rats). No positive cells with insulin and glucagons were observed 2 wk after modeling, while the positive cells appeared 8 wk after modeling in group C, D and E.
CONCLUSION: The bone marrow MSC participate in pancreatic self-restoration and pathological regeneration.
- Citation: Jiang XL, Li ZS, Cui HF. Role of bone marrow mesenchymal stem cells in pancreas self-restoration and pathological regeneration. Shijie Huaren Xiaohua Zazhi 2006; 14(4): 398-404
- URL: https://www.wjgnet.com/1009-3079/full/v14/i4/398.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i4.398
受损伤或病变的胰脏可进行自我修复, 胰腺内分泌细胞也常常需要更新, 表明胰腺中可能存在具有分裂能力、并在分裂后进入终末分化的细胞. 尽管已经从胰腺中分离得到了具有分化为胰腺多种细胞的所谓胰腺干细胞[1-11], 但相关研究仍处于初级阶段. 从胰腺导管上皮、胰岛等多部位所得到的各种胰腺干细胞, 以及肝-胰细胞间的相互转化[12-15]在胰腺自我更新和损伤修复中所起的作用, 目前还不明确.
Ianus et al[16]的新近报道采用了将GFP基因置于胰岛素启动子下游的转基因小鼠作为骨髓移植的供体, 受体先作了清髓处理, 之后进行骨髓移植. 结果表明, 骨髓来源的细胞出现在胰岛, 还表达胰岛素及β细胞分化的相关转录因子Glut-2等, 而且该细胞可对葡萄糖的浓度变化作出反应, 并排除细胞融合是骨髓细胞分化为β细胞的机制. 这是进行异体骨髓移植得到的结果, 自然情况下, 自体骨髓也是胰腺干细胞的另一个居所吗? 我们观察了自体骨髓间充质干细胞(MSC)参与胰腺生理更新和损伤修复的情况.
Hoechst 33258(Sigma公司), Hoechst 33258贮存液(1 g/L, 三蒸水为溶剂, 4℃避光冷藏), 鼠抗Cytokeratin 19单抗, 小鼠抗胰岛素单抗, 小鼠抗胰高血糖素单抗(以上3种抗体均为武汉博士德生物工程有限公司, 工作浓度1∶100). 羊抗鼠IgG-CY3(Sigma公司, 工作浓度1∶100), L-精氨酸(Sigma公司), 雨蛙素(caerulein, 美国Sigma产品), DMEM(Gibco公司, 用三蒸水配制, 调pH 7.2后除菌过滤, 分装后4℃冷藏), 小牛血清(杭州四季青公司, 用前56℃ 30 min进行灭活, 分装后-20℃贮存), 淋巴细胞分离液(上海华精生物高科技有限公司), 戊巴比妥钠(上海试剂二厂, 进口分装, 以生理盐水为溶剂配制为10 g/L的溶液), 肝素钠(烟台东城生化有限公司, 以无血清DMEM配制, 浓度为1×106 U/L), 胰酶(Sigma公司, 以无血清DMEM配制成2.5 g/L的溶液), 封片用缓冲甘油(0.5 mol/L pH 9.0的碳酸盐缓冲液与甘油等体积混合). BB5060 Heraeus紫外清洁型细胞培养箱(上海力申科学仪器有限公司), DMIL倒置显微镜(德国Leica公司), CM1850冰冻切片机(德国LEICA), TE300倒置显微镜(日本NIKON公司), Olympus BX60荧光显微镜(日本Olympus公司), Falcon 35 mm塑料培养皿(Becton Dickinson公司). 健康♂Sprague-Dawley(SD)大鼠, 体质量180-220 g, 清洁级, 第二军医大学动物实验中心提供. 适应性饲养1 wk后开始实验. 实验前12 h禁食, 自由饮水.
1.2.1 动物分组: 将大鼠随机分为5组, 每组12只. A组为正常阴性组, 不作任何处理; B组为自体骨髓回输对照组, C组为轻度胰腺炎(MAP)模型组, D组为重度胰腺炎(SAP)模型, E组为粒细胞集落因子(G-CSF)预处理组(SAP+GSF): 在造模前3 d, sc G-CSF 40 μg/(kg•d), 共3 d, 其余处理同D组. 造模前3 d用核染料Hoechst 33258标记自体骨髓MSC, 并回输到自体骨髓腔. 观察其在胰腺生理更新和胰腺病理修复中的作用.
1.2.2 骨髓的采集: 大鼠待穿刺部位用硫化钠溶液进行脱毛处理. 将被毛剪短, 然后用棉球蘸取脱毛剂, 在所需部位涂一薄层, 2-3 min后用温水洗去脱落的被毛, 用纱布擦干即可. 在无菌条件下, 以10 mL一次性注射器(事先吸入0.5 mL抗凝液)直接行股骨穿刺, 针头要加用合适的细针栓, 以防针眼堵塞, 待有突破感后拔出针栓, 抽吸即可, 抽取骨髓1 mL, 立即注入10 mL无菌离心管中, 1 000 r/min离心10 min, 弃去上层液体, 以无菌PBS离心洗涤3次, 弃上清, 细胞沉淀以PBS充分混匀, 小心叠加于2倍体积的淋巴细胞分离液上, 2 500 r/min离心30 min, 收集骨髓单核细胞层, 再用PBS洗涤两次.
1.2.3 原代骨髓造血干细胞HSC和MSC的分离: 参照Piltenger法[17], 即利用密度梯度离心技术, 收集位于培养基和悬浮液界面上的骨髓单个核细胞, 洗涤后铺板培养. 根据MSC与造血干细胞贴壁性能的差异, 将两类细胞分离.
1.2.4 骨髓干细胞的荧光标记和自体骨髓腔回输: 待标记的MSC, 以无血清的DMEM悬浮细胞加入Hoechst 33258贮存液, 使其终浓度为10 µg/L,于37℃, 50 mL/L CO2饱和湿度的CO2孵箱中孵育15 min, 然后用PBS洗涤5次, 以充分洗去未掺入的染料. 将上述标记的骨髓干细胞以约1 mL PBS悬浮, 分别进行自体骨髓腔回输. 按上述骨髓穿刺操作刺入骨髓腔, 将标记好的细胞悬液小心注入后, 再注入0.5 mL PBS, 停顿约0.5 min, 拔出穿刺针, 并按压穿刺部位5 min.
1.2.5 胰腺损伤模型的制作: A组: 正常阴性对照组, SD大鼠不做任何操作处理; B组: 自体骨髓回输对照组; 在标记的自体骨髓细胞回输3 d后, C组和D组复制胰腺损伤模型, C组(依据Oruc et al[18]的方法): 轻度胰腺炎组, 雨蛙肽(caerulein)溶于9 g/L生理盐水中配制成浓度为25 mg/L的caerulein溶液, SD大鼠皮下注射雨蛙肽(caerulein)20 µg/kg, 共4次, 间隔1 h, 注射后自由饮食; D组(根据Tani et al[19]的方法改进): 重度胰腺炎组, L-精氨酸溶于9 g/L生理盐水中配制成浓度为20 g/L的L-精氨酸溶液, SD大鼠腹腔注射2次L-精氨酸(2.0 g/kg体质量), 间隔1 h. E组: 在造模前3 d, sc G-CSF 40 μg/(kg•d), 共3 d, 其余处理同D组.
1.2.6 胰腺的冰冻切片和荧光观察: 于骨髓干细胞回输后的2 wk和8 wk, 分批处死大鼠. 采集胰腺, 立即进行冰冻切片, 荧光显微镜下直接观察胰腺组织中是否有呈现黄绿色荧光的细胞. 对照试验: 取A组大鼠的胰腺, 进行冰冻切片, 观察荧光.
1.2.7 胰腺的免疫荧光观察: 选择有上述黄绿色荧光的冰冻切片进行免疫荧光染色, 步骤如下: 将冰冻切片以800 mL/L的冷乙醇室温固定10 min, PBS洗涤3次, 每次5 s; 置切片于湿盒中, 分别滴加鼠抗Cytokeratin 19的单抗工作液, 37℃孵育1 h, 以PBS洗切片3次, 每次5 s, 滴加羊抗鼠IgG-CY3工作液, 37℃孵育1 h, 以PBS洗切片3次, 每次5 s, 缓冲甘油封片, 荧光显微镜下观察结果, Cytokeratin 19的特异性荧光染色为红色. 对照试验: 自发荧光对照(切片只加PBS, 缓冲甘油封片后, 荧光显微镜下观察); 荧光抗体对照 (切片只加二抗羊抗鼠IgG-CY3染色, 缓冲甘油封片后, 荧光显微镜下观察); 抑制试验: 先将二抗羊抗鼠IgG-CY3与一抗Cytokeratin 19的单抗等量混合, 再加在切片上染色, 缓冲甘油封片后, 荧光显微镜下观察. 胰岛素的免疫荧光染色和胰高血糖素的免疫荧光染色操作同Cytokeratin 19, 只是换用相应的一抗.
1.2.8 免疫荧光结果判定: -: 切片中未见荧光细胞; ±: 切片中偶尔可见荧光细胞, 每个视野中≤3个荧光细胞; +: 切片可见散在荧光细胞, 每个视野中≤10个荧光细胞; ++: 切片中可见较多荧光细胞, 每个视野中≤20个荧光细胞; +++: 切片中可见大量荧光细胞, 每个视野中>20个荧光细胞; ++++: 切片中可见成团荧光细胞, 视野中细胞无法计数.
A、B、C组大鼠无死亡, 造模后72 h内D组有4只死亡, E组有1只死亡.
A组(非处理组)的胰腺冰冻切片未见有黄绿色荧光. 造模后2 wk, B、C、D(存活大鼠)、E组可见标记的MSC出现在正常胰腺组织和损伤胰腺组织中, 在正常胰腺组织中偶见(图1A), 而在损伤胰腺组织中多见, 尤以GSF预处理组最多见(图1B), D组死亡大鼠中仅偶见, C组和D组存活大鼠、E组一直持续到8 wk仍可见到黄绿色荧光(表1).
| 分组 | n | MSC | CK19 | 胰岛素 | 胰高血糖素表达 |
| 表达 | |||||
| 造模后2 wk | |||||
| A组 | 6 | - | - | - | - |
| B组 | 6 | ± | ± | - | - |
| C组 | 6 | + | + | - | - |
| D组 | |||||
| 死亡大鼠 | 4 | ± | - | - | - |
| 存活大鼠 | 2 | ++ | + | - | - |
| E组 | |||||
| 死亡大鼠 | 1 | + | - | - | - |
| 存活大鼠 | 5 | +++ | ++ | - | - |
| 造模后8 wk | |||||
| A组 | 6 | - | - | - | - |
| B组 | 6 | - | - | - | - |
| C组 | 6 | ± | + | ± | ± |
| D组 | 6 | + | + | ± | ± |
| E组 | 5 | + | + | + | + |
个体出生后, 组织损伤修复的细胞来源尚无定论. 一种可能的来源是损伤组织内源性的干细胞样祖细胞, 即已有多种组织分离得到的成体组织干细胞, 如神经[20-22]、血管[23-25]、皮肤[26-28]、肝[29]、消化道[30,31]等. 另一个可能来源是骨髓, 在组织损伤时迁入其中.
受损伤或病变的胰脏如何进行自我修复, 参与胰腺内分泌细胞更新的细胞源自哪里目前还不明确. 2000年发现胰腺干细胞存在的直接证据, 此后分别从胰腺导管上皮、腺泡细胞和胰岛组织中分离得到了具有分化为胰腺多种细胞类型的胰腺干细胞. 美国哈佛大学医学院Bonner-Weir et al[5,12]报道, 90%胰腺切除的大鼠,残存的胰外分泌腺组织可见明显的增殖, 能够形成新的胰岛和胰腺外分泌组织, 提示胰腺存在干细胞或前体细胞, 在特定因素的诱导下, 能够分化成具有特异功能的细胞. 在胰脏的发生中, 外分泌细胞和内分泌细胞来源于具有导管细胞特征的未分化上皮细胞, 说明胰腺导管细胞可能有干细胞的功能[1]. Alison et al[2]从尚未发病的成年非肥胖糖尿病模型小鼠(NOD鼠)胰腺导管上皮细胞诱导分化得到"产生胰岛的干细胞"(islet producing stem cells, IPSCs), 这些干细胞已培养了3 a. 由IPSCs可诱导分化得到有功能的胰岛组织. Peck et al[11]成功地从人和小鼠的胰导管上皮分离了干细胞, 在体外培养条件下能快速增殖, 并失去导管上皮细胞特异性的表型, 该细胞在合适的条件下可分化形成胰岛的各种内分泌细胞, 具有多向分化潜能, 被称为胰腺干细胞. 他们是一种嗜碱性的单核细胞, 直径约8 μm, 呈圆形, 细胞核为圆形或肾形, 较大, 多含2个核仁. 染色质细腻而分散, 胞质中不含颗粒, 在形态上与小淋巴细胞极为相似, 但小淋巴细胞体积较小, 染色质浓集, 核仁不明显且有细胞器. 啮齿动物的资料显示, 胰腺外分泌组织(包括腺泡和导管)经体外培养可形成与直接分离导管上皮单独培养相似的结果, 提示腺泡细胞可能通过逆分化形成导管上皮细胞[8]. 大鼠的Langerhans胰岛细胞, 包括产生胰岛素的β细胞及位于胰腺导管的内分泌细胞前体分化成新的胰岛细胞每隔40-50 d便通过凋亡以来更新一次, 胰岛营养因子如葡萄糖、胰高血糖素样肽作用于小鼠1-48 h便可使胰岛细胞倍增, 由此推测胰岛中可能有胰岛前体细胞存在[2]. Offield et al[9]发现在人及大鼠胰腺中还有表达nestin的胰岛前体细胞存在, 即nestin阳性胰岛前体细胞(nestin-positive islet-derived progenitor cells, NIPs), 并且这种前体细胞还并可由其诱导分化得到胰岛细胞. NIPs不表达导管细胞标志CK19, 所以不是导管细胞; 也不表达成熟胰岛细胞标志, 但表达胰岛细胞早期分化标志PDX-1. 在培养时加入HGF/activin A, 在2.5 mmol/L葡萄糖浓度下NIPs形成细胞团, 并表达胰岛素、胰高血糖素和GLP-1. 另外, 动物实验还发现, 肝脏细胞和胰腺细胞可以在体内互相转变[12-15]. 如通过将标记蛋白为Ⅳ型胰二肽酶(dipeptidase Ⅳ of pancreas, DPPⅣ)的鼠胰腺上皮细胞前体细胞移植到肝或注入到肝门静脉方法, 于移植后6 wk和3 mo分别取材检验发现, 胰腺上皮细胞前体细胞转变成了肝细胞, 表达肝脏特异性蛋白质, 细胞完全融入了肝实质中. 把鼠肝脏干细胞大量地移植到老鼠的胰管里, 3 mo后, 肝脏干细胞转变成了胰脏细胞, 并能分泌胰脏特有的消化酶, 甚至能形成可分泌胰岛素的细胞. TH、Glu T-2、CK19、PDX01、Kit、波形蛋白(vimentin)和Bcl-2等可作为胰腺干细胞的标记物.
现已发现骨髓中至少有两类多能干细胞参与组织修复, 即HSC和MSC. HSC除分化产生血液细胞和免疫细胞外, 还分化产生多种非造血组织[33-36]. MSC也同样具有多能性, 体内外分化产生骨、软骨、脂肪、肌肉、造血基质等[37-41], 而且组织损伤可以促进MSC迁入组织[42]. 现已表明, 造血干细胞和MSC可以分化产生三个胚层来源的细胞[30,38,40,43]. Ianus et al[16]通过将雄性带有GFP基因的骨髓移植给雌鼠后发现, 骨髓可以掺入胰腺中, 并且分化为有功能的内分泌细胞, 而且排除该分化不是由细胞融合引起, 提示骨髓有可能是胰腺干细胞的另一个居所[44].
雨蛙素诱导的大鼠MAP模型和L-精氨酸诱导的大鼠SAP模型轻重不同, 简便、可靠、重复性及可比性好, 适合发病机制和治疗学的研究[18,19]. 腹腔内分次大剂量注射L-精氨酸是新近建立的一种复制重症急性胰腺炎(SAP)的方法[45], 可引起胰腺细胞退变或坏死, 死亡率在30%以上.
本实验结果表明, 在自然情况下, MSC可出现在正常和损伤的胰腺组织中, 但在后者中的数量明显多于前者, 这与Prockop et al[46]的研究一致, 即组织损伤可以促进骨髓干细胞的迁入, 因为损伤部位可能产生迁移因子引导干细胞到达该部位参与组织修复, 例如, 参与成体神经再生的神经干细胞(NSC)能从侧脑室区到达大脑的受损部位, 已经检测到受损部位邻近区域的细胞大量表达BDNF、NT-4/5、NT-3和trkB受体, 这些因子和受体是干细胞迁移的诱导因子. TGFα不但诱导神经干细胞迁移, 还诱导神经干细胞的增殖. 本实验中SAP组死亡大鼠中MSC细胞掺入数量明显少于存活大鼠, 可能与胰腺坏死严重、血液循环障碍有关. GSF预处理组MSC出现在损伤胰腺中的数量最多, 可能与GSF骨髓动员有关, 使骨髓干细胞数量增加, 满足胰腺更新需要.
本实验免疫荧光的结果说明, 造模后2 wk, C、E和D组存活大鼠掺入损伤胰腺中的MSC均有分化为Cytokeratin 19染色阳性的细胞, CK19是胰腺干细胞的分化标志之一, 是上皮细胞骨架的组成成分, 表达在正常上皮和上皮源性肿瘤组织中, 在正常骨髓中无表达[47]. 这表明骨髓来源的干细胞已完成了"本地化", 成为CK19阳性的细胞-胰腺干细胞, 作为后续胰腺生理更新和损伤修复的"后备军", 即归巢至损伤胰腺组织的骨髓干细胞已发生部分分化, 具有了导管上皮的分化标志. 造模后2 wk, C、E和D组未见胰岛素和胰高血糖素染色呈阳性的细胞, 表明骨髓来源的细胞还未成熟为胰岛功能细胞-β和α细胞. 究其原因一方面实验周期短, 而损伤首先刺激胰腺自身原有的干细胞的增殖和分化; 另一方面, 已知干细胞的分化是逐步进行的, 先由干细胞分化为祖细胞, 后者再分化为定向祖细胞, 最后由定向祖细胞进行扩增并分化为成熟的功能细胞. 从本实验结果来看, 造模后8 wk, 胰岛素和胰高血糖素染色呈阳性的细胞在C、D组偶见, E组散见, 提示贮存在胰腺干细胞库中的骨髓来源干细胞可能进入增殖和分化程序, 并最终成为成熟的胰腺功能细胞.
总之, 骨髓间充质干细胞在自然情况下, 可以参与内胚层来源的组织--胰腺的生理更新和损伤修复. 生理情况下, 胰腺更新少、慢, 主要由胰腺干细胞补充, 病理损伤时, 自体骨髓间充质干细胞可随血液循环到达损伤的胰腺, 并且转化为胰腺干细胞, 参与病理修复.
受损伤或病变的胰脏可进行自我修复, 胰腺内分泌细胞也常常需要更新, 表明胰腺中可能存在具有分裂能力、并在分裂后进入终末分化的细胞. 尽管已经从胰腺中分离得到了具有分化为胰腺多种细胞的所谓胰腺干细胞, 但相关研究仍处于初级阶段, 对其在胰腺自我更新和损伤修复中所起的作用, 目前还不明确.
由于缺乏特异标记, 胰腺干细胞分离培养鉴定都很困难. 对胰腺干细胞来源还不清楚, 骨髓间充质干细胞能否转化为胰腺干细胞尚缺乏直接证据.
I anus e t a l 的新近报道采用了将GFP基因置于胰岛素启动子下游的转基因小鼠作为骨髓移植的供体, 受体先作了清髓处理, 之后进行骨髓移植. 结果表明, 骨髓来源的细胞出现在胰岛, 还表达胰岛素及β细胞分化的相关转录因子Glut-2等, 而且该细胞可对葡萄糖的浓度变化作出反应, 并排除细胞融合是骨髓细胞分化为β细胞的机制.
上述相关研究是进行异体骨髓移植得到的结果, 自然情况下, 自体骨髓也是胰腺干细胞的另一个居所吗? 我们观察了自体骨髓间充质干细胞(MSC)参与胰腺生理更新和损伤修复的情况.
骨髓间充质干细胞在自然情况下, 可以参与内胚层来源的组织―胰腺的生理更新和损伤修复. 生理情况下, 胰腺更新少、慢, 主要由胰腺干细胞补充, 病理损伤时, 自体骨髓间充质干细胞可随血液循环到达损伤的胰腺, 并且转化为胰腺干细胞, 参与病理修复.
干细胞: 是一类具有自我更新和多向分化增生能力的原始细胞, 能产生表现型和基因型与自己完全相同的子细胞, 既具有生理性的更新能力, 又具有对损伤与疾病导致的反应与修复功能的细胞.
题目能准确反映研究工作的内容, 有一定的特色, 而且实验结果有一定的参考价值.
电编: 张敏 编辑:张海宁
| 1. | Qu-Petersen Z, Deasy B, Jankowski R, Ikezawa M, Cummins J, Pruchnic R, Mytinger J, Cao B, Gates C, Wernig A. Identification of a novel population of muscle stem cells in mice: potential for muscle regeneration. J Cell Biol. 2002;157:851-864. [PubMed] [DOI] |
| 3. | Brittan M, Wright NA. Stem cell in gastrointestinal structure and neoplastic development. Gut. 2004;53:899-910. [DOI] |
| 4. | Brittan M, Braun KM, Reynolds LE, Conti FJ, Reynolds AR, Poulsom R, Alison MR, Wright NA, Hodivala-Dilke KM. Bone marrow cells engraft within the epidermis and proliferate in vivo with no evidence of cell fusion. J Pathol. 2005;205:1-13. [PubMed] [DOI] |
| 5. | Bonner-Weir S. Perspective: Postnatal pancreatic beta cell growth. Endocrinology. 2000;141:1926-1929. [PubMed] [DOI] |
| 6. | Docherty K. Growth and development of the islets of Langerhans: implications for the treatment of diabetes mellitus. Curr Opin Pharmacol. 2001;1:641-650. [PubMed] [DOI] |
| 7. | Dickson LM, Rhodes CJ. Pancreatic beta-cell growth and survival in the onset of type 2 diabetes: a role for protein kinase B in the Akt? Am J Physiol Endocrinol Metab. 2004;287:E192-E198. [PubMed] [DOI] |
| 8. | Ramiya VK, Maraist M, Arfors KE, Schatz DA, Peck AB, Cornelius JG. Reversal of insulin-dependent diabetes using islets generated in vitro from pancr-eatic stem cells. Nat Med. 2000;6:278-282. [PubMed] [DOI] |
| 9. | Offield MF, Jetton TL, Labosky PA, Ray M, Stein RW, Magnuson MA, Hogan BL, Wright CV. PDX-1 is required for pancreatic outgrowth and differentiation of the rostral duodenum. Development. 1996;122:983-995. [PubMed] |
| 10. | Street CN, Sipione S, Helms L, Binette T, Rajotte RV, Bleackley RC, Korbutt GS. Stem cell-based approaches to solving the problem of tissue supply for islet transplantation in type 1 diabetes. Int J Biochem Cell Biol. 2004;36:667-683. [PubMed] [DOI] |
| 11. | Peck AB, Chaudhari M, Cornelius JG, Ramiya VK. Pancreatic stem cells: building blocks for a better surrogate islet to treat type 1 diabetes. Ann Med. 2001;33:186-192. [PubMed] [DOI] |
| 12. | Bonner-Weir S, Taneja M, Weir GC, Tatarkiewicz K, Song KH, Sharma A, O'Neil JJ. In vitro cultivation of human islets from expanded ductal tissue. Proc Natl Acad Sci USA. 2000;97:7999-8004. [PubMed] [DOI] |
| 14. | Githens S, Schexnayder JA, Moses RL, Denning GM, Smith JJ, Frazier ML. Mouse pancreatic acinar/ductular tissue gives rise to epithelial cultures that are morphologically, biochemically, and functionally indistinguishable from interlobular duct cell cultures. In Vitro Cell Dev Biol Anim. 1994;30A:622-635. [PubMed] [DOI] |
| 15. | Githens S, Schexnayder JA, Desai K, Patke CL. Rat pancreatic interlobular duct epithelium: isolation and culture in collagen gel. In Vitro Cell Dev Biol. 1989;25:679-688. [PubMed] [DOI] |
| 16. | Ianus A, Holz GG, Theise ND, Hussain MA. In vivo derivation of glucose-competent pancreatic endocrine cells from bone marrow without evidence of cell fusion. J Clin Invest. 2003;111:843-850. [PubMed] [DOI] |
| 17. | Pittenger MF, Mackay AM, Beck SC, Jaiswal RK, Douglas R, Mosca JD, Moorman MA, Simonetti DW, Craig S, Marshak DR. Multilineage potential of adult human mesenchymal stem cells. Science. 1999;284:143-147. [PubMed] [DOI] |
| 18. | Oruc N, Ozutemiz AO, Yukselen V, Nart D, Celik HA, Yuce G, Batur Y. Infliximab: a new therapeutic agent in acute pancreatitis? Pancreas. 2004;28:e1-e8. [PubMed] [DOI] |
| 19. | Tani S, Itoh H, Okabayashi Y, Nakamura T, Fujii M, Fujisawa T, Koide M, Otsuki M. New model of acute necrotizing pancreatitis induced by excessive doses of arginine in rats. Dig Dis Sci. 1990;35:367-374. [PubMed] [DOI] |
| 20. | Kopen GC, Prockop DJ, Phinney DG. Marrow stromal cells migrate throughout forebrain and cerebellum, and they differentiate into astrocytes after injection into neonatal mouse brains. Proc Natl Acad Sci USA. 1999;96:10711-10716. [PubMed] [DOI] |
| 21. | Brazelton TR, Rossi FM, Keshet GI, Blau HM. From marrow to brain: expression of neuronal pheno-types in adult mice. Science. 2000;290:1775-1779. [PubMed] [DOI] |
| 22. | Mezey E, Chandross KJ, Harta G, Maki RA, McKer-cher SR. Turning blood into brain: cells bearing neuronal antigens generated in vivo from bone marrow. Science. 2000;290:1779-1782. [PubMed] [DOI] |
| 23. | Orlic D, Kajstura J, Chimenti S, Bodine DM, Leri A, Anversa P. Transplanted adult bone marrow cells repair myocardial infarcts in mice. Ann N Y Acad Sci. 2001;938:221-229. [PubMed] [DOI] |
| 24. | Strauer BE, Brehm M, Zeus T, Kostering M, Hernandez A, Sorg RV, Kogler G, Wernet P. Repair of infarcted myocardium by autologous intraco-ronary mononuclear bone marrow cell transplan-tation in humans. Circulation. 2002;106:1913-1918. [PubMed] [DOI] |
| 25. | Strauer BE, Brehm M, Zeus T, Bartsch T, Schannwell C, Antke C, Sorg RV, Kogler G, Wernet P, Muller HW. Regeneration of human infarcted heart muscle by intracoronary autologous bone marrow cell transplantation in chronic coronary artery disease: the IACT Study. J Am Coll Cardiol. 2005;46:1651-1658. [PubMed] [DOI] |
| 26. | Krause DS, Theise ND, Collector MI, Henegariu O, Hwang S, Gardner R, Neutzel S, Sharkis SJ. Multi-organ, multi-lineage engraftment by a single bone marrow-derived stem cell. Cell. 2001;105:369-377. [PubMed] [DOI] |
| 27. | Korbling M, Katz RL, Khanna A, Ruifrok AC, Rondon G, Albitar M, Champlin RE, Estrov Z. Hepatocytes and epithelial cells of donor origin in recipients of peripheral-blood stem cells. N Engl J Med. 2002;346:738-746. [PubMed] [DOI] |
| 28. | Wang JS, Shum-Tim D, Galipeau J, Chedrawy E, Eliopoulos N, Chiu RC. Marrow stromal cells for cellular cardiomyoplasty: feasibility and potential clinical advantages. J Thorac Cardiovasc Surg. 2000;120:999-1005. [PubMed] [DOI] |
| 29. | Doherty MJ, Ashton BA, Walsh S, Beresford JN, Grant ME, Canfield AE. Vascular pericytes express osteogenic potential in vitro and in vivo. J Bone Miner Res. 1998;13:828-838. [PubMed] [DOI] |
| 30. | Jiang Y, Jahagirdar BN, Reinhardt RL, Schwartz RE, Keene CD, Ortiz-Gonzalez XR, Reyes M, Lenvik T, Lund T, Blackstad M. Pluripotency of mesenchymal stem cells derived from adult marrow. Nature. 2002;418:41-49. [PubMed] [DOI] |
| 31. | Kuznetsov SA, Mankani MH, Gronthos S, Satomura K, Bianco P, Robey PG. Circulating skeletal stem cells. J Cell Biol. 2001;153:1133-1140. [PubMed] [DOI] |
| 33. | Lagasse E, Connors H, Al-Dhalimy M, Reitsma M, Dohse M, Osborne L, Wang X, Finegold M, Weissman IL, Grompe M. Purified hematopoietic stem cells can differentiate into hepatocytes in vivo. Nat Med. 2000;6:1229-1234. [PubMed] [DOI] |
| 34. | Chien KR, Shimizu M, Hoshijima M, Minamisawa S, Grace AA. Toward molecular strategies for heart disease--past, present, future. Jpn Circ J. 1997;61:91-118. [PubMed] [DOI] |
| 35. | Zulewski H, Abraham EJ, Gerlach MJ, Daniel PB, Moritz W, Muller B, Vallejo M, Thomas MK, Habener JF. Multipotential nestin-positive stem cells isolated from adult pancreatic islets differen-tiate ex vivo into pancreatic endocrine, exocrine, and hepatic phenotypes. Diabetes. 2001;50:521-533. [PubMed] [DOI] |
| 36. | Peck AB, Yin L, Ramiya V. Animal models to study adult stem cell-derived, in vitro-generated islet implantation. ILAR J. 2004;45:259-267. [PubMed] [DOI] |
| 37. | Johansson CB, Momma S, Clarke DL, Risling M, Lendahl U, Frisen J. Identification of a neural stem cell in the adult mammalian central nervous system. Cell. 1999;96:25-34. [PubMed] [DOI] |
| 38. | Kotton DN, Ma BY, Cardoso WV, Sanderson EA, Summer RS, Williams MC, Fine A. Bone marrow-derived cells as progenitors of lung alveolar epithelium. Development. 2001;128:5181-5188. [PubMed] |
| 39. | Poulsom R, Forbes SJ, Hodivala-Dilke K, Ryan E, Wyles S, Navaratnarasah S, Jeffery R, Hunt T, Alison M, Cook T. Bone marr-ow contributes to renal parenchymal turnover and regeneration. J Pathol. 2001;195:229-235. [PubMed] [DOI] |
| 40. | Liechty KW, MacKenzie TC, Shaaban AF, Radu A, Moseley AM, Deans R, Marshak DR, Flake AW. Human mesenchymal stem cells engraft and demonstrate site-specific differentiation after in utero transplantation in sheep. Nat Med. 2000;6:1282-1286. [PubMed] [DOI] |
| 42. | Rao MS, Reddy JK. Hepatic transdifferentiation in the pancreas. Semin Cell Biol. 1995;6:151-156. [PubMed] [DOI] |
| 43. | McLin VA, Zorn AM. Organogenesis: making pancreas from liver. Curr Biol. 2003;13:R96-R98. [PubMed] [DOI] |
| 44. | Grant MB, May WS, Caballero S, Brown GA, Guthrie SM, Mames RN, Byrne BJ, Vaught T, Spoerri PE, Peck AB. Adult hematopoietic stem cells provide functional hemangioblast activity during retinal neovascularization. Nat Med. 2002;8:607-612. [PubMed] [DOI] |
| 45. | Okamoto R, Yajima T, Yamazaki M, Kanai T, Mukai M, Okamoto S, Ikeda Y, Hibi T, Inazawa J, Watanabe M. Damaged epithelia regenerated by bone marrow-derived cells in the human gastroin-testinal tract. Nat Med. 2002;8:1011-1017. [PubMed] [DOI] |
| 46. | Prockop DJ. Marrow stromal cells as stem cells for nonhematopoietic tissues. Science. 1997;276:71-74. [PubMed] [DOI] |
| 47. | Toma C, Pittenger MF, Cahill KS, Byrne BJ, Kessler PD. Human mesenchymal stem cells differentiate to a cardiomyocyte phenotype in the adult murine heart. Circulation. 2002;105:93-98. [PubMed] [DOI] |