修回日期: 2006-03-23
接受日期: 2006-03-29
在线出版日期: 2006-12-28
目的: 研究Ad-p27mt转染重组腺病毒对人胃癌细胞凋亡的作用及机制.
方法: Ad-p27mt转染重组腺病毒导入胃癌细胞株SGC-7901内; 流式细胞仪检测凋亡染色体亚二倍体峰值, 了解Ad-p27mt对人胃癌组织凋亡的作用; TUNEL法检测DNA片断, 在Ad-p27mt组和Ad-LacZ组中分析细胞的凋亡.
结果: Ad-p27mt成功转入人胃癌细胞SGC-7901内, 转化率达100%. 流式细胞仪检测发现在感染后18 h出现G1-S相前出现凋亡染色体亚二倍体峰值, 并且DNA电泳出现凋亡特征性的条带; TUNEL法检测Ad-p27治疗组与对照组的凋亡率分别是92.3%±3.76%和2.01%±0.15%, 两组的差异有显著性(P<0.01).
结论: 重组腺病毒转染的人p27突变基因能诱导裸鼠体内人胃癌细胞SGC-7901的凋亡.
引文著录: 朱金水, 张强, 宋明全, 张卫平, 达炜, 陈金联, 孙群. Ad-p27mt转染重组腺病毒治疗裸鼠内人胃癌的分子机制. 世界华人消化杂志 2006; 14(36): 3477-3481
Revised: March 23, 2006
Accepted: March 29, 2006
Published online: December 28, 2006
AIM: To explore the effect of recombinant adenovirus Ad-p27mt on the apoptosis of human gastric cancer cells and its correlative mechanism.
METHODS: The recombinant adenovirus Ad-p27mt was constructed and then transfected into human gastric cancer cell line SGC-7901. The apoptotic peak of hypodiploid chromosomes in SGC-7901 cells was measured by flow cytometry, and the apoptosis of SGC-7901 cells was detected by TUNEL method.
RESULTS: Ad-p27mt was successfully constructed and the infection efficiency reached 100%. After 18-h infection, the apoptotic peak of hypodiploids appeared before G1-S phase and the bands with apoptotic characteristics were shown by DNA electrophoresis. The apoptotic rate of SGC-7901 cells detected by TUNEL method was 89.4%±3.12% (Ad-p27mt group) and 3.12%±0.13% in Ad-p27mt-transfected cells and controls, respectively, and there existed significant difference between the two groups (P<0.01).
CONCLUSION: Human mutant p27 can induce the apoptosis of human gastric cancer cells in vitro.
- Citation: Zhu JS, Zhang Q, Song MQ, Zhang WP, Da W, Chen JL, Sun Q. Molecular mechanism of recombinant adenovirus Ad-p27mt therapy for human gastric cancer in nude mice. Shijie Huaren Xiaohua Zazhi 2006; 14(36): 3477-3481
- URL: https://www.wjgnet.com/1009-3079/full/v14/i36/3477.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i36.3477
凋亡在各种恶性肿瘤细胞的发展过程中占有十分重要的地位. 目前已证实各种抗肿瘤药物如细胞毒性药物、激素或者一些重组基因、药物等能诱导肿瘤的凋亡率增高. 同其他恶性肿瘤一样, 胃癌不仅存在细胞增殖和分化的异常, 同时也存在凋亡的异常. 目前晚期胃癌尚缺乏有效的治疗方法. 因此如何诱导胃癌细胞凋亡是目前的研究重点. 人突变基因p27表达产物(T187A)是一种多功能细胞因子依赖性酶抑制剂(CDKI), 通过抑制细胞从G0/G1期向S期转化起负向调节作用[1-2]. 基于前一阶段的研究, 我们检测经过p27基因突变重组并种植于裸鼠的人胃癌细胞的凋亡指数, 将重组腺病毒Ad-P27mt转化胃癌细胞SGC-7901, 研究其对胃癌细胞凋亡的影响并探讨相关的抗肿瘤机制, 从而寻求对晚期胃癌治疗的新方法.
30只6-7周龄BALB/cnu/nu鼠(体质量18-22 g)和人胃癌细胞株SGC-7901均来自上海肿瘤研究所. 裸鼠皮下种植SGC-7901细胞. RPMI1640培养液和TRIzol总RNA提取试剂盒购自Gibco BRL公司. 鼠抗人p27 kip1多抗体购自Transduction Laboratories公司. 脂质体, 胰酶, DMEM培养液, 200 bp DNA梯度, dNTP, Taq酶和限制性内切酶均购自华美生物公司. pORF9-hp27mt质粒(含人p27突变基因)来自Invivogen公司. E. coli BJ5183购自Stratagene公司. 重组腺病毒和Ad-LacZ(为重组腺病毒的中介)由美国休斯顿大学Robert教授提供. Western blot检测仪器为: TMB system western blot kit, KPL USA. 人胃癌细胞株SGC-7901在加入100 mL/L胎牛血清(FCS), 100 kU/L青霉素, 100 mg/L链霉素和2 mmol/L谷氨酸盐的RPMI1640培养液中生长, 于37 ℃, 50 mL/L CO2饱和湿度条件下培养. 胃癌细胞长满培养瓶80%-90%后即可进行实验处理.
1.2.1 重组腺病毒质粒的制备和鉴定: 基因hP27mt自pORF9-hP27mt质粒中经AgeⅠ和Nhe Ⅰ酶切后, 回收619 bp的片段的片段, 亚克隆入经XmaⅠ和XbaⅠ酶切的pBluescriptⅡSK(+)中, pBluescript-hP27mt质粒经NotⅠ和KpnⅠ酶切, 回收619 bp的目的基因片段, 插入到经同样酶切的穿梭质粒pShuttle-CMV中, 构建成转移质粒pShuttle-CMV-hP27mt. 用腺病毒骨架质粒pAdeasy-1转化感受态E. coli, 根据pAdeasy-1的氨苄抗性基因挑取含pAdeasy-1的BJ5183菌, 大量扩增后制备含pAdeasy-1的超感受态BJ5183. 含pAdeasy-1的超感受态BJ5183菌经PmeⅠ酶切和碱性磷酸酶去磷酸化后, 转化含Adeasy-1的超感受态BJ5183. 小量抽提转化克隆菌质粒DNA, 根据琼脂糖电泳质粒大小, 选择可疑重组腺病毒质粒DNA, 经PacⅠ酶切鉴定正确后, 大量扩增, 采用脂质体PolyFect介导转染Ad293细胞, 完成人重组腺病毒Ad-hP27mt的制备. 重组腺病毒的扩增、鉴别、及滴度测定同前[3].
1.2.2 X-gal染色: SGC-7901细胞在15 cm培养瓶中生长, 分别感染MOI为20, 40, 50和100的Ad-lacZ, 温孵48h后用5 mL/L的戊二醇固定15 min, PBS液清洗3次, 加入X-gal染色液(20:1), 在37 ℃ 50 mL/L CO2的培养箱中温孵4-24 h. 被染为蓝色的细胞是表达LacZ基因的阳性细胞, 在显微镜下观察并计数阳性细胞比率.
1.2.3 p27mt基因表达的检测: SGC-7901细胞在75 cm培养瓶中培养, 分别感染Ad-p27mt和Ad-LacZ. 在相同条件下温孵48 h后分别用0.5 g/L胰酶消化. 细胞用PBS液冲洗2次. PCR鉴定的引物序列如下: 引物1: 5'-CCTAGAGGGCAAGTACGAGTG-3'; 引物2: 5'-GAAGAATCGTCGGTTGCAGGTCGCT-3'; 引物3: 5'-TCGTTTCTCAGCAGCTGTTG-3'; 引物4: 5'-CATCTGAACTCAAAGCGTGG-3'. 细胞经裂解液裂解后用Western blot检测.
1.2.4 流式细胞仪检测感染Ad-p27mt的细胞: SGC-7901细胞在75 cm培养瓶中培养, 感染Ad-p27mt. 温孵48 h后在0.5 g/L的胰酶中消化. 收集细胞并在PBS液中冲洗两次. 加PBS液调整细胞浓度至109/L. 取出100 μL细胞悬液与DNA-PREPTM LPR 200 μL混合. 检测细胞周期和凋亡. Ad-LacZ组和正常空白组(无腺病毒感染)作为对照组.
1.2.5 DNA片段分析: SGC-7901感染Ad-p27mt和Ad-LacZ 48 h后离心去上清, 在剩余细胞沉淀中加500 μL的细胞裂解液(10 g/L Np40, 20 mmol/L EDTA, 50 mmol/L Tris-HCl(pH 7.5)]和10 μL蛋白酶K. 在56 ℃水浴中加热1-2 h, 用苯酚和氯仿提取, 然后用脱水酒精沉淀DNA. 在700 mL/L酒精洗涤一次后加入200 μL TE. 然后再加入RNA酶(最终浓度为50 mL/L), 37 ℃下过夜. 然后在10 g/L琼脂糖凝胶中电泳, 在紫外灯下观察结果.
1.2.6 TUNEL法检测细胞凋亡: 1×104细胞悬液在60 mm培养皿中温孵, 覆盖盖玻片(清洗并高温消毒). Ad-p27mt组和正常对照组每个均温孵6张玻片, 每张玻片温孵24 h. 然后将玻片取出, 用1×PBS液冲洗2次, 用甲醇: 冰醋酸(3:1)固定30 min. 根据按说明书操作, 每一玻片上计数1000个细胞, 计算平均凋亡细胞数目. 并按每100个癌症细胞多少凋亡细胞来计算凋亡指数.
统计学处理 采用SPSS11.5统计软件分析所有数据, 进行t检验, P<0.05有统计学意义.
收集和溶解有病理反应的多药抗药性SGC-7901细胞及其培养液, 如此反复3次. 然后离心, 得到5 mL的悬浊液, 将其取出, 加入1 mg蛋白酶K, 10 g/L SDS, 10 mmoL/L EDTA和20 mmol/L Tris-HCl溶解. 等待2 h, 加入脱水酒精沉淀, 得到病毒DNA, 然后加入正逆转录引物, 开始进行PCR反应. 最后275 bp的目的基因得到放大, 并显示出重组腺病毒已经被成功导入p27mt基因.
通过X-gal染色来测量腺病毒介导的基因转换率. 结果显示: 只要MOI大于50, 感染效率就能接近100%. 这表明在体外实验中重组腺病毒可以有效的将基因转入SGC-7901细胞.
用重组腺病毒Ad-p27mt (MOI 100)感染SGC-7901细胞, 24 h后, 分析p27蛋白的表达量. 首先搜集细胞, 然后用1×SDS×PAGE细胞溶解液加以溶解. 加热到100 ℃持续5 min, 离心, 取上清. 接着用Western blot测定蛋白. 在TMB染色后, 数据显示在Ad-p27mt组中有大量的27 kDa蛋白表达, 而在Ad-LacZ组和正常对照组中只检测到少量的蛋白表达(图1). 这表明在目前的实验中人类p27突变基因重组腺病毒可以在SGC-7901细胞中正确的表达并生成大量的相关蛋白.
三组SGC-7901细胞分别经过Ad-p27mt, Ad-LacZ和无病毒的处理, 24 h后, Ad-p27mt激发了胃癌细胞的程序性凋亡. 通过流式细胞仪测量, 重复6次. 亚二倍体的平均值分别是: Ad-p27mt组41.0%, Ad-LacZ组4.67%和未感染组1.96%. Ad-p27mt组比较Ad-LacZ组, Ad-p27mt组比较未感染组, P<0.01; Ad-LacZ组比较未感染组, P>0.05. 统计分析表明: 实验数据在Ad-p27mt组和Ad-LacZ组, 未感染组之间存在着显著性差异.
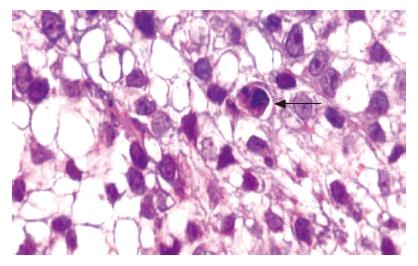
DNA电泳结果显示: 在Ad-LacZ组和正常对照组中基因条带是完整的, 而在Ad-p27mt组中却有明显180-200 bp的双重梯形带. 这跟典型的细胞凋亡变化是吻合的, 通过TUNEL法在Ad-p27mt组和Ad-LacZ组中分析细胞的程序性凋亡. 凋亡细胞的细胞核在显微镜下呈蓝色; 而在正常对照组中, 凋亡细胞的细胞核在显微镜下观测不到(图2).
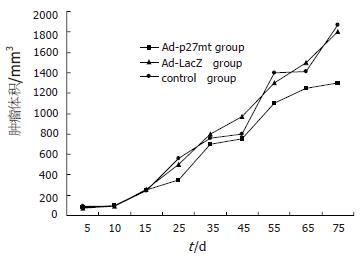
转染Ad-p27mt的重组腺病毒感染人胃癌细胞株SGC-7901细胞, 绘制该细胞株在裸鼠体内的生长曲线, 并与对照组比较, 肿瘤生长曲线显示Ad-P27mt基因治疗组裸鼠体内肿瘤生长第20天后体积与生理盐水、Ad-LacZ对照组比较显著降低, 证实转染人Ad-P27mt基因的重组腺病毒对裸鼠体内人胃癌有显著抑制作用(图3).
染色后的凋亡细胞核呈黑色或者棕黑色, 细胞质浓缩, 细胞皱缩. Ad-P27mt组和对照组的凋亡率分别是92.3%±3.76%和2.01%±0.15%, 两者比较具有显著差异(P<0.01), 且对裸鼠内人胃癌SGC-7901的细胞周期影响有差异(P<0.05).
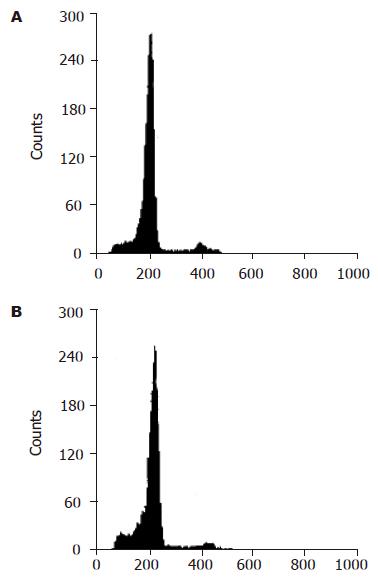
SGC-7901细胞经不同处理后流式细胞仪检测细胞周期结果(表1). Ad-LacZ及空白对照组G1/G0期比例逐渐下降, S期比例上升, 表明G0/G1→S的过程非常迅速, 细胞增殖活跃. 而Ad-P27mt组G1/G0期比例较高, S期比例则下降, 与对照组相比差异有显著性(P<0.05), 细胞发生G1期阻滞, 细胞增殖受到抑制. 流式细胞仪检测的对照组与Ad-P27mt组的凋亡峰见图4.
| 分组 | G0/G1 | S | G2/M |
| 未感染 | 25.29±1.04 | 41.12±1.19 | 33.34±1.55 |
| Ad-lacZ | 27.57±0.45 | 38.21±0.44 | 34.22±0.92 |
| Ad-p27mta | 77.96±2.20 | 8.98±0.17 | 13.06±2.35 |
人突变基因p27表达蛋白是一种热稳定蛋白, 最早由Polyak et al[4]在一项用TGF-β研究细胞接触抑制的实验中发现. 1994年p27基因可以被克隆后, 人们发现p27主要抑制细胞周期因子E-CDK2复合体的活性, 同时也能抑制细胞周期因子D-CDK4和细胞周期因子A-DK2复合体. 另外, p27还能下调细胞周期因子B的表达. 由外源性信号诱导引起p27表达产物堆积导致细胞在G0/G1期停留与肿瘤生成和p27基因的转位, 缺失和突变以及p27的表达水平、蛋白活性相关[5-6]. 如果p27mt的表达水平下调, 对细胞周期因子E-CDK2复合物的抑制作用也会下降, 从而使DNA损伤细胞能从G1期直接进入S期.
p27蛋白的降解主要由受泛醌介导的第187位苏氨酸磷酸化引起的[7-9]. Kudo et al[10]发现如果p27表达受p27蛋白影响的话, 他会明显抑制细胞生长. 并且在p27突变型比在p27野生型的抑制效果更明显. 这种抑制作用是由于CDK的磷酸化位点受阻碍引起的. 构建携带p27mt的复制缺陷型重组腺病毒, 研究胃癌细胞株MNK45的凋亡, 我们希望能发现治疗胃癌的更有效的p27基因[11]. Koguchi et al[12]报道当腺病毒携带的外源性基因p27转染星形胶质细胞后这些细胞的生存能力下降. Zhang et al[13]报道由维甲酸诱导的p27表达上调能显著抑制卵巢肿瘤细胞的生长. Koh et al[4]对来源于子宫颈鳞状肿瘤细胞的SUN-1066, SUN-1041, SUN-1076细胞系进行检测, 将这些细胞转染由重组腺病毒携带的p27kip1后发现, p27的高表达能提高表达这些细胞周期因子D1和细胞周期因子E增高, 同时肿瘤细胞的增殖明显受抑. 在该研究中, 细胞周期分析显示胃癌细胞主要停留在G1-S相. 以上各项研究显示在肿瘤发生发展过程中p27是对肿瘤产生、进展和预后都具有十分重要影响的基因.
目前, 功能性重组抗肿瘤基因是肿瘤基因治疗的有效途径. Sasaki et al[14]发现用腺病毒诱导的p27mt和p27wt转染胆管癌细胞系TFK-1和HuCCT-1, p27mt比p27mt有更强的促进凋亡和诱导细胞增殖作用. Park et al[15-16]用腺病毒将p27mt和p27wt转染肺癌细胞株NCIH460, NCIH1264, NCIH358和NCIH15和胶质细胞系后也获得了相同的结果. 在我们的研究中, p27mt转染胃癌细胞系SGC-7901, 用p27mAb证实该基因的高表达, 结果显示携带重组p27mt的腺病毒能将目标基因导入源自人胃腺癌组织种植于裸鼠并能表达内源性p27的肿瘤细胞内. 利用流式细胞仪, 在Ad-p27mt组中凋亡率上升至41.0%, 与对照组相比较有显著差异. DNA分析显示存在180-200 bp的DNA梯度.
SGC-7901细胞用不同方法处理后检测各组细胞周期. 从表1中可见Ad-LacZ组和空白对照组G0/G1细胞数有所下降, 而S相细胞比率增高, 这一现象说明细胞周期各相的转化时间缩短, 细胞增殖活跃. 然而在Ad-P27mt组中G0/G1相细胞数增多, 细胞周期停顿在G0/G1相, 与空白组和Ad-LacZ对比具有显著差异. TUNEL法显示Ad-P27mt诱导裸鼠体内人胃癌细胞SGC7901的凋亡率达到92.4%, 并且与正常对照组相比具有显著差异. 以上结果说明p27基因与胃癌的发生具有密切相关性. 下调p27表达是细胞增殖失调和凋亡失调的主要原因. 利用p27mt上调p27的表达促进肿瘤细胞的凋亡, 从而形成一种新型的抗胃癌治疗途径. 细胞周期分析显示通过p27mt抑制细胞周期/CDK激酶的活性, 肿瘤细胞分裂中止于G1期. Winteringham et al[17]认为p27的积累在细胞增殖启动中对胃癌细胞周期的中止机制中起着重要作用. 但是其他一些在该过程中起作用的凋亡因子仍需要进一步探讨.
近期研究显示NM-3以及其他一些基因治疗能成功诱导胃癌细胞凋亡[18-19], 但是在裸鼠胃癌模型中由Ad-p27mt导入腺病毒对裸鼠内人胃癌细胞SGC-7901的分子凋亡作用尚未报道, 本研究提示重组腺病毒转染人p27基因具有显著抑制裸鼠体内人胃癌作用, 这一方法的有效性及凋亡机制为其治疗晚期胃癌提供了重要的实验依据.
凋亡在各种恶性肿瘤细胞的发展过程中占有十分重要的地位. 同其他恶性肿瘤一样, 胃癌不仅存在细胞增殖和分化的异常, 同时也存在凋亡的异常. 目前晚期胃癌尚缺乏有效的治疗方法. 因此如何诱导胃癌细胞凋亡是目前的研究重点.
本研究提示重组腺病毒转染人p27基因具有显著抑制裸鼠体内人胃癌细胞SGC-7901的作用. p27的积累对胃癌细胞周期的中止机制起着重要作用, 利用p27mt上调p27的表达促进肿瘤细胞的凋亡, 可能形成一种新型的抗胃癌治疗途径.
电编: 张敏 编辑: 张焕兰
| 1. | Nan KJ, Jing Z, Gong L. Expression and altered subcellular localization of the cyclin-dependent kinase inhibitor P27Kip1 in hepatocellular carcinoma. World J Gastroenterol. 2004;10:1425-1430. [PubMed] |
| 2. | Bryja V, Pachernik J, Faldikova L, Krejci P, Pogue R, Nevriva I, Dvorak P, Hampl A. The role of P27(Kip1) in maintaining the levels of D-type cyclins in vivo. Biochim Biophys Acta. 2004;1691:105-116. [PubMed] |
| 3. | Koh TY, Park SW, Park KH, Lee SG, Seol JG, Lee DW, Lee CT, Heo DS, Kim KH, Sung MW. Inhibitory effect of P27KIP1 gene transfer on head and neck squamous cell carcinoma cell lines. Head Neck. 2003;25:44-49. [PubMed] |
| 4. | Polyak K, Kato JY, Solomon MJ, Sherr CJ, Massague J, Roberts JM, Koff A. P27Kip1, a cyclin-Cdk inhibitor, links transforming growth factor-beta and contact inhibition to cell cycle arrest. Genes Dev. 1994;8:9-22. [PubMed] |
| 5. | Bryja V, Cajanek L, Pachernik J, Hall AC, Horvath V, Dvorak P, Hampl A. Abnormal development of mouse embryoid bodies lacking P27Kip1 cell cycle regulator. Stem Cells. 2005;23:965-974. [PubMed] |
| 6. | Liu E, Li X, Yan F, Zhao Q, Wu X. Cyclin-dependent kinases phosphorylate human Cdt1 and induce its degradation. J Biol Chem. 2004;279:17283-17288. [PubMed] |
| 7. | Takeda A, Osaki M, Adachi K, Honjo S, Ito H. Role of the phosphatidylinositol 3'-kinase-Akt signal pathway in the proliferation of human pancreatic ductal carcinoma cell lines. Pancreas. 2004;28:353-358. [PubMed] |
| 8. | Guo W, Shang F, Liu Q, Urim L, West-Mays J, Taylor A. Differential regulation of components of the ubiquitin-proteasome pathway during lens cell differentiation. Invest Ophthalmol Vis Sci. 2004;45:1194-1201. [PubMed] |
| 9. | Wei W, Ayad NG, Wan Y, Zhang GJ, Kirschner MW, Kaelin WG Jr. Degradation of the SCF component Skp2 in cell-cycle phase G1 by the anaphase-promoting complex. Nature. 2004;428:194-198. [PubMed] |
| 10. | Kudo Y, Kitajima S, Sato S, Ogawa I, Miyauchi M, Takata T. Transfection of P27(Kip1) threonine residue 187 mutant type gene, which is not influenced by ubiquitin-mediated degradation, induces cell cycle arrest in oral squamous cell carcinoma cells. Oncology. 2002;63:398-404. [PubMed] |
| 11. | Hurteau JA, Brutkiewicz SA, Wang Q, Allison BM, Goebl MG, Harrington MA. Overexpression of a stabilized mutant form of the cyclin-dependent kinase inhibitor P27(Kip1) inhibits cell growth. Gynecol Oncol. 2002;86:19-23. [PubMed] |
| 12. | Koguchi K, Nakatsuji Y, Nakayama K, Sakoda S. Modulation of astrocyte proliferation by cyclin-dependent kinase inhibitor P27(Kip1). Glia. 2002;37:93-104. [PubMed] |
| 13. | Zhang D, Holmes WF, Wu S, Soprano DR, Soprano KJ. Retinoids and ovarian cancer. J Cell Physiol. 2000;185:1-20. [PubMed] |
| 14. | Sasaki T, Katayose Y, Suzuki M, Yamamoto K, Shiraso S, Mizuma M, Unno M, Takeuchi H, Lee CT, Matsuno S. Adenovirus expressing mutant P27kip1 enhanced apoptosis against cholangiocarcinoma than adenovirus-P27kip1 wild type. Hepatogastroenterology. 2004;51:68-75. [PubMed] |
| 15. | Park KH, Seol JY, Kim TY, Yoo CG, Kim YW, Han SK, Shim YS, Lee CT. An adenovirus expressing mutant P27 showed more potent antitumor effects than adenovirus-P27 wild type. Cancer Res. 2001;61:6163-6169. [PubMed] |
| 16. | Park KH, Lee J, Yoo CG, Kim YW, Han SK, Shim YS, Kim SK, Wang KC, Cho BK, Lee CT. Application of P27 gene therapy for human malignant glioma potentiated by using mutant P27. J Neurosurg. 2004;Sep; 101:505-510. [PubMed] |
| 17. | Winteringham LN, Kobelke S, Williams JH, Ingley E, Klinken SP. Myeloid Leukemia Factor 1 inhibits erythropoietin-induced differentiation, cell cycle exit and p27Kip1 accumulation. Oncogene. 2004;23:5105-5109. [PubMed] |
| 18. | Kawada M, Yoshimoto Y, Minamiguchi K, Kumagai H, Someno T, Masuda T, Ishizuka M, Ikeda D. A microplate assay for selective measurement of growth of epithelial tumor cells in direct coculture with stromal cells. Anticancer Res. 2004;24:1561-1568. [PubMed] |
| 19. | Zhu JS, Shen B, Chen JL, Chen GQ, Yu XH, Yu HF, Zhu ZM. Molecular action mechanisms of NM-3 on human gastric cancer SGC-7901 cells in vivo or in vitro. World J Gastroenterol. 2003;9:2366-2369. [PubMed] |