修回日期: 2006-09-13
接受日期: 2006-09-20
在线出版日期: 2006-12-28
目的: 研究非酒精性脂肪肝大鼠肝脏SCD-1表达及ATP含量之间的关系.
方法: SD大鼠30只分成正常组、高脂组, 在实验的第8, 16和24周分批处死, 观察肝脏组织学改变, 荧光素酶-荧光素法测定肝脏ATP含量, RT-PCR实时荧光分析大鼠肝SCD-1 mRNA与β-actin mRNA的比值.
结果: 肝组织HE染色显示高脂组大鼠肝脏内有弥漫性肝细胞脂肪变性, 8 wk达到脂肪肝诊断标准. 8 wk表现为单纯性脂肪肝, 16-24 wk进展为脂肪性肝炎. 电镜下发现实验组与对照组相比, 肝细胞线粒体肿胀、增大, 部分内膜嵴粒脱落, 16 wk发现线粒体内有类圆形结晶样物质沉积. 实验组肝SCD-1 mRNA表达下降, 8, 16和24 wk的测定值分别为0.39±0.18 vs 0.83±0.28(P<0.05)、0.44±0.17 vs 0.81±0.30(P<0.05)和0.47±0.23 vs 0.88±0.22 (P<0.01); 每克肝匀浆ATP含量(10-8 μmol/L)减低(2.40±0.54 vs 2.96±0.43, P>0.05, 2.26±0.55 vs 3.00±0.42, P<0.05和1.74±0.45 vs 2.79±0.40, P<0.01). 肝SCD-1 mRNA表达与ATP含量呈正相关(r = 0.46, P<0.05).
结论: 长期高脂饮食引起肝SCD-1的表达下调, 促使脂肪在肝内蓄积形成非酒精性脂肪肝. 同时使肝细胞内饱和游离脂肪酸增加, 线粒体结构和功能受损, 使ATP的合成和储存下降, 加重氧化应激对肝细胞的打击和肝脏的炎症反应.
引文著录: 陆元善, 范建高, 方继伟, 丁晓东, 杨兆瑞. 非酒精性脂肪肝大鼠肝脏硬脂酰CoA去饱和酶-1表达与ATP浓度之间的关系. 世界华人消化杂志 2006; 14(36): 3450-3456
Revised: September 13, 2006
Accepted: September 20, 2006
Published online: December 28, 2006
AIM: To explore the relationship between hepatic stearoyl-CoA desaturase-1 (SCD-1) expression and adenosine triphosphate (ATP) content in nonalcoholic fatty liver caused by fat-rich diet.
METHODS: A total of 30 Sprague Dawley rats were divided into group A and B. The rats in group B were fed with fat-rich diet, consisting of 10% lard oil and 2% cholesterol, while those in group A served as controls. The rats were sacrificed at the 8th, 16th, and 24th week, respectively. The hepatic histological changes were evaluated by microscopy and transmission electron microcopy. The ATP contents of hepatic cell were measured by luminescent-fluorescein method. The ratio of hepatic SCD-1 mRNA to β-actin mRNA was analyzed by real-time fluorescence reverse transcription-polymerase chain reaction (RT-PCR).
RESULTS: The hepatocytes, stained with Haematoxylin & Eosin, in group B were filled with fat under microscope and met the diagnostic standard of fatty liver at the 8th week. Simple fatty liver was observed at the 8th week, and steatohepatitis came into formation from the 16th to 24th week. Marked abnormal morphological changes, including swelling, rounding, loss of cristae, and stacks of intramitochondrial paracrystalline inclusion bodies, were observed in the hepatocytic mitochondrion in group B. SCD-1 expression was lower in group B than that in group A, and the ratio of SCD-1 mRNA to β-actin mRNA was significantly different (8 wk: 0.39 ± 0.18 vs 0.83 ± 0.28, P < 0.05; 16 wk: 0.44 ± 0.17 vs 0.81 ± 0.30, P < 0.05; 24 wk: 0.47 ± 0.23 vs 0.88 ± 0.22, P < 0.01) at the 8th, 16th and 24th week, respectively. The contents of ATP were also significantly different between group B and A (8 wk: 2.40 ± 0.54 vs 2.96 ± 0.43, P > 0.05; 16 wk: 2.26 ± 0.55 vs 3.00 ± 0.42, P < 0.05; 24 wk: 1.74 ± 0.45 vs 2.79 ± 0.40, P < 0.01). There was a positive correlation between SCD-1 expression and hepatic ATP content (r = 0.45, P < 0.05).
CONCLUSION: Fat-rich diet may decrease the expression of hepatic SCD-1 mRNA, which may result in excessive fat deposition and formation of nonalcoholic fatty liver. Meanwhile, it may increase free saturated fatty acid concentration, impair mitochondrial structure and function, and decrease the capability of ATP synthesis and storage.
- Citation: Lu YS, Fan JG, Fang JW, Ding XD, Yang ZR. Relationship between hepatic stearoyl-CoA desaturase-1 expression and adenosine triphosphate content in rats with nonalcoholic fatty liver caused by fat-rich diet. Shijie Huaren Xiaohua Zazhi 2006; 14(36): 3450-3456
- URL: https://www.wjgnet.com/1009-3079/full/v14/i36/3450.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i36.3450
硬脂酰CoA去饱和酶(stearoyl-CoA desaturase, SCD, E.C. 1.14.99.5)是单不饱和脂肪酸(monou-nsaturated fatty acid, MUFA)生物合成的限速酶, 是瘦素作用目的基因之一, 在脂肪酸代谢及能量平衡中起重要的调节作用[1]. MUFA从其前体饱和脂肪酸经NADH依赖的黄素蛋白细胞色素b5还原酶、细胞色素b5和SCD 3种物质组成的酶系催化, 无氧氧化而来. SCD催化硬脂酰和软脂酰CoA形成油酰和棕榈油酰CoA. 生成的油酰和棕榈油酰CoA是细胞内合成三酰甘油、胆固醇酯和膜磷脂MUFA的主要来源[2-4]. 油酸是肝合成三酰甘油和胆固醇酯的必需脂肪酸, 三酰甘油和胆固醇酯是肝内装配和分泌VLDL的重要成份. 非酒精性脂肪肝主要是由于中性脂肪在肝脏中沉积所引起, 而高脂饮食是非酒精性脂肪肝形成的原因之一. 对高脂饮食引起的脂肪肝动物模型的研究发现, 非酒精性脂肪性肝脏病变大鼠血浆游离脂肪酸(free fatty acid, FFA)水平升高[5], FFA增加诱发脂凋亡, 造成肝细胞功能障碍和炎症反应. 同时, 脂肪肝是能量过剩所在肝脏的表现, 对非酒精性脂肪肝患者及动物实验研究发现, 脂肪沉积的肝脏ATP储存能力下降[6-7], 导致肝细胞对氧应激的反应下降, 加重FFA对肝细胞的损伤[8-9]. 本文旨在通过对引起FFA增加的SCD-1和肝ATP含量之间关系的研究, 给临床非酒精性脂肪肝的预防和治疗提供理论指导.
♂SD大鼠, 购自于中科院上海实验动物中心斯莱克公司, 体质量150 g左右(140-160 g). 胆固醇纯品, 上海生化试剂商店. 猪油, 自备. Taq DNA聚合酶、dNTP及逆转录试剂均为Promega产品. 荧光素酶-荧光素、标准ATP粉剂和荧光素酶缓冲液均购自中科院上海植物生理研究所. FG-100型发光光度计、透射电子显微镜、MJ扩增仪、低温离心机和全自动酶标仪.
1.2.1 非酒精性脂肪肝模型的建立: 30只大鼠正常喂养1 wk后, 随机分成2组, 对照组15只, 高脂组15只. 对照组以普通饲料喂养, 高脂组以2%胆固醇、10%猪油和88%标准大鼠饲料构成的高脂饲料喂养. 于实验开始后第8, 16和24周分别处死5只对照组和5只高脂组大鼠. 大鼠以0.1 g/kg体质量氯胺酮予以麻醉, 腹主动脉采血. 称取肝湿质量后, 迅速从肝右叶固定部位切取1块肝组织, 以40 g/L的中性甲醛固定后制备成石蜡切片, 剩余肝组织经标记后投入液氮罐中冷冻保存备用, 并取2 mm3的肝脏组织投入戊二醛中固定, 送电镜检查.
1.2.2 RT-PCR: 从液氮中取出肝组织, 称取0.1 g, 放入Eppendorf管中, 加入1 mL TRIzol, 研磨匀浆. 匀浆中加入0.2 mL氯仿, 剧烈震荡15 s, 室温孵育5 min. 4 ℃, 10 000 g, 离心15 min, 将无色水相移至另一Eppendorf管. 加入0.5 mL异丙醇, 室温孵育15 min, 再4 ℃ 10 000 g离心10 min, 弃上清. 沉淀加入750 mL/L乙醇1 mL, 洗涤沉淀物. 4 ℃ 7500 r/min离心5 min, 弃上清. 沉淀用20 μL DEPC水溶解. 取1 μL溶解好的RNA溶液, DEPC水稀释至100 μL, 微量分光光度计检测RNA纯度和浓度.
按产品说明书操作. 取总RNA 2 μg, 加入随机引物2 μL, 用无RNA酶去离子水添至总体积12 μL, 70 ℃, 5 min. 取出立即置冰中, 快速冷却. 然后加入10 mmol/L dNTP 0.8 μL, 10×缓冲液2 μL, 25 mmol/L MgCl2 3 μL, RNA酶抑制剂0.7 μL和逆转录酶0.5 μL, 37 ℃, 20 min, 42 ℃, 30 min, 最后95 ℃, 3 min, 4 ℃, 5 min. 产物cDNA -80 ℃保存备用.
取10×缓冲液2.5 μL, 25 mmol/L MgCl2 3 μL, 10 mmol/L dNTP 0.8 μL, cDNA 2 μL, 25 μmol/L引物各0.5 μL, Taq DNA聚合酶1 U, 20×SYBR greenⅠ1.25 μL, 去离子水加至25 μL. 按95 ℃, 3 min变性, 然后95 ℃, 20 s, 56 ℃, 30 s和72 ℃, 30 s, 40个循环. β-actin的引物为: 5'-AACCCTAAGGCCAACCGTGAAAAG-3'和5'-TCATGAGTAGTCTGTCAGGT-3'; SCD-1的引物为: 5'-TGCTGATGTGCTTCATCCTG-3'和5'-GGGAAACCAGGATATTCTCC-3'.
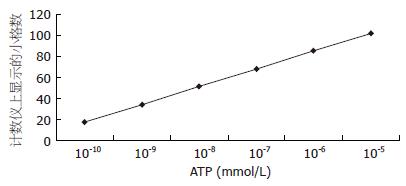
1.2.3 ATP测定: 所有试剂均用重蒸馏水配制. 测定时, 模型組和对照组各个时期均取5个标本, 共30个标本. 腺苷酸提取液(Tris·HCl 20 mmol/L, MgSO4 2 mmol/L). 荧光素酶缓冲液: 每支粉剂用50 mL重蒸水溶解, 内含 50 mmol/L甘氨酰甘氨酸(pH 7.6)、10 mmol/L MgSO4、1 mmol/L EDTA缓冲液. 将ATP配成1×10-10-5×10-5 mmol/L的6管应用液进行测定, 以相对荧光强度的log值与ATP浓度的log值绘制标准曲线(图1). 将从液氮罐中冷冻的肝脏组织0.15-0.35 g加入1 mL腺苷酸提取液中, 电动匀浆, 再放入沸水中加热3 min, 消耗并灭活肝脏组织中的ATP酶, 然后以4000 r/min离心3 min, 取上清液0.4 mL待检测. 取代检液0.1 mL加入0.1 mL重蒸水稀释, 将混合液吸入2 mL的比色杯中, 然后从FG-200型发光光度计的暗室盖的小孔中快速注入0.8 mL荧光素酶缓冲液, 记录发光曲线的初始峰值, 该峰值即为标准或检测样品的荧光强度, 测定温度为25 ℃, 测定电压0.5 mV, 查标准曲线求得检测标本的ATP含量.
统计学处理 8, 16及24 wk的对照组与高脂组对应指标用t检验, SCD-1 mRNA水平与ATP含量之间的相关性统计用非参数的Spearman相关分析, 统计软件为SPSS 9.0.
实验过程中未发生大鼠死亡, 两组大鼠体质量均呈进行性增长. 8, 16及24 wk高脂组大鼠的体质量、肝脏湿质量和腹腔内脂肪均显著高于对照组(表1).
| 分组 | 体质量(g) | 肝湿质量(g) | 脂肪质量(g) | SCD-1/β-actin比值 | ATP(×10-8 μmol/L) |
| N 8 wk | 372.00±12.55 | 11.46±0.82 | 12.78±0.71 | 0.83±0.28 | 2.96±0.43 |
| H 8 wk | 421.00±29.66b | 15.22±2.41a | 13.90±0.77a | 0.39±0.18a | 2.40±0.54 |
| N 16 wk | 490.00±50.50 | 13.50±0.61 | 14.02±2.10 | 0.81±0.30 | 3.00±0.42 |
| H 16 wk | 550.00±35.07a | 16.16±1.47b | 19.20±3.56a | 0.44±0.17a | 2.26±0.55a |
| N 24 wk | 496.44±22.05 | 12.66±1.34 | 14.28±3.46 | 0.88±0.22 | 2.79±0.40 |
| H 24 wk | 563.90±32.89a | 17.98±1.95b | 19.52±1.02b | 0.47±0.23b | 1.74±0.45b |
肝脏大体观察, 对照组大鼠肝脏形态、质地、颜色均正常; 高脂组大鼠的肝脏体积增大, 外形饱满圆钝, 色泽灰黄, 切面油腻, 质地较脆. 光镜下, 肝组织HE染色显示高脂组大鼠肝脏内有弥漫性肝细胞脂肪变, 8 wk达到脂肪肝诊断标准. 16 wk时, 大鼠肝脏内往往数个坏死灶融合成片, 汇管区炎症较严重. 24 wk高脂组呈中重度脂肪肝, 肝脏炎症程度较重.
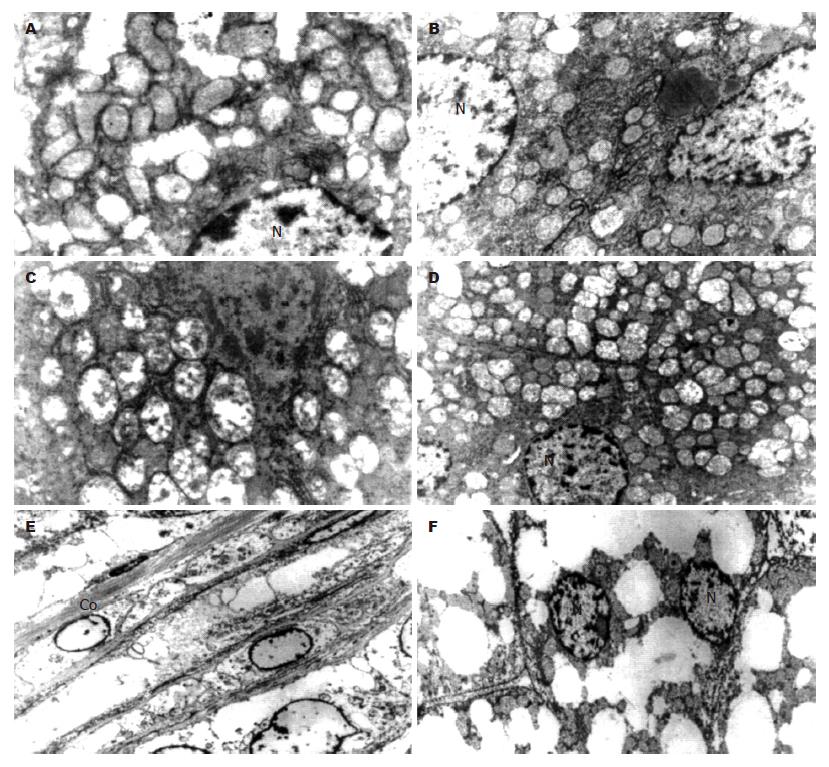
扫描电镜下, 模型组肝脏中看到其内充满大量脂滴, 肝细胞内线粒体结构异常, 表现为线粒体增大、肿胀、内嵴粒脱落、减少, 而且随着造模时间延长, 线粒体损害加重, 部分线粒体内可以看到类圆形高密度结晶样物质沉积(图2A-D). 在24 wk电镜下肝脏内发现胶原纤维沉积(图2E), 肝细胞核被胞质内积聚的大脂滴推挤, 从肝细胞中央区被推到细胞的周边(图2F).
SCD-1和β-actin的扩增产物分别为201 bp和241 bp. 实验组大鼠的肝脏SCD-1 mRNA水平及ATP含量均较同期的对照组低(表1).
SCD-1 mRNA水平与每克肝匀浆ATP含量之间的Spearman相关系数为0.46(P<0.05). 随着喂养时间的延长, 大鼠肝脏SCD-1的表达与ATP含量表现为同步下降, 两者之间呈正相关(表1).
最近的研究表明, SCD是脂质代谢和体质量调节的关键控制点. 在ob/ob小鼠中, SCD-1功能缺乏可通过增加AMP激活的蛋白激酶(AMP-activated protein kinase, AMPK)的磷酸化和肉毒碱棕榈酰转移酶(carnitine palmitoyltransferase Ⅰ, CPTⅠ)mRNA水平和活性, 提高β-氧化的速率. 同时, 降低丝氨酸棕榈酰转移酶(serine palmitoyltransferase, SPT)的mRNA水平及活性, 降低神经酰胺的合成, 发挥抗脂毒性作用[10]. 对SCD-1-/-小鼠的研究发现, AMPK的激活可能是SCD-1缺乏小鼠能量消耗增加的原因[11-12], 尽管脂毒性与细胞内三酰甘油的含量相关, 但脂质诱导的组织损伤可能并不是由三酰甘油引起[13-15], 而是非氧化的棕榈酰CoA的衍生物--神经酰胺的可能性最大[15-16]. 神经酰胺在细胞的休止、分化和凋亡中起作用[17-19]. 在不同的胰岛素抵抗啮齿类动物模型中, 神经酰胺诱导抑制Akt的活性[20-22]; 在脂毒性中发挥重要作用. 神经酰胺与发生在Zucker糖尿病大鼠及过度表达酰基-CoA合成酶的心梗转基因小鼠的胰岛β-细胞[23]和心脏[24]等非瘦素化组织的脂毒性有关[25], 内源性产生的神经酰胺是软脂酸诱导的胰岛素抵抗[26]和凋亡所必需的[23]. 在正常SD大鼠肝脏中表现如何? 本研究希望通过对高脂饮食喂养的SD大鼠肝脏组织学改变、SCD-1表达和ATP含量检测, 研究SCD-1与肝脏能量代谢之间的关系.
我们发现, 高脂饮食喂养可成功的塑造非酒精性脂肪肝模型. 大鼠体质量增加、腹腔内脂肪增多, 肝脏明显增大, 肝细胞内有脂肪颗粒沉积, 肝细胞的超微结构特别是线粒体受到不同程度的损坏[27]. 同时发现, 经一段时间喂养高脂饮食大鼠肝SCD-1 mRNA水平下降, SCD-1 mRNA水平下降可能与高脂喂养引起的内源性高瘦素血症有关[1,28], 瘦素是由脂肪细胞分泌的抑制进食、刺激能量消耗、维持体质量防止脂毒性对非脂肪组织损伤的激素[29-32]. Cohen et al[1]最近研究显示, SCD-1基因是瘦素信号的靶基因, 瘦素通过转录因子SREBP[33]或神经肽(neuropeptide Y, NPY)[34-35]发生作用, 抑制SCD-1基因的表达. 本研究发现, 高脂饮食喂养SD大鼠肝脏SCD-1的表达下调在8 wk就表现出显著性差异, 而肝脏ATP含量及电镜下线粒体结构的改变在16 wk有显著差异, 可能与SCD-1的表达下调引起细胞内棕榈酰CoA水平升高, 神经酰胺的合成增加有关. 对中国昌鼠卵巢细胞的研究发现, SCD的主要产物油酸在细胞内神经酰胺的合成起重要的调节作用[13]. 细胞内神经酰胺的水平升高通常发生在线粒体凋亡阶段之前[36-37]. 线粒体是神经酰胺介导的凋亡的靶器官, 在细胞凋亡中起主要的调节作用[38-39]. 神经酰胺的合成位于胞质内的内质网表面[40-41], 可通过内质网膜与线粒体膜的近距离接触直接由内质网输入[42-43], 或由线粒体合成[44-45]. 对线粒体的亚结构成份的研究发现, 其内、外膜均具有合成神经酰胺的能力[46]. 神经酰胺形成在线粒体结构上的分布决定了其功能上的差异[19], 线粒体内膜生成神经酰胺的能力和神经酰胺作为膜的固有成份[47], 线粒体内膜的神经酰胺可通过抑制呼吸链的复合物Ⅰ[48]和Ⅲ[49], 或增加过氧化氢的生成[50], 直接与线粒体的电子传递链相互作用, 降低ATP的合成和能量储存.
通过在大鼠普通饲料中添加脂肪, 经一段时间喂养后可成功的塑造非酒精性脂肪肝模型. 高脂饮食使大鼠肝脏SCD-1 mRNA水平下降, 使脂肪在肝内蓄积形成非酒精性脂肪肝. 同时, SCD-1 mRNA水平下降, 游离脂肪酸增加, 对线粒体产生脂毒性, 引起线粒体结构和功能损伤, ATP生成减少, 加重了氧化应激对肝细胞的损伤. SCD-1在高脂饮食引起的非酒精性脂肪肝的形成和治疗中起中枢调节作用, 有望成为临床非酒精性脂肪肝的预防和药物开发的一个较为合适的监测指标.
对高脂饮食引起的脂肪肝动物模型的研究发现, 非酒精性脂肪性肝脏病变大鼠血浆游离脂肪酸水平升高, 造成肝细胞功能障碍和炎症反应. 同时, 脂肪沉积的肝脏ATP储存能力下降, 导致肝细胞对氧应激的反应下降, 加重游离脂肪酸对肝细胞的损伤. 硬脂酰CoA去饱和酶-1(SCD1)是肝脏VLDL合成的限速酶, 影响肝脏内脂肪的排出并与游离脂肪酸的增加有关. 研究SCD-1和肝ATP含量之间的关系将给临床非酒精性脂肪肝的预防和治疗提供理论指导.
本文通过对非酒精性脂肪肝大鼠肝脏SCD-1表达与ATP含量之间关系的研究, 为临床非酒精性脂肪肝的预防和治疗提供理论指导. 实验设计合理, 结论可靠, 具有较高的理论水平和临床实用价值.
电编: 张敏 编辑: 张焕兰
| 1. | Cohen P, Miyazaki M, Socci ND, Hagge-Greenberg A, Liedtke W, Soukas AA, Sharma R, Hudgins LC, Ntambi JM, Friedman JM. Role for stearoyl-CoA desaturase-1 in leptin-mediated weight loss. Science. 2002;297:240-243. [PubMed] |
| 2. | Heinemann FS, Ozols J. Stearoyl-CoA desaturase, a short-lived protein of endoplasmic reticulum with multiple control mechanisms. Prostaglandins Leukot Essent Fatty Acids. 2003;68:123-133. [PubMed] |
| 3. | Miyazaki M, Ntambi JM. Role of stearoyl-coenzyme A desaturase in lipid metabolism. Prostaglandins Leukot Essent Fatty Acids. 2003;68:113-121. [PubMed] |
| 4. | Gibbons GF, Wiggins D, Brown AM, Hebbachi AM. Synthesis and function of hepatic very-low-density lipoprotein. Biochem Soc Trans. 2004;32:59-64. [PubMed] |
| 5. | Donnelly KL, Smith CI, Schwarzenberg SJ, Jessurun J, Boldt MD, Parks EJ. Sources of fatty acids stored in liver and secreted via lipoproteins in patients with nonalcoholic fatty liver disease. J Clin Invest. 2005;115:1343-1351. [PubMed] |
| 7. | 丁 晓东, 范 建高, 徐 正婕, 郑 晓英, 田 丽艳, 王 国良. 高脂饮食性脂肪性肝炎大鼠肝脏线粒体损伤和ATP储备改变. 世界华人消化杂志. 2005;13:1524-1528. [DOI] |
| 10. | Dobrzyn A, Dobrzyn P, Lee SH, Miyazaki M, Cohen P, Asilmaz E, Hardie DG, Friedman JM, Ntambi JM. Stearoyl-CoA desaturase-1 deficiency reduces ceramide synthesis by downregulating serine palmitoyltransferase and increasing beta-oxidation in skeletal muscle. Am J Physiol Endocrinol Metab. 2005;288:E599-607. [PubMed] |
| 11. | Dobrzyn P, Dobrzyn A, Miyazaki M, Cohen P, Asilmaz E, Hardie DG, Friedman JM, Ntambi JM. Stearoyl-CoA desaturase 1 deficiency increases fatty acid oxidation by activating AMP-activated protein kinase in liver. Proc Natl Acad Sci USA. 2004;101:6409-6414. [PubMed] |
| 12. | Kerner J, Hoppel C. Fatty acid import into mitochondria. Biochim Biophys Acta. 2000;1486:1-17. [PubMed] |
| 13. | Listenberger LL, Han X, Lewis SE, Cases S, Farese RV Jr, Ory DS, Schaffer JE. Triglyceride accumulation protects against fatty acid-induced lipotoxicity. Proc Natl Acad Sci USA. 2003;100:3077-3082. [PubMed] |
| 14. | Tomas E, Tsao TS, Saha AK, Murrey HE, Zhang Cc C, Itani SI, Lodish HF, Ruderman NB. Enhanced muscle fat oxidation and glucose transport by ACRP30 globular domain: acetyl-CoA carboxylase inhibition and AMP-activated protein kinase activation. Proc Natl Acad Sci USA. 2002;99:16309-16313. [PubMed] |
| 15. | Unger RH. Lipid overload and overflow: metabolic trauma and the metabolic syndrome. Trends Endocrinol Metab. 2003;14:398-403. [PubMed] |
| 16. | Unger RH. Lipotoxic diseases. Annu Rev Med. 2002;53:319-336. [PubMed] |
| 17. | Hannun YA, Luberto C. Ceramide in the eukaryotic stress response. Trends Cell Biol. 2000;10:73-80. [PubMed] |
| 18. | Mathias S, Pena LA, Kolesnick RN. Signal transduction of stress via ceramide. Biochem J. 1998;335:465-480. [PubMed] |
| 19. | van Blitterswijk WJ, van der Luit AH, Veldman RJ, Verheij M, Borst J. Ceramide: second messenger or modulator of membrane structure and dynamics? Biochem J. 2003;369:199-211. [PubMed] |
| 20. | Turinsky J, O'Sullivan DM, Bayly BP. 1, 2-Diacylglycerol and ceramide levels in insulin-resistant tissues of the rat in vivo. J Biol Chem. 1990;265:16880-16885. [PubMed] |
| 21. | Summers SA, Garza LA, Zhou H, Birnbaum MJ. Regulation of insulin-stimulated glucose transporter GLUT4 translocation and Akt kinase activity by ceramide. Mol Cell Biol. 1998;18:5457-5464. [PubMed] |
| 22. | Kim JK, Fillmore JJ, Chen Y, Yu C, Moore IK, Pypaert M, Lutz EP, Kako Y, Velez-Carrasco W, Goldberg IJ. Tissue-specific overexpression of lipoprotein lipase causes tissue-specific insulin resistance. Proc Natl Acad Sci USA. 2001;98:7522-7527. [PubMed] |
| 23. | Shimabukuro M, Higa M, Zhou YT, Wang MY, Newgard CB, Unger RH. Lipoapoptosis in beta-cells of obese prediabetic fa/fa rats. Role of serine palmitoyltransferase overexpression. J Biol Chem. 1998;273:32487-32490. [PubMed] |
| 24. | Zhou YT, Grayburn P, Karim A, Shimabukuro M, Higa M, Baetens D, Orci L, Unger RH. Lipotoxic heart disease in obese rats: implications for human obesity. Proc Natl Acad Sci USA. 2000;97:1784-1789. [PubMed] |
| 25. | Chiu HC, Kovacs A, Ford DA, Hsu FF, Garcia R, Herrero P, Saffitz JE, Schaffer JE. A novel mouse model of lipotoxic cardiomyopathy. J Clin Invest. 2001;107:813-822. [PubMed] |
| 26. | Chavez JA, Knotts TA, Wang LP, Li G, Dobrowsky RT, Florant GL, Summers SA. A role for ceramide, but not diacylglycerol, in the antagonism of insulin signal transduction by saturated fatty acids. J Biol Chem. 2003;278:10297-10303. [PubMed] |
| 27. | Fan JG, Zhong L, Xu ZJ, Tia LY, Ding XD, Li MS, Wang GL. Effects of low-calorie diet on steatohepatitis in rats with obesity and hyperlipide-mia. World J Gastroenterol. 2003;9:2045-2049. [PubMed] |
| 28. | 陆 元善, 范 建高, 方 继伟, 丁 晓东, 杨 兆瑞. 瘦素及硬脂酰CoA去饱和酶-1在高脂饮食大鼠非酒精性脂肪肝发病中的作用. 世界华人消化杂志. 2005;13:2327-2331. [DOI] |
| 30. | Cohen P, Friedman JM. Leptin and the control of metabolism: role for stearoyl-CoA desaturase-1 (SCD-1). J Nutr. 2004;134:2455S-2463S. [PubMed] |
| 31. | Larsson H, Elmstahl S, Berglund G, Ahren B. Evidence for leptin regulation of food intake in humans. J Clin Endocrinol Metab. 1998;83:4382-4385. [PubMed] |
| 32. | Harris RB, Mitchell TD, Hebert S. Leptin-induced changes in body composition in high fat-fed mice. Exp Biol Med (Maywood). 2003;228:24-32. [PubMed] |
| 33. | Kakuma T, Lee Y, Unger RH. Effects of leptin, troglitazone, and dietary fat on stearoyl CoA desaturase. Biochem Biophys Res Commun. 2002;297:1259-1263. [PubMed] |
| 34. | Asilmaz E, Cohen P, Miyazaki M, Dobrzyn P, Ueki K, Fayzikhodjaeva G, Soukas AA, Kahn CR, Ntambi JM, Socci ND. Site and mechanism of leptin action in a rodent form of congenital lipodystrophy. J Clin Invest. 2004;113:414-424. [PubMed] |
| 35. | Wang H, Storlien LH, Huang XF. Effects of dietary fat types on body fatness, leptin, and ARC leptin receptor, NPY, and AgRP mRNA expression. Am J Physiol Endocrinol Metab. 2002;282:E1352-1359. [PubMed] |
| 36. | Perry DK, Carton J, Shah AK, Meredith F, Uhlinger DJ, Hannun YA. Serine palmitoyltransferase regulates de novo ceramide generation during etoposide-induced apoptosis. J Biol Chem. 2000;275:9078-9084. [PubMed] |
| 37. | Charles AG, Han TY, Liu YY, Hansen N, Giuliano AE, Cabot MC. Taxol-induced ceramide generation and apoptosis in human breast cancer cells. Cancer Chemother Pharmacol. 2001;47:444-450. [PubMed] |
| 38. | Crompton M. The mitochondrial permeability transition pore and its role in cell death. Biochem J. 1999;341:233-249. [PubMed] |
| 39. | Susin SA, Zamzami N, Kroemer G. Mitochondria as regulators of apoptosis: doubt no more. Biochim Biophys Acta. 1998;1366:151-165. [PubMed] |
| 40. | Merrill AH Jr. De novo sphingolipid biosynthesis: a necessary, but dangerous, pathway. J Biol Chem. 2002;277:25843-25846. [PubMed] |
| 41. | Mandon EC, Ehses I, Rother J, van Echten G, Sandhoff K. Subcellular localization and membrane topology of serine palmitoyltransferase, 3-dehydrosphinganine reductase, and sphinganine N-acyltransferase in mouse liver. J Biol Chem. 1992;267:11144-11148. [PubMed] |
| 42. | Ardail D, Gasnier F, Lerme F, Simonot C, Louisot P, Gateau-Roesch O. Involvement of mitochondrial contact sites in the subcellular compartmentalization of phospholipid biosynthetic enzymes. J Biol Chem. 1993;268:25985-25992. [PubMed] |
| 43. | Marsh BJ, Mastronarde DN, Buttle KF, Howell KE, McIntosh JR. Organellar relationships in the Golgi region of the pancreatic beta cell line, HIT-T15, visualized by high resolution electron tomography. Proc Natl Acad Sci USA. 2001;98:2399-2406. [PubMed] |
| 44. | Shimeno H, Soeda S, Sakamoto M, Kouchi T, Kowakame T, Kihara T. Partial purification and characterization of sphingosine N-acyltransferase (ceramide synthase) from bovine liver mitochon-drion-rich fraction. Lipids. 1998;33:601-605. [PubMed] |
| 45. | El Bawab S, Roddy P, Qian T, Bielawska A, Lemasters JJ, Hannun YA. Molecular cloning and characterization of a human mitochondrial ceramidase. J Biol Chem. 2000;275:21508-21513. [PubMed] |
| 46. | Bionda C, Portoukalian J, Schmitt D, Rodriguez-Lafrasse C, Ardail D. Subcellular compartmentaliza-tion of ceramide metabolism: MAM (mitochondria-associated membrane) and/or mitochondria? Biochem J. 2004;382:527-533. [PubMed] |
| 47. | Ardail D, Popa I, Alcantara K, Pons A, Zanetta JP, Louisot P, Thomas L, Portoukalian J. Occurrence of ceramides and neutral glycolipids with unusual long-chain base composition in purified rat liver mitochondria. FEBS Lett. 2001;488:160-164. [PubMed] |
| 48. | Di Paola M, Cocco T, Lorusso M. Ceramide interaction with the respiratory chain of heart mitochondria. Biochemistry. 2000;39:6660-6668. [PubMed] |
| 49. | Gudz TI, Tserng KY, Hoppel CL. Direct inhibition of mitochondrial respiratory chain complex III by cell-permeable ceramide. J Biol Chem. 1997;272:24154-24158. [PubMed] |
| 50. | Garcia-Ruiz C, Colell A, Mari M, Morales A, Fernandez-Checa JC. Direct effect of ceramide on the mitochondrial electron transport chain leads to generation of reactive oxygen species. Role of mitochondrial glutathione. J Biol Chem. 1997;272:11369-11377. [PubMed] |