凋亡是导致细胞死亡的调节性生理过程. Fas在各种疾病和细胞凋亡的发生中起到首要作用. Caspase为半胱氨酸蛋白酶家族, 是凋亡的中心调节者, 一旦Caspase-8, 10被激活, 引起Caspase的断裂及激活下游的Caspase-3, 6, 7, 作用于Bcl-2家族某些成员如Bad、一些骨架蛋白和RB蛋白等并使其断裂, 从而导致细胞凋亡. 本文重点讨论了Caspase-3, -8的激活机制及其在Fas诱导细胞凋亡中的作用.
关键词: Caspase家族; Fas; 细胞凋亡
引文著录: 王玉, 孙黎光, 夏春辉. Caspase介导的Fas凋亡途径. 世界华人消化杂志 2006; 14(36): 3439-3442
Caspase-mediated Fas apoptotic pathway
Yu Wang, Li-Guang Sun, Chun-Hui Xia
Yu Wang, Li-Guang Sun, Department of Biochemistry and Molecular Biology, China Medical University, Shenyang 110001, Liaoning Province, China
Yu Wang, Chun-Hui Xia, Qiqihar Medical College, Qiqihar 161042, Heilongjiang Province, China
Supported by: the Plan for the Core Teacher′s Innovation Abilities of Common Colleges and Universities in Heilongjiang Province, No. 1054G070, No. 1055G066, and the Scientific Research Foundation from Education Department of Heilongjiang Province, No. 10511129.
Correspondence to: Li-Guang Sun, Department of Biochemistry and Molecular Biology, China Medical University, Shenyang 110001, Liaoning Province, China. ydslg@163.com
Received: July 28, 2006
Revised: October 12, 2006
Accepted: October 18, 2006
Published online: December 28, 2006
0 引言
细胞凋亡现象是20世纪末生命科学的一个重大发现, 他为人类理解生存和死亡这对矛盾在生命中如何统一起来提供了一个崭新的思路, 加深了人类对生命现象的认识. 已有研究表明, 在各种疾病如癌症、自身免疫、不规则的神经变性[1-2]和生理细胞死亡中, 细胞凋亡起到重要作用如Nagata et al[3]研究中发现, 并且许多因子都卷入死亡信号中. 细胞凋亡又叫细胞程序性死亡, 一般被分为四个阶段: 第一阶段是细胞凋亡的刺激信号, 包括能引起细胞凋亡的物理刺激(如各种射线的照射)、化学刺激(如一些化学药物和血清因子的缺失)、生理性刺激(如细胞环境的改变等); 第二阶段是信号感应和传递, 这一阶段信号可以通过多种途径传递到下一步--中心调控和凋亡发生的效应阶段; 第三阶段是中心控制和效应阶段, 是各种凋亡信号汇集之处, 对信号进行处理并启动细胞凋亡的"发动机"ICE酶类-Caspase(半胱氨酸蛋白酶家族); 第四阶段是细胞死亡阶段, 在这个阶段细胞结构发生变化: 细胞质和染色体浓缩, DNA断裂成200 bp左右的片段, 凋亡小体形成并被临近细胞吞噬. 在细胞凋亡的中心控制和效应阶段, 最重要的事件是发生Caspase的活化. Caspase的活化直接或间接引起细胞凋亡结构特征的出现.
1 Fas
细胞表面有多种受体参与细胞凋亡信号的转导, 其中Fas受体尤为重要. Fas受体是跨膜蛋白, 属于肿瘤坏死因子/神经生长因子受体家族, 死亡信号是由Fas配体、Fas抗体或他们的胞外部分脱落蛋白(可溶性)刺激产生的. 在正常的鼠和人的肝中, 添加anti-Fas的抗体可导致的鼠或人的肝细胞凋亡[4]. 对于表达Fas的肿瘤细胞, 采用抗Fas抗体可迅速选择性引起细胞凋亡, 不仅对于组织细胞的限制或肿瘤细胞的增殖, 而且对于免疫反应的下游调节来说, Fas/FasL系统是生理性关键. Fas/FasL的反常调节导致各种各样的严重临床紊乱, 如Fas/FasL机能失常可以偶联于淋巴组织增生的和多形核中性粒细胞(PMN)-介导的紊乱[5]. 还有一些证据显示Fas在肝病如肝损伤、肝炎、肝硬化和肝癌等的发病机制上起到一个重要的调节作用.
2 Caspase
对于Fas诱导细胞凋亡的分子机制已经进行了较深入的研究, 其中蛋白激酶以Caspase执行细胞有秩序的死亡而闻名[6]. Caspase是指(ICE)/CED-3半胱氨酸蛋白酶家族, 目前有14个基因被证实属于Caspase家族, 包括Caspase-1-14, 其中人类有11种: Caspase-1-10, 13, 而Caspase-11, 12具有种属特异性, 仅存在于鼠中, Caspase-14是最近在鼠中被发现的. 在哺乳动物细胞, Caspase以依赖线粒体和非依赖线粒体两条途径促进细胞凋亡[7-8].
非依赖线粒体途径: 通过膜的死亡受体作用, Caspase可以被细胞外部因子如FasL或Fas抗体激活, 激活的Caspase-8激活下游的Caspase, 从而引起细胞凋亡; 内质网通路: 内质网参与维持细胞内钙离子内环境稳定、膜蛋白的合成、修饰和折叠, 内质网在凋亡信号处理过程中有重要作用[9]. Caspase-12存在于内质网, 当内质网钙离子动态平衡破坏或过多蛋白积聚于内质网时, 可直接激活Caspase-12. 另外, 胞质的Caspase-7可转移到内质网表面, 进一步激活Caspase-12, 激活的Caspase-12可进一步剪切Caspase-3, 而引发细胞凋亡, 此过程由内质网失常引起, 与以膜或线粒体为靶位点的凋亡信号触发无关.
依赖线粒体途径: Caspase也可以被细胞的内在信号激活, 可以导致细胞色素C和线粒体蛋白Smac/Diablo从线粒体释放, 细胞色素C和线粒体蛋白Smac/Diablo的释放能明显的促进Caspases的活性, 并且增加了依赖Caspase的DNA的断裂[10]. 在死亡受体介导的凋亡途径中, Caspase-8除了直接激活Caspase-3外, 还可直接切割胞质的Bcl-2家族成员Bid前体, 形成截断的Bid (truncated Bid, tBid), 激活的tBid转位到线粒体, 触发bak和bax同源寡聚作用, 启动细胞色素C的释放, 因此Bid将凋亡信号从死亡受体途径传递到线粒体途径, 把死亡受体通路和线粒体通路联系起来, 有效的放大了凋亡信号[11]. 而Bcl-2蛋白对caspse-3有拮抗作用[29-30]. 线粒体通路和内质网通路也有密切的联系. 许多情况下, 内质网钙离子释放是线粒体释放细胞色素C的一个早期事件, 即依赖内质网的线粒体内钙离子改变是重要的促进细胞色素C释放的信号[12].
3 Caspase与Fas/FasL
通过收缩抗体引起的FasR刺激导致DISC的形成(death inducing signaling complex)(FADD和Caspase-8被叫作DISC)、DISC添补、激活Caspase-8, 一旦其激活, Caspase-8促进Caspase-3的活性, 以非依赖线粒体或独立的模式进行[7-8]. 一些报道显示, Caspase-8在凋亡中起到一个非常重要的作用, Caspase-3是其重要的靶子如Dasmahapatra et al[13]研究发现, Caspase-8激活Caspase-3并使其水解和激活聚合酶, 诱导细胞死亡[13-15]. 在CPP32亚家族中, 对于凋亡细胞的死亡来说, Caspase-3由于其易变的底物的特殊性而尤其重要. 在刺囊酸(EA)诱导HepG2凋亡实验中Caspase起到中枢作用如Tong et al[16]研究证实的, Caspase-3被划分为Caspase的执行者, Caspase-8, 9被划分为Caspase的启动者, 并且EA引起的Caspase-8, 9, 3的激活呈时间依赖性, 可以靶向细胞程序性死亡必需的某些基因, 或者激活的Caspase-3转位到核与Rb或Rb-E2F复合体作用执行凋亡.
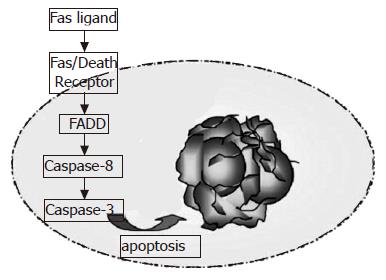
Fas诱导的细胞凋亡, 是由于膜FasL、抗Fas-特殊的抗体和块状可溶的FasL的刺激引起的[31], 重组Fas复合体形成Fas超分子团, 引起随后细胞质内的含调节蛋白的死亡区(FADD)结合到Fas, 然后联合体Fas-FADD恢复FADD-样的白细胞介素-1转换酶, 其含有与Caspase家族蛋白酶相关的蛋白酶区. 这个复合体可以诱导蛋白酶区的自身激活, 其反过来恢复Caspase-8 [17]. Caspase-8是通过二聚化作用而激活的[18], DISC联合高效的激活的影响因子Caspases, 尤其是Caspase-3, 导致凋亡最终步骤的执行(图1)[4]. 激活的Caspase断裂他们的死亡底物, 如核纤层蛋白(lamin), 肌动蛋白(actin), 多聚核糖体[poly(ADP-ribose)]聚合酶, DNA-依赖蛋白激酶, 并引起在细胞或核中可以被观察到的凋亡形态变化如DNA梯状降解等. 一个生理性信号通过内源FADD蛋白也可以激活这个途径[19]. 前列腺和乳腺上皮细胞的行为相似与成纤维细胞, 不可能激活这个途径, 细胞对于死亡抵抗的发生影响着其他的凋亡途径, 显示这是被FADD蛋白诱导的, 并且通过FADD蛋白的不同部分与Caspase-8相互作用, 或者激活Caspase-8, 这使我们认识到凋亡和自溶是被诱导的. FADD的死亡区可以激活细胞的死亡途径, 涉及到凋亡和自溶, 并且在正常细胞无限增殖时, 凋亡和自溶是选择性失活[19]. 同样的刺激可被TRAIL(肿瘤坏死因子相关的诱导凋亡的配体)受体刺激激活或被FADD突变阻碍, 显示这个途径可被表达的外源FADD容易激活. 在TRAIL的临床模型中, FADD几乎对正常组织无毒性, 但可以杀死肿瘤细胞[20-21]. TRAIL通过联合两个受体诱导凋亡, 这两个受体维持一个细胞的死亡区(FADD), 结合的配体被认为是导致这种变化的形成的因素, 对于FADD调节蛋白来说其暴露了结合表面[22], FADD也与Caspase-8结合, 导致Caspase-8二聚体和激活, 甚至导致Caspase激活, 引起依赖Caspase的凋亡, 也可以被Caspase抑制者阻碍, 但如果缺少FADD, 则不能与Caspase-8结合[23].
一些药物诱导或Fas诱导的凋亡同时伴有RB断裂事件, 显示断裂事件由ICE样蛋白酶催化的, 虽然对断裂的认识没有一致的结果, 但在药物诱导或a-Fas诱导的不同人类细胞的凋亡中, 一个单一的5 kDa断片从RB的C端断裂下来. C端断片的特点: (1)有凋亡位点; (2)被碘乙酰胺抑制; (3)描绘了一个氨基酸序列作为CED3/CPP32b-样半胱氨酸蛋白激酶的底物; (4)模拟亚磷酸化RB的转移模式; (5)断裂的结果导致增加截断的RB与E2F家族成员的结合[24]. 药物诱导或Fas诱导的凋亡的初期, C端断裂的关键问题是时间的问题. 例如, 在不可反转的细胞程序性死亡中, RB的端裂是较晚的事件, 反映了激活的半胱氨酸蛋白激酶的活性, 并且在这个过程中起到一个早期生物学作用. RB是细胞生长负性调节子和肿瘤抑制因子, 在许多癌症中如视网膜母细胞瘤和肺癌、乳腺癌、膀胱癌和前列腺癌等发现RB的失活和缺失[25]. 一经磷酸化的RB蛋白将结合的转录因子(E2F家族)释放, 这些转录因子活化那些细胞从G1进入S期所需基因表达. 最近RB蛋白被证明在凋亡发生过程中被水解, 凋亡蛋白酶Caspase家族的一个成员在TNF、叉孢霉素和阿糖胞苷诱导的细胞凋亡中专一裂解RB蛋白, 这种水解作用被ICE类酶的四肽抑制剂所抑制, RB蛋白的破坏可能对于诱发细胞凋亡是必需的.
凋亡逃逸对于癌症的进展是需要的, 逃避哪一条死亡途径还不清楚. 曾经有实验证明一个上皮细胞死亡途径, 在正常细胞中起作用, 但在肿瘤细胞中失活, 暗示在肿瘤进展中可以作为靶子. 这个途径可以被FADD调节蛋白激活, 是通过Caspase-8由FADD诱导的凋亡机制. 展示了一个生理信号(抗-Fas抗体、Fas配体及TRAIL)能杀死正常上皮细胞, 通过内源的FADD蛋白经过神奇的FADD死亡途径, 可以激活凋亡和自溶. 当原代上皮细胞无限增殖时, 选择性抵抗这个途径, 独立于我们所知道的事件(寡聚酶的激活、P53, RB, INK4a和ARF功能的丢失)并且伴随无限增殖. 这些事件证实了一个神奇的死亡途径参与凋亡、自溶, 在上皮癌进展的早期阶段, 这个途径进行选择性失活[26].
尽管Fas作为凋亡诱导者已被认识, 另外还有不依赖凋亡的Fas功能, 包括对T细胞和成纤维细胞增殖的诱导, 肝细胞的再生, 化学因子的产生, 神经突的长出等[27-28], 然而, 在这些过程中, 大部分Fas信号的分子机制被理解的很少. 在Fas诱导凋亡的研究中, Caspase作为细胞凋亡的调节者已被明确, 证实了FADD, Caspase-8等作为Fas-诱导NF-κB信号的最基本内容, 但是Caspase家族在Fas诱导的凋亡作用途径有待于进一步阐明
评论
背景资料
Fas在各种疾病和细胞凋亡的发生中起到重要作用, 在哺乳动物细胞, Caspase以依赖线粒体和非依赖线粒体两条途径促进细胞凋亡, 在Fas诱导凋亡的过程中, Caspase-3, -8与哪些基因相互作用及其作用途径尚不明确.
同行评价
凋亡是目前肿瘤研究的热点课题, 本文对Caspase-3, 8的激活机制及其在Fas诱导细胞凋亡中的作用进行了较为全面的阐述, 文中观点引证有据, 内容前沿, 文笔流畅, 有参考价值.