修回日期: 2006-10-02
接受日期: 2006-10-11
在线出版日期: 2006-12-18
目的: 观察原发性肝癌(HCC)经高强度聚焦超声(HIFU)治疗后临床效果并探讨其影响因素.
方法: 通过对2001-04/2002-12经HIFU治疗的104例原发性肝癌患者肿瘤大小, 数目, 是否转移, HIFU前后AFP, HIFU前肝功能, Child-Pugh分级和TNM分期及彩色多普勒超声检查等指标观察HIFU治疗效果.
结果: 104例原发性肝细胞癌治疗后HCC患者临床症状缓解率为83.2%(80/104), 肝功能好转者占82.7%(86/104), AFP降低超过原数值50%者占62.5%(65/104), 彩色多普勒超声检查癌灶灰阶明显增加或减弱, 癌灶内血液供应减少或消失. HIFU治疗后生存期3-6 mo占59.5%, 12 mo占38.7%, 24 mo占25.6%. HIFU治疗效果与治疗前AFP, TNM分期, 治疗前是否联合TACE治疗, 治疗前是否有转移等因素有关.
结论: HIFU治疗HCC是有效和可行的, 其疗效与治疗前AFP, TNM分期, 治疗前是否联合TACE治疗, 治疗前是否有转移等因素有关.
引文著录: 薛净, 沙卫红, 聂玉强, 李瑜元, 张亚历, 周殿元. 高强度聚焦超声治疗肝细胞癌的疗效及其影响因素. 世界华人消化杂志 2006; 14(35): 3377-3381
Revised: October 2, 2006
Accepted: October 11, 2006
Published online: December 18, 2006
AIM: To observe the efficacy of high intensity focused ultrasound (HIFU) in the treatment of hepatocellular carcinoma (HCC) and investigate the prognostic factors affecting the overall survival.
METHODS: A total of 104 patients with HCC were treated with HIFU and the efficacy was evaluated by the following indexes: tumor size, number, metastasis, alpha fetoprotein (AFP) levels before and after HIFU treatment, hepatic function before HIFU treatment, Child-Pugh classifications, TNM stages and variations in color Doppler sonography.
RESULTS: After HIFU treatment, the remission rates for clinical symptoms and liver function were 83.2% (80/104) and 82.7% (86/104), respectively, and the patients with AFP decreased by more than 50% covered a percentage of 62.5% (65/104). After HIFU, color Doppler sonography manifested coagulative necrosis and tumor blood supply reduction or disappearance in the target region. The survival rates of patients were 59.5% (3-6 mo), 38.7% (12 mo) and 25.6% (24 mo). The therapeutic effects of HIFU were correlated with AFP levels, TNM stages and treatment combined with transcatheter arterial chemoembolization and metastasis before treatment.
CONCLUSION: HIFU is effective and feasible in the treatment of HCC, and its efficacy is associated with the pretherapeutic AFP levels, TNM stages and treatment combined with transcatheter arterial chemoembolization and metastasis.
- Citation: Xue J, Sha WH, Nie YQ, Li YY, Zhang YL, Zhou DY. Efficacy of high intensity focused ultrasound in treatment of hepatocellular carcinoma and its influential factors. Shijie Huaren Xiaohua Zazhi 2006; 14(35): 3377-3381
- URL: https://www.wjgnet.com/1009-3079/full/v14/i35/3377.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i35.3377
肝细胞癌是我国常见的恶性肿瘤之一[1], 消化道肿瘤肝转移亦多见. 由于肝癌细胞一般对放、化疗不敏感, 手术治疗为首选的方法[2]. 但是, 对于中晚期肝癌, 特别是伴有肝硬化、肝功能不全的患者, 以及肿瘤靠近门静脉、肝动脉和多发性、转移性肝癌患者, 手术切除非常困难; 早期肝癌伴有肝硬化肝功能失代偿时, 也属手术禁忌证[3]. 高强度聚焦超声(high intensity focused ultrasound, HIFU)是近年来兴起的局部消融(ablation)治疗肿瘤的方法, 其利用超声波方向性和聚焦性好的特点, 将体外低能量的低频超声聚焦于体内某个靶区, 利用超声波的生物效应, 使靶区的焦点温度瞬间达到65-100 ℃, 使靶区组织产生凝固性坏死, 从而达到局部消融肿瘤的目的. HIFU治疗原发性肝癌的疗效已被大量临床应用所证实[4-6], 但关于治疗后效果的评价及其影响因素的报道较少. 本研究应用临床资料探讨HCC经HIFU治疗后临床效果及其影响因素.
2001-04/2002-12接受HIFU治疗的原发性肝癌患者104例, 全部按卫生部肝癌诊治规范[7], 经影像学(超声加CT或MR), 实验室检查(AFP, CEA, CA199等)诊断, 有23例经肝活检病理组织学所证实. 其中HCC 89例, 转移性肝癌15例. 男86例, 女18例, 年龄31-67(平均49岁). 患者肿瘤病灶直径为2.6-15.5 cm不等. 多数患者伴有肝内多发病灶部分伴门静脉癌栓或肝内或全身转移. 其中20例(19.2%) HIFU治疗前曾行经皮肝动脉栓塞化疗(TACE)治疗(指HIFU前6 mo和/或HIFU后1 mo内TACE). 所有患者均自愿接受HIFU治疗. HIFU治疗前89例AFP阳性, 其中≥200-500, ≥1000 μg/L分别为64和25例. 肝功能Child-Pugh分级A, B, C级分别为83, 16和5例. 按TNM分期[8], Ⅱb期8例、Ⅲ期49例、Ⅳ期47例. 对肝内残留复发肿瘤, 若患者病情许可, 1 mo后进行再次行HIFU治疗.
患者经临床体格检查及影像学检查确定病灶位置、大小、形态和与邻近器官、血管、胆管的关系. 根据上述资料确定治疗方案[9]. 采用重庆医科大学超声研究所提供海扶HIFU肿瘤JC-1型治疗系统. 全麻下按病灶位置调整体位, 多用俯卧位. 最少者1次, 最多者3次. 治疗参数: 频率0.8 MHz, 焦距135-160 mm, 声功率160-230 W. 在B超定位和监测下治疗, 先深后浅, 部分患者治疗次数为2-3次. 筛选可能对HIFU治疗效果产生影响的临床因素包括: 性别、年龄、肿瘤大小、肿瘤数目、是否转移、HIFU前后AFP、HIFU前肝功能、Child-Pugh分级、TNM分期、联合应用TACE、复发等.
统计学处理 应用SPSS 10.0统计软件, 经对数转换后以均数±标准差表示. 采用两样本t检验分析两组间数据差异.
104例肝癌患者治疗前有98例均有不同程度的临床症状, 经过HIFU治疗后症状有明显的改善: 乏力改善, 食欲增加, 体质量有所增加, 肿区不适、疼痛有所缓解, 临床症状缓解率为83.2%(80/104), 肝功能好转者占82.7%(86/104), AFP升高的患者经HIFU治疗后降低超过原数值50%者占62.5%(65/104), HIFU治疗的近期疗效见表1.
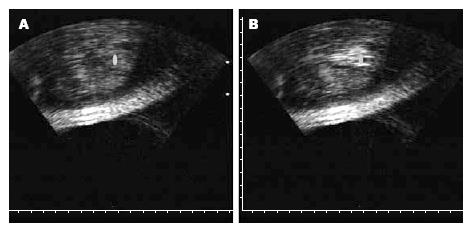
经HIFU治疗时, 其超声声像图有明显的变化, 主要为治疗靶区回声增强, 治疗时灰度增强后, 等待5-10 min, 灰度会减弱, 但治疗区域回声光点变得细小而均匀. 随治疗时间的延长, 治疗时皮肤的水肿情况加重, 靶区超声灰度会减弱. 分析其主要原因可能与肿瘤血供是否丰富、治疗时间、治疗区域等有关. HIFU治疗后靶区肿瘤呈高回声改变, 边界不清, 组织灰阶增加. 2 wk后肿瘤中心区回声减弱, 边缘回声增强, 癌灶血流减少或消失, 病灶明显缩小(图1).
104例原发性肝细胞HIFU治疗后的效果于治疗前AFP、肿瘤的大小、TNM分期、治疗前是否联合TACE治疗、治疗前是否有转移等因素有关. 肝功能异常的患者行HIFU治疗3 d后复查肝功能稍有增高, 但与HIFU治疗前比较差异无显著意义, 其均数±标准差为ALT(1339.1±586.6) nkat/L, AST(1823.0 ±700.8) nkat/L, 其生存期3-6, 12, 24 mo分别为59.5%, 38.7%, 25.6%.
治疗前肿瘤大小直径为2.6-15.5 cm不等, 平均随访11.9 mo, 影响局部复发的因素分析发现肿瘤大小是影响疗效最显著的因素(P<0.01). 治疗前后Child-Pugh积分分别为9.06±1.43, 7.13±3.22, 5.00±5.44 7.65±4.09, 两组比较差异显著(P<0.01); TNM分期, Ⅱb期8例、Ⅲ期49例、Ⅳ期47例, 组间比较差异显著(P<0.01). 术前联合应用TACE, 复发在生存率分析中均为危险度最高的影响因素(表2, 3).
| Sig. | Exp(B) | 95%CI | ||
| Lower | Upper | |||
| 肿瘤大小 | 0.027 | 25.135 | 0.192 | 41.682 |
| 肿瘤数目 | 0.361 | 29.960 | 0.206 | 75.959 |
| 术前AFP | 0.723 | 0.000 | 0.000 | 0.000 |
| Child(П) | 0.334 | 0.046 | 0.000 | 23.982 |
| TNM分期 | 0.020 | 11.132 | 0.000 | 34.063 |
| 性别 | 0.554 | 0.480 | 0.042 | 5.437 |
| 年龄 | 0.981 | 1.001 | 0.913 | 1.097 |
| 联合TACE | 0.001 | 0.000 | 0.000 | 0.042 |
| 复发 | 0.024 | 0.263 | 0.019 | 3.601 |
| 是否转移 | 0.014 | 21.604 | 1.083 | 430.874 |
| B | S.E. | Wald | df | Sig. | Exp(B) | 95%CI for EXP (B) | ||
| Lower | Upper | |||||||
| 肿瘤大小 | 0.496 | 0.993 | 27.89 | 1 | 0.056 | 0.032 | 0.015 | 0.075 |
| TNM分期 | -2.823 | 0.825 | 11.697 | 1 | 0.001 | 0.059 | 0.012 | 0.300 |
| 联合ACE | -5.441 | 1.508 | 13.027 | 1 | 0.000 | 0.004 | 0.000 | 0.083 |
| 复发 | -1.800 | 0.975 | 3.409 | 1 | 0.024 | 0.165 | 0.024 | 1.117 |
| 是否转移 | 1.183 | 0.897 | 1.738 | 1 | 0.043 | 3.265 | 0.562 | 18.953 |
| Constant | 16.275 | 5.021 | 10.508 | 1 | 0.001 | 11702.668 | 0.000 | 0.000 |
由于肝癌细胞一般对放、化疗不敏感, 手术切除目前仍是肝细胞癌(HCC)的首选治疗方法. 然而, 临床上往往一经发现大多数为已无法进行手术切除[10], 仅有10%-20%的HCC患者可以接受手术治疗. 综合治疗包括局部治疗和全身治疗. 局部治疗主要有TAE、PEI、冷冻、激光、射频和微波等[11-12], 与上述方法相比, HIFU是一种非侵入性的体外适形治疗肿瘤的新技术. 国内外大量的动物实验和临床应用HIFU技术治疗多种恶性实体肿瘤亦显示HIFU治疗肝癌的安全有效[13]. 因HIFU技术有可视性、软组织穿透性和聚焦性等物理特点, 可掌握治疗范围, 随肿瘤复发转移重复治疗等优点, 现已越来越受到临床重视.
HIFU是近年才开始应用于临床的无创治疗实体肿瘤的新技术. 将体外低能量超声聚焦在体内肿瘤病灶处, 使焦点处瞬态产生高温, 从而使组织发生凝固性坏死[14]或有效的破坏瘤区血管, 包括动脉、静脉及瘤区微血管. 他可随肿瘤复发转移多次治疗等优点而受到临床重视[15]. 由于HIFU应用于临床的时间远远少于外科和TACE等传统治疗方法, 大样本和长期随访的病例报道较少, 有关治疗影响因素分析的研究更少. 本文对我院过去3年内进行HIFU治疗的104例HCC进行治疗影响因素分析, 并对治疗后生存期进行探讨, 以阐述HIFU治疗原发性肝癌的效果和影响因素.
本组资料分析104例原发性肝细胞经HIFU治疗后患者临床症状较治疗前减轻、血清AFP水平有所下降, 彩色多普勒超声检查癌灶灰阶明显增加或减弱, 癌灶内血液供应减少或消失. 临床上AFP是诊断HCC及复发检测的重要指标. 但是治疗前APF水平对肝癌预后的影响仍有争议. 本组资料显示, 经HIFU治疗原发性肝癌大多数病例AFP下降明显. 可见AFP与HIFU后生存率相关; AFP轻度升高不影响预后, 但AFP>200 U/L有可能成为影响预后的一个因素. 根据Child-Pugh肝功能分级, A, B, C级患者分别为83例、16例、5例. 分析影响患者生存期的诸多因素, 经过临床观察HIFU治疗后生存期为59.5%(3-6 mo), 38.7%(12 mo), 25.6%(24 mo), 说明肝功能是影响HIFU治疗疗效的主要因素之一. 由此可以得出行HIFU前应尽量进行内科治疗恢复肝功能, 治疗中应尽量保留正常肝组织. 应采用较规范的计算方案可达到用最少数目的聚焦灶完全灭活肿瘤, 以减少损伤周围肝组织的目的.
治疗前肿瘤大小直径为2.6-15.5 cm不等, 随访3-28 mo, 2.0-5.0 cm肿瘤的完全坏死率为71.4%(35/49), >5 cm肿瘤的完全坏死率仅为25.4%(14/55). 本组资料对治疗时患者的性别、年龄、肿瘤大小及肿瘤数目等因素进行了统计学分析, 结果显示, 只有肿瘤大小是影响局部复发的一个变量. 对于肿瘤数目可能还需要积累病例观察远期疗效和作进一步研究. 术前联合应用TACE治疗(20例)的患者, 随访11 mo, 局部复发率为25%(5/20), 说明术前联合应用TACE治疗对HIFU治疗疗效的有一定的影响. 本组资料数据分析提示, TNM分期的Ⅰ-Ⅱ期和Ⅲ-Ⅳ期之间具有统计学意义, 但Ⅲ期与Ⅳ期癌之间生存期未见明显差异, 由此可以看出, TNM分期可以反映出肝癌的综合预后. 而对于单发且肿块直径<3 cm无转移者联合应用TACE预后较好, 生存率较高. 多发且肿块直径>5 cm伴转移者预后较差, 生存率较低. 对于肝转移癌的治疗其成功率较低, 分析其原因是多方面的, 其中最重要的是肿瘤的治疗不恰当或对组织的不同反应. 由于较小的肝细胞癌肿瘤边缘多数被假包膜包绕[16-17], 容易被均匀、彻底灭活; 但转移肿瘤的外缘则不同, 肿瘤对周边肝实质的浸润很常见[18], 因遗漏而造成肿瘤局部复发的几率较大. 因此, 对转移性肝癌进行HIFU时应采取更为激进的方法, 如扩大安全治疗范围等, 以降低肿瘤局部复发率.
从本组临床数据来看体检发现的肝癌患者总生存期优于有症状后就诊者, 这就指出应定期进行健康体检, 可早期发现肿瘤、早期治疗, 改善预后, 提高生活质量. 发现原发性肝癌至高强度聚焦超声间隔时间的长短也反映了是否及时进行治疗; 肿瘤分布反映了肿瘤的生长方式及起源特点, 此两项均对无瘤生存率有影响. 生存分析结果显示, 保护肝功能, 治疗前全面影像学检查, 重视规范化治疗和辅助治疗将有助于改善肝癌高强度聚焦超声生存期.
总之, HIFU治疗肝肿瘤疗效及其影响因素是多种因素决定的. 通过分析我们发现肝功能、肿瘤大小、术前联合应用TACE治疗、是否伴有转移、TNM分期、复发均对HIFU的疗效有一定的影响. 这些因素将反映手术后的有效率. 正确评价HIFU的疗效, 充分了解疗效、并发症及相关的影响因素, 将有助于指导临床实际应用, 从而提高肝肿瘤的治疗水平.
由于肝癌细胞一般对放、化疗不敏感, 手术切除目前仍是肝细胞癌(HCC)的首选治疗方法. 然而, 临床上往往一经发现大多数为已无法进行手术切除, 高强度聚焦超声(HIFU)是近年才开始应用于临床的无创治疗实体肿瘤的新技术, HIFU治疗原发性肝癌的疗效已被大量临床应用所证实, 但关于治疗后效果的评价及其影响因素的报道较少.
本文探讨了高强度聚焦超声治疗原发性肝癌的疗效及其影响因素, 有一定参考价值.
电编: 张敏 编辑: 张焕兰
| 1. | Yang R, Reilly CR, Rescorla FJ, Faught PR, Sanghvi NT, Fry FJ, Franklin TD Jr, Lumeng L, Grosfeld JL. High-intensity focused ultrasound in the treatment of experimental liver cancer. Arch Surg. 1991;126:1002-1009; discussion 1009-1010. [PubMed] |
| 2. | Thuroff S, Chaussy C. High-intensity focused ultrasound: complications and adverse events. Mol Urol. 2000;4:183-187; discussion 189. [PubMed] |
| 3. | Sato M, Watanabe Y, Kashu Y, Nakata T, Hamada Y, Kawachi K. Sequential percutaneous microwave coagulation therapy for liver tumor. Am J Surg. 1998;175:322-324. [PubMed] |
| 4. | Wu F, Wang ZB, Chen WZ, Zou JZ, Bai J, Zhu H, Li KQ, Jin CB, Xie FL, Su HB. Advanced hepatocellular carcinoma: treatment with high-intensity focused ultrasound ablation combined with transcatheter arterial embolization. Radiology. 2005;235:659-667. [PubMed] |
| 5. | Yi J, Li N, Jiang LS, Xiong XZ. The study of clinical application of high intensity focused ultrasound in non-invasive therapy for liver cancer. Sichuan Daxue Xuebao Yixueban. 2005;36:426-428. [PubMed] |
| 6. | Wu F, Wang ZB, Chen WZ, Zhu H, Bai J, Zou JZ, Li KQ, Jin CB, Xie FL, Su HB. Extracorporeal high intensity focused ultrasound ablation in the treatment of patients with large hepatocellular carcinoma. Ann Surg Oncol. 2004;11:1061-1069. [PubMed] |
| 7. | Su XZ. Computed tomography in the diagnosis of hepatocellular carcinoma. Zhonghua Zhongliu Zazhi. 1983;5:52-54. [PubMed] |
| 8. | Zhang Z, Wu M, Shen F. Significance of TNM clasification in prognostic evaluation of hepato-celluar carcinoma following surgical resection. Zhonghua Zhongliu Zazhi. 1999;21:293-295. [PubMed] |
| 9. | ter Haar G, Sinnett D, Rivens I. High intensity focused ultrasound-a surgical technique for the treatment of discrete liver tumours. Phys Med Biol. 1989;34:1743-1750. [PubMed] |
| 10. | Ahmed M, Goldberg SN. Thermal ablation therapy for hepatocellular carcinoma. J Vasc Interv Radiol. 2002;13:S231-244. [PubMed] |
| 11. | Sibille A, Prat F, Chapelon JY, Abou el Fadil F, Henry L, Theillere Y, Ponchon T, Cathignol D. Extracorporeal ablation of liver tissue by high-intensity focused ultrasound. Oncology. 1993;50:375-379. [PubMed] |
| 12. | Zhang L, Jensen RT, Maton PN. Characterization of beta-adrenoreceptors on smooth muscle cells from guinea pig stomach. Am J Physiol. 1990;259:G436-442. [PubMed] |
| 13. | Wang XJ, Yuan SL, Lu YR, Zhang J, Liu BT, Zeng WF, He YM, Fu YR. Growth inhibition of high-intensity focused ultrasound on hepatic cancer in vivo. World J Gastroenterol. 2005;11:4317-4320. [PubMed] |
| 14. | Zibari GB, Riche A, Zizzi HC, McMillan RW, Aultman DF, Boykin KN, Gonzalez E, Nandy I, Dies DF, Gholson CF. Surgical and nonsurgical management of primary and metastatic liver tumors. Am Surg. 1998;64:211-220; discussion 220-221. [PubMed] |
| 15. | Farmer DG, Rosove MH, Shaked A, Busuttil RW. Current treatment modalities for hepatocellular carcinoma. Ann Surg. 1994;219:236-247. [PubMed] |
| 16. | Jin CB, Wu F, Wang ZB, Chen WZ, Zhu H. High intensity focused ultrasound therapy combined with transcatheter arterial chemoembolization for advanced hepatocellular carcinoma. Zhonghua Zhongliu Zazhi. 2003;25:401-403. [PubMed] |
| 17. | Wang XJ, Yuan SI, Zhang J, Lu YR, Wang YP, Chen XH, Ning QZ, Fu YR, Liu BT, Zeng WF. A study of the inhibition effect of HIFU and its mechanism of action on the proliferation of human breast cancer cells. Sichuan Daxue Xuebao Yixueban. 2004;35:60-63. [PubMed] |
| 18. | Li CX, Xu GL, Jiang ZY, Li JJ, Luo GY, Shan HB, Zhang R, Li Y. Analysis of clinical effect of high-intensity focused ultrasound on liver cancer. World J Gastroenterol. 2004;10:2201-2204. [PubMed] |