修回日期: 2006-09-10
接受日期: 2006-09-25
在线出版日期: 2006-12-18
目的: 观察不同浓度磁性纳米控释紫杉醇对食管癌细胞Eca109的影响及与不同化疗药物的对比.
方法: 取对数生长期的食管癌Eca109细胞作细胞增殖抑制实验, 实验组分别给予不同浓度的磁性纳米控释紫杉醇和5-氟尿嘧啶、泰素, 同时设立二甲基亚砜(DMSO)和RPMI 1640液对照, 测定24, 48, 72 h三个时间段的吸光度值, 计算抑制率. 经不同浓度的磁性纳米控释紫杉醇作用72 h后, 用电镜观察细胞超微结构, 同时用流式细胞仪测定细胞周期和细胞凋亡.
结果: MTT实验显示磁性纳米控释紫杉醇可抑制食管癌细胞增殖, 与5-氟尿嘧啶, 泰素相比, 具有缓释性(P<0.01); 电镜可发现药物作用组细胞核固缩、解聚以及凋亡小体; 流式细胞仪检测显示G1峰前有明显的凋亡峰; 细胞周期分析提示磁性纳米控释紫杉醇可将Eca109细胞阻滞于G2-M期, 且与浓度相关.
结论: 磁性纳米控释紫杉醇对人食管癌细胞Eca109的生长有明显的抑制作用, 使细胞分裂阻滞于G2-M期, 并诱导细胞凋亡, 且具有缓释效果.
引文著录: 陈萍, 施瑞华, 凌亭生. 磁性纳米控释紫杉醇对食管癌Eca109细胞株生长的影响. 世界华人消化杂志 2006; 14(35): 3348-3352
Revised: September 10, 2006
Accepted: September 25, 2006
Published online: December 18, 2006
AIM: To observe the effects of magnetic nano-controlled paclitaxel at different concentrations on the growth of esophageal carcinoma cell line Eca109.
METHODS: Eca109 cells in logarithmic growth phase were treated by magnetic nano-controlled release paclitaxel at different concentrations, fluorouracil (5-FU) and Taisu, while dimethylsurfoxide (DMSO) and RPMI 1640 were used in the control cells. MTT assay was used to examine the inhibitory rate through the absorbency of 24, 48, and 72 h. After Eca109 cells were disposed by magnetic nano-controlled release paclitaxel at different concentrations for 72 h, the cellular ultrastructure was observed under electron microscope and cell cycle and apoptosis were analyzed by flow cytometry.
RESULTS: Magnetic nano-controlled release paclitaxel inhibited the proliferation of Eca109 cell in vitro, and the effect had characteristic of slower release in comparison with that of 5-FU or Taisu (78.1% vs 60.0%, 63.8%, P < 0.01). Chromation condensation, nucleic fragmentation and apoptic body formation were found in drug-treated cells by electron microscopy. Flow cytometry analysis showed an obvious apoptotic peak before G1 peak and magnetic nano-controlled release paclitaxel blocked Eca109 cells in G2-M phase, which was associated with the concentrations.
CONCLUSION: Magnetic nano-controlled release paclitaxel can induce apoptosis and block cell cycle of esophageal cells.
- Citation: Chen P, Shi RH, Ling TS. Effects of magnetic nano-controlled release paclitaxel on the growth of esophageal carcinoma cell line Eca109. Shijie Huaren Xiaohua Zazhi 2006; 14(35): 3348-3352
- URL: https://www.wjgnet.com/1009-3079/full/v14/i35/3348.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i35.3348
食管癌严重危害人民生命健康, 目前主要的治疗方法包括外科手术、化学治疗、放射治疗及生物免疫治疗. 外科手术是实体瘤的首选治疗方法, 但许多患者往往在就诊时已有局部或全身转移病灶, 手术无法根除原发病灶, 此时化学治疗成为主要治疗手段之一. 化疗药物对肿瘤缺乏特异亲和性和专一性, 临床应用全身毒副作用大. 因此, 多年来人们一直希望能改变化疗药物剂型, 使其能有效到达肿瘤部位, 提高疗效, 降低毒副作用[1]. 磁靶向给药系统(magnetic targeting drug delivery system, MTDDS)作为一种新型药物载体指将药物与适当的磁活性成分配置在稳定系统中, 于一定磁场作用下将药物定位于靶器官而发挥作用[2]. 本课题采用我们自行制备的纳米级磁性控释紫杉醇进行体外对食管癌细胞株生长的抑制作用及其机制的研究, 为其用于食管癌的临床治疗提供实验基础. 紫杉醇(tatol, paclitaxel)是近年来研究开发的化学结构新颖、作用机制独特的新型抗肿瘤药物. 他可促进微血管双聚体装配成微管, 并阻止微管蛋白解聚, 使微管稳定, 从而阻碍细胞分裂, 使其发生凋亡, 达到抑制肿瘤细胞的生长, 对多种中晚期肿瘤有一定的疗效, 但其水溶性差, 不便临床应用[3-5]. 利用超声乳化-溶剂挥发法自行制备的磁性纳米控释紫杉醇具有水溶性好、缓释、靶向性的特点[6]. 如在体外被证实对食管癌细胞具有良好的制抑生长及促进凋亡作用, 将对其用于临床, 在足够强的外加磁场作用下, 使其在体内定向移动, 定向浓集, 作用于食管癌局部, 从而达到提高治疗效果, 降低毒副作用带来广阔的应用前景.
RPMI 1640培养液, 小牛血清, 四甲基偶氮唑蓝(MTT), 碘化丙啶(PI)及Rnase(美国Sigma公司), 磁性白蛋白纳米控释紫杉醇(磁性材料为Fe3O4, 分子质量853.9 Da, 自行制备), 5-氟尿嘧啶, 泰素(紫杉醇的商品名, 由百时美施贵宝公司提供, 6 g/L, 分子质量853.9 Da). 人食管癌细胞株Eca109取自北京肿瘤防治研究所, 用含100 mL/L小牛血清的RPMI 1640培养液培养, 生长于37 ℃含50 mL/L的CO2孵箱中, 待细胞长至单层后, 以2.5 g/L的胰蛋白酶消化贴壁细胞, 选用对数生长期细胞用于实验.
1.2.1 细胞增殖抑制实验: 采用MTT法, 选择对数生长期细胞, 调整细胞数为2.5×107/L接种于96孔培养板, 每孔200 μL, 实验组分别给予10-5, 10-6, 10-7, 10-8, 10-9 mmol/L浓度的磁性纳米控释紫杉醇和5-氟尿嘧啶(5-FU)、泰素, 同时设立二甲基亚枫(DMSO)和RPMI 1640液对照, 每组的每个浓度设8个复孔, 分别于24, 48, 72 h, 每孔加入20 μL 5 g/L MTT, 孵育4 h后, 弃上清, 加入DMSO终止反应. 微振荡后, 于酶标仪波长620 nm处测吸光度值(A), 抑制率(%) = (1-实验组A/对照组A)×100%, 即吸光度值越大, 抑制率越小.
1.2.2 形态学观查: 细胞经不同浓度的磁性纳米控释紫杉醇作用, 72 h后用胰酶消化, 离心收集细胞, 25 g/L戊二醛固定, 置于4 ℃冰箱30 min, 常规制作电镜标本, 双铅染色后, 置1200EX型透射电镜下观察细胞超微结构, 并摄像.
1.2.3 细胞周期和细胞凋亡率的测定: 72 h后, 收集不同浓度作用的Eca109细胞, PBS洗涤后用4 ℃的700 mL/L乙醇固定12 h以上, 经离心去乙醇, 加10 g/L Rnase 200 μL, 37 ℃水浴15 min, 加碘化丙啶染色, 用Becton Dickinons公司FACS Calibur型流式细胞仪检测(汞灯激发光波长为488 nm), 根据DNA含量测定细胞时相(G0-G, S, G2-M). 位于G0-G1前期的亚二倍体峰为"凋亡峰), 所得资料均经LysisⅡ软件收集、贮存和分析.
统计学处理 采用t检验补充检验水准等.
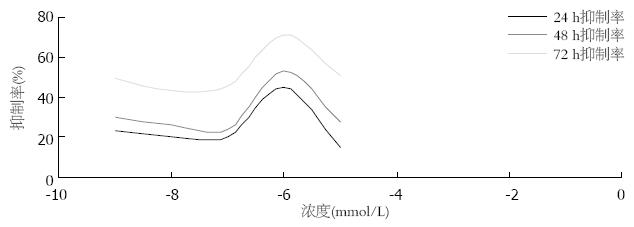
不同浓度磁性纳米控释紫杉醇与Eca109细胞共同孵育后, 细胞生长受到抑制, 并呈剂量效应关系. 在3个不同的时间段, 各浓度的抑制率都在72 h达到最高, 其中, 10-6 mmol/L浓度的磁性紫杉醇其他浓度相比, 抑制率明显高于对照组. 不同浓度磁性纳米控释紫杉醇与空白, 泰素在24, 48, 72 h的吸光度值相比, 均有显著差异, 其中, 24, 48 h磁性纳米紫杉醇抑制率小于对照组, 而在72 h抑制率明显高于对照组, 有缓释作用(表1, 2). 图1表明随着时间的延长, 任意浓度的磁靶向纳米紫杉醇对肿瘤细胞的抑制率均逐渐升高, 说明其抑制肿瘤细胞增殖的效应具有时间依赖性. 任意时间段内, 10-6 mmol/L浓度的磁性紫杉醇的抑制率高于其他任何浓度组.
| 浓度(mmol/L) | 吸光度值(A) | 抑制率(%) |
| 空白 | 0.907±0.086 | |
| 10-5 | 0.625±0.178 | 31.1 |
| 10-6 | 0.395±0.129 | 56.4b |
| 10-7 | 0.637±0.146 | 29.8 |
| 10-8 | 0.636±0.122 | 29.9 |
| 10-9 | 0.597±0.135 | 34.2 |
| 24 h吸光度 | 48 h吸光度 | 72 h吸光度 | 抑制率(%) | |
| 空白 | 1.060±0.209 | |||
| 磁性 | 0.874±0.092 | 0.623±0.073 | 0.232±0.056 | 17.6/41.3/78.1 |
| 泰素 | 0.483±0.059 | 0.394±0.043 | 0.384±0.065 | 54.5/62.8/63.8 |
| 5-FU | 0.511±0.044 | 0.438±0.057 | 0.424±0.056 | 51.8/58.7/60.0 |
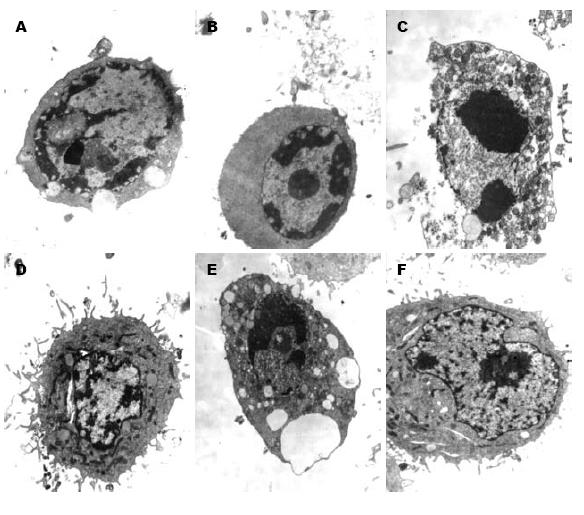
正常情况下, Eca109细胞呈多角形, 贴壁生长. 在磁性纳米紫杉醇的作用下, 癌细胞逐渐变圆, 折光性减弱, 贴壁细胞数减少. 电镜下经磁性纳米紫杉醇处理的细胞可出现细胞核DNA固缩, 解聚以及凋亡小体, 并可见大量处于分裂期的细胞, 而空白对照组细胞生长良好, 未见上述改变, 而以72 h各浓度组凋亡小体出现最多(图2).
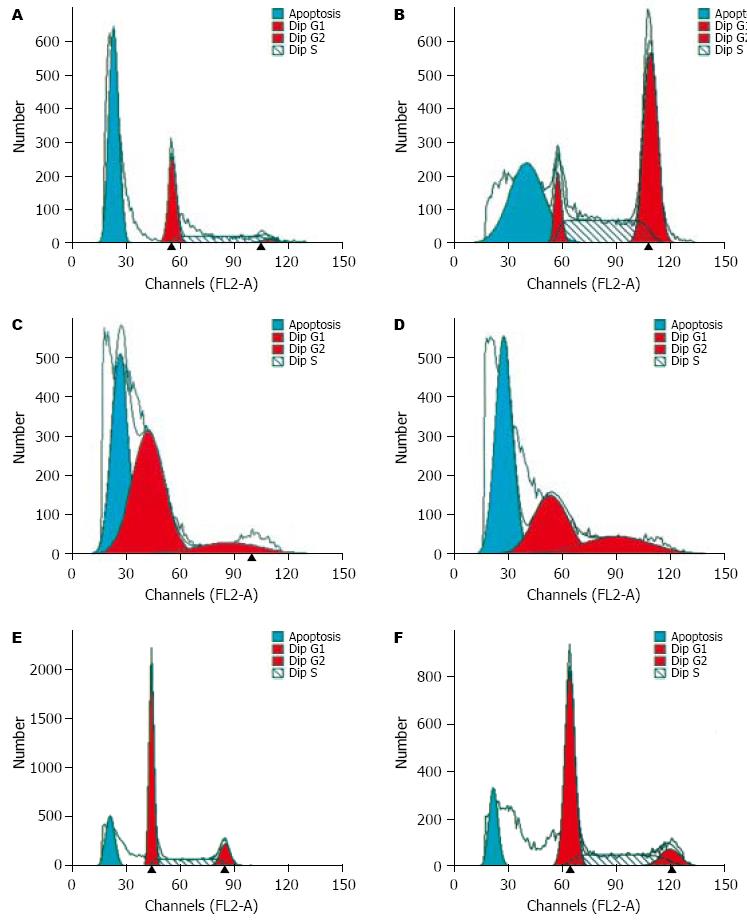
无论低浓度还是高浓度磁性纳米紫杉醇均可将Eca109细胞阻滞于G2-M期, 低浓度磁性纳米紫杉醇处理的细胞阻断G2-M期短暂, 不完全, 而高浓度磁性纳米紫杉醇对食管癌细胞的G2-M期阻断较低浓度的完全、持久. 在G2-M期阻断过后, 流式细胞仪可检测到凋亡期, 10-5, 10-6, 10-7 mmol/L的磁性纳米紫杉醇作用后, 凋亡细胞明显多于空白及对照组, 且持续时间延长, 具有缓释性. 高浓度组在24 h后出现诱导凋亡作用, 而在72 h后呈直接杀伤作用, 低浓度组在48 h后出现诱导凋亡作用(图3).
理想的药物分布应该是, 目的药物选择性的、集中分布到需要发挥疗效的作用部位, 并在必要时间内维持一定浓度, 尽量少向无关部位分布, 即具有靶向性、缓释性. 纳米粒由于其粒度小, 易穿过各种生理屏障而达到特定部位. 他们容易被肝、脾、骨髓等网状内皮系统的巨噬细胞吞噬, 被动的靶向于此类器官中, 其中, 肝富集最多. 若病变部位不在此类器官, 则被动靶向是不利的. 要使纳米粒能靶向于特定部位, 可以对纳米粒进行表面修饰. 其中方法之一是加磁性材料, 通过外加磁场, 对于特异性部位有很好的靶向性[7-9]. 磁性纳米紫杉醇是利用超声乳化-溶剂挥发法制备成白蛋白纳米微粒紫杉醇, 以Fe3O4作为磁性材料, 目的使其在外加磁场的作用下, 如食管支架上加磁场, 使药物选择性的浓集于肿瘤局部, 以达到高效, 缓释的杀伤肿瘤细胞, 提高疗效, 减少副作用[10-13]. 紫杉醇已被证实是一种新型独特的抗肿瘤药, 作用机制是其可促进微管双聚体装配成微管, 并防止微管蛋白解聚, 使微管稳定, 促使肿瘤细胞凋亡, 达到抑制肿瘤细胞生长的作用[14-17]. 磁性纳米紫杉醇和紫杉醇及其他抗肿瘤药相比, 在体外对食管癌细胞生长的抑制作用有无差异及可能的机制, 是本课题要探讨的问题.
在本实验中, MTT实验及流式细胞仪细胞周期分析, 均提示磁性纳米紫杉醇具有缓释作用, 在72 h后药物作用达高峰, 高于对照组, MTT实验中, 不同浓度磁性纳米紫杉醇作用于肿瘤细胞后, 提示10-6 mmol/L浓度的磁性纳米紫杉醇对肿瘤细胞的生长抑制率最高. 细胞生长抑制率大小是反映药物抑制细胞增殖分化功能的指标. 10-6 mmol/L浓度的磁性纳米紫杉醇有较强的抑制作用, 推测可能与其更能影响微管蛋白的聚集有关, 表明该浓度对微管蛋白聚集有更强的细胞毒作用而诱导细胞发生凋亡的. 流式细胞细胞周期分析结果显示, 高浓度组在24 h后出现诱导凋亡作用, 而在72 h后呈直接杀伤作用, 低浓度组在48 h后开始出现诱导凋亡作用. 推测由于缓释作用, 高浓度药物在24 h后药物释放的浓度达到最低诱导凋亡浓度, 而在72 h后药物释放高峰后, 药物浓度增加, 呈直接杀伤作用. 而低浓药物在48 h后药物释放达到最低诱导凋亡浓度. 凋亡诱导时间与药物浓度在一定范围内呈时间依赖性关系. 磁性纳米紫杉醇的抗癌效果与其诱导细胞凋亡的能力密切相关. 本实验用药组电镜下出现的细胞核固缩, 解聚以及凋亡小体, 流式细胞仪可检测到明显的凋亡峰, 充分证明磁性纳米紫杉醇对食管癌细胞有明显的抑制作用, 他不仅可将细胞阻滞于G2-M期, 还可诱导凋亡, 并随着时间的延长, 其药物释放量达峰值后, 药物作用更趋明显, 有缓释作用.
食管癌严重危害人民生命健康, 化学治疗是中晚期食管癌的主要治疗手段之一. 磁性纳米紫杉醇作为一种新型药物, 是利用超声乳化-溶剂挥发法制备成白蛋白纳米微粒, 以四氧化三铁作为磁性材料, 目的使其在外加磁场的作用下, 如食管支架上加磁场, 使药物选择性的浓集于肿瘤局部, 以达到高效, 缓释的杀伤肿瘤细胞, 提高疗效, 减少副作用. 磁性纳米紫杉醇在体外对食管癌细胞生长的抑制作用及可能的机制, 目前尚未阐述清楚.
在过去的10余年中, 人们对紫杉醇在妇科及消化道肿瘤的治疗作用的研究较多, 紫杉醇的抑癌作用已得到公认. 磁性纳米紫杉醇与紫杉醇及其他化疗药物相比, 对食管癌细胞的生长抑制作用有无差异及可能机制, 对其进行深入研究, 有望开辟肿瘤治疗的又一重要途径.
Mulet al研究认为, 磁性纳米紫杉醇是一种新型的缓释的抗癌新药, Sunet al研究认为, 磁性纳米紫杉醇可增加靶向作用, 国内张伟、沈锡中在正常小鼠体内应用磁性阿克拉霉素, 认为可增加靶向性. 这些研究均提示, 磁性纳米紫杉醇作为一种新型抗癌药物, 可增加化疗的效果, 达到高效、缓释、靶向的作用.
磁靶向给药系统作为一种新型药物载体, 于一定磁场作用下, 药物可浓集于肿瘤局部, 达到高效、缓释、靶向的目的, 因此, 对磁靶向给药系统的研究成为抗肿瘤研究的新热点, 可以预见, 随着对磁靶向给药系统的深入研究, 有可能开辟肿瘤治疗的又一个重要有效途径.
传统的化疗药物对肿瘤细胞缺乏特异亲和性和专一性, 药物疗效与剂量呈正相关, 临床应用毒副作用大, 因此, 多年来人们一直希望能改变药物剂型, 使其能有效到达肿瘤部位, 提高疗效, 降低毒副作用. 磁性纳米紫杉醇可以有望成为这样一种剂型.
磁靶向给药系统(MTDDS): 是一种新型的药物载体, 指药物与适当的磁活性成分配置在稳定的系统中, 在一定磁场作用下, 将药物定位于靶向而发挥作用.
电编: 张敏 编辑: 张焕兰
| 7. | Chen JZ, Ranade SV, Xie XQ. NMR characterization of paclitaxel/poly (styrene-isobutylene-styrene) formulations. Int J Pharm. 2005;305:129-144. [PubMed] |
| 8. | Dong AJ, Deng LD, Sun DX, Zhang YT, Jin JZ, Yuan YJ. Studies on paclitaxel-loaded nanoparticles of amphiphilic block copolymer. Yaoxue Xuebao. 2004;39:149-152. [PubMed] |
| 9. | Mu L, Feng SS. A novel controlled release formula-tion for the anticancer drug paclitaxel (Taxol): PLGA nanoparticles containing vitamin E TPGS. J Control Release. 2003;86:33-48. [PubMed] |
| 10. | Sun EY, Josephson L, Weissleder R. "Clickable" nanoparticles for targeted imaging. Mol Imaging. 2006;5:122-128. [PubMed] |
| 11. | Liu SQ, Tong YW, Yang YY. Thermally sensitive micelles self-assembled from poly(N-isopropylacrylamide-co-N, N-dimethylacrylamide)-b-poly(D, L-lactide-co-glycolide) for controlled delivery of paclitaxel. Mol Biosyst. 2005;1:158-165. [PubMed] |
| 12. | Cavalli R, Caputo O, Gasco MR. Preparation and characterization of solid lipid nanospheres containing paclitaxel. Eur J Pharm Sci. 2000;10:305-309. [PubMed] |
| 13. | Gradishar WJ. Albumin-bound paclitaxel: a next-generation taxane. Expert Opin Pharmacother. 2006;7:1041-1053. [PubMed] |
| 14. | Ami K, Nagahama T, Andou M, Nawa K, Ganno H, Ohbu M, Kimu K, Ito T, Yamauchi A, Ichikawa S. A case of ascities decrease in malignant peritoneal mesothelioma by weekly intra-peritoneal administration of cisplatin and paclitaxel. Gan To Kagaku Ryoho. 2005;32:1709-1711. [PubMed] |
| 16. | 马 湘一, 何 福仙, 陈 刚, 徐 茜, 刘 玉兰, 邬 素芳, 李 辅军, 卢 运萍, 马 丁. 紫杉醇诱导卵巢癌细胞凋亡及对survivin基因表达的影响. 现代妇产科进展. 2005;14:44-46. |
| 17. | 王 承龙, 邓 雪娥, 肖 健云, 赵 素萍, 张 帅. 紫杉醇对鼻咽癌上皮细胞株HNE-1生长抑制和凋亡的影响. 中国耳鼻咽喉颅底外科杂志. 2004;10:263-265. |