修回日期: 2006-09-01
接受日期: 2006-09-12
在线出版日期: 2006-11-28
目的: 探讨缺氧对转化生长因子β1(transform-ing growth factor-β1, TGF-β1)在肝细胞表达的影响.
方法: 选择SD大鼠20只, 采用气管阻塞的方法建立轻、中、重度的缺氧模型, 15 min和60 min采集肝脏标本, 用免疫组化技术SABC法检测肝细胞转化生长因子β1表达的变化.
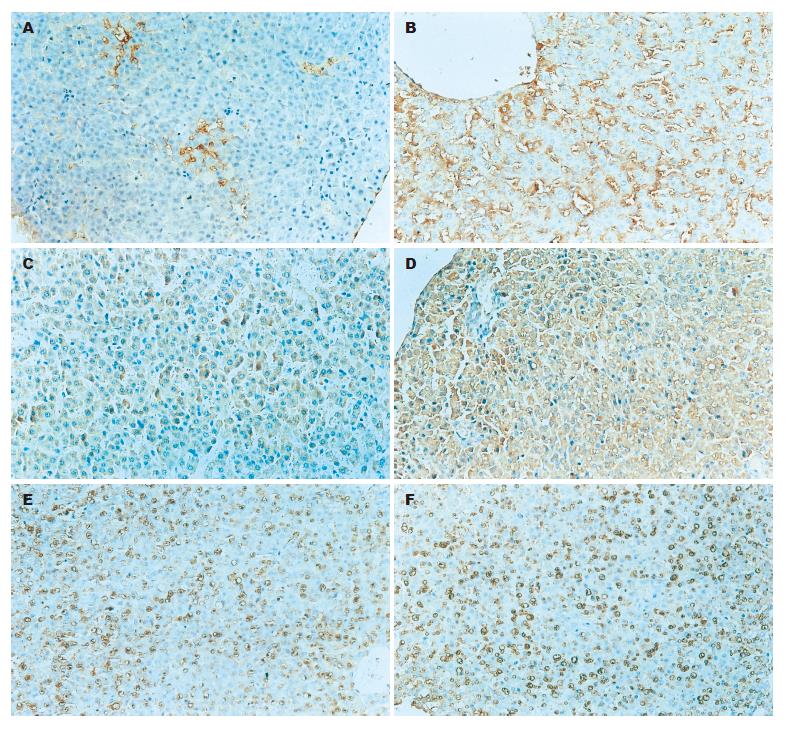
结果: 在正常肝脏中TGF-β1极少表达或无表达(15和60 min分别为3.6±1.9, 3.6±1.9), 随着缺氧时间的延长与缺氧程度的加重, 肝细胞转化生长因子β1表达逐渐增加(轻度缺氧15和60 min分别为8.5±2.0, 15.2±3.1; 中度缺氧15和60 min分别为18.4±3.5, 63.7±3.8; 重度缺氧15和60 min分别为68.9±3.2, 86.7±3.6).
结论: 大鼠缺氧条件下肝脏TGF-β1表达增加可促进细胞外基质的合成, 有利于肝细胞的再生与修复.
引文著录: 李侠, 詹皓, 齐颖, 王琼, 赵安东, 王喆, 笪冀平, 施新猷. 缺氧对大鼠肝细胞转化生长因子β1表达的影响. 世界华人消化杂志 2006; 14(33): 3180-3183
Revised: September 1, 2006
Accepted: September 12, 2006
Published online: November 28, 2006
AIM: To investigate the effect of anoxia on the expression of transforming growth factor-β1 (TGF-β1) in the rat liver.
METHODS: A total of 20 Sprague Dawley rats were used in this study. Trachea obstructive method was employed to establish the animal model of mild, moderate, and severe anoxia. Liver samples were collected 15 and 60 min after obstruction for the examination of TGF-β1 expression using immunohistochemical technique.
RESULTS: TGF-β1 was not or lowly expressed in normal rats (3.6 ± 1.9 and 3.6 ± 1.9, respectively at 15 and 60 min). The level of hepatic TGF-β1 expression was increased with prolonging of anoxia time and enhancement of anoxia degree. The expression of hepatic TGF-β1 at 15 and 60 min was 8.5 ± 2.0 and 15.2 ± 3.1 under mild anoxia, 18.4 ± 3.5 and 63.7 ± 3.8 under moderate anoxia, and 68.9 ± 3.2 and 86.7 ± 3.6 under severe anoxia, respectively. There were significant differences between normal and anoxia rats (P < 0.05 or P < 0.01).
CONCLUSION: TGF-β1 expression is increased under the condition of anoxia, which accelerates the formation of extracellular matrix, and further contributes to the repair and regeneration of liver cells.
- Citation: Li X, Zhan H, Qi Y, Wang Q, Zhao AD, Wang Z, Da JP, Shi XY. Effects of anoxia on expression of transforming growth factor-β1 in rat liver. Shijie Huaren Xiaohua Zazhi 2006; 14(33): 3180-3183
- URL: https://www.wjgnet.com/1009-3079/full/v14/i33/3180.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i33.3180
众所周知, 临床上缺氧可以引起多组织器官的损伤和不同系统的疾病; 而且缺氧对机体的损伤机制和防护措施的研究在航空航天医学领域亦具有重要意义和实用价值. 近年来的研究表明, 转化生长因子β1在脑、心、骨骼、周围神经等器官组织的缺血缺氧损伤和修复中起重要作用[1-5], 但关于缺氧条件下肝组织该因子表达的变化研究甚少. 为探讨缺氧对肝转化生长因子β1表达的影响, 本研究以SD大鼠为对象, 采取轻、中、重度缺氧条件下的肝脏标本, 用免疫组化方法观察了肝细胞转化生长因子β1在不同的缺氧程度和缺氧时间表达水平的变化.
健康SD大鼠20只, 体质量120-140 g, 购自军事医学科学院实验动物中心. TGF-β1鼠mAb与免疫组化SABC试剂盒购自武汉博士德生物工程有限公司. 大鼠随机分4组: 轻度缺氧组、中度缺氧组、重度缺氧组及正常对照组. 大鼠ip苯巴比妥(40 mg/kg)麻醉后行气管插管, 气管阻塞1/2为轻度窒息缺氧, 气管阻塞2/3为中度窒息缺氧, 气管完全阻塞为重度窒息缺氧. 各组均取缺氧15 min和60 min时的肝组织, 用40 g/L甲醛固定24 h, 然后用石蜡包埋固定, 做连续切片5 mm, 脱蜡, 分别进行HE染色与免疫组化染色. 切片用双盲法在显微镜下观察, 每张切片取5个高倍视野(×400).
石蜡切片, 脱水, 采用ABC法, 按照试剂盒说明进行, 检测正常与实验组TGF-β1抗原蛋白, 切片经过DAB染色, 染色过程中设阳性和阴性对照. 细胞核为蓝色, 胞质内着棕褐色为阳性细胞, 阴性(-)为细胞内未见棕褐色颗粒, 弱阳性(±)为细胞内棕褐色颗粒极少表达, 轻度阳性(+)为细胞内棕褐色颗粒局灶性弱表达, 中度阳性(++)为较大片肝细胞内着棕褐色颗粒或小局灶性着棕褐色颗粒的强表达, 强阳性(+++)为弥漫性肝细胞内着深棕褐色颗粒重度表达. 结果的定量判断是计数100个细胞, 轻度阳性为着色阳性细胞比例小于25%, 中度阳性为着色阳性细胞比例为25%-75%, 强阳性为着色阳性细胞比例为大于75%.
统计学处理 用SPLM统计学软件包对数据进行处理, 所有计量数据资料用mean±SD表示, 组间比较采用方差分析.
典型肝细胞TGF-β1抗原蛋白表达为细胞核蓝色, 胞质着棕褐色. 各组间TGF-β1抗原蛋白表达水平有明显差异. 随着缺氧时间的延长和缺氧程度的加重, 各组肝细胞TGF-β1抗原蛋白表达逐渐增强(表1, 图1).
转化生长因子是细胞产生和分化的多功能调节因子, 具有调节细胞增殖, 分化及细胞外基质合成代谢的作用[6-7]. TGF-β1主要由血小板、单核细胞、巨噬细胞、成纤维细胞、平滑肌细胞、内皮细胞和淋巴细胞等合成, 其生理功能很多, 最早发现他能促进成纤维细胞的生长, 其后发现在调节细胞周期、伤口愈合、血管形成、细胞分化、胚胎形成、免疫调节、细胞凋亡等方面都有作用. 迄今的研究表明, TGF-β1参与肝损伤有关的一些临床疾病的病理生理过程[8-10]. 在肝脏中, TGF-β1是最主要的成份, 他主要由肝脏的贮脂细胞/肌成纤维细胞、枯否细胞及内皮细胞等合成. 枯否细胞、成纤维细胞和血小板合成的TGTβ 78%-98%是无活性的, 需经内皮细胞通过纤维蛋白溶酶的作用, 将其结构中的LAP裂解, 使其转化为有活性的TGF-β1, 后者能与其相应受体结合, 发挥生理功能. 国外研究较多的当属TGF-β1对细胞外基质的合成及降解的影响[10]. 肝脏受损后刺激单核巨噬细胞因子, 在经内皮细胞活化后, 以旁分泌和自分泌方式作用于贮脂细胞及其激活后的成纤维细胞, 促进细胞外基质的合成, 促进贮脂细胞增殖与肌成纤维增殖[11], TGF-β1与肝纤维化的发生密切相关[12-14]. 有研究表明, 由于能够促进细胞外基质与蛋白多糖合成, TGF-β1在创伤修复中起重要作用[15-17].
本研究的结果表明, 在正常大鼠肝脏中TGF-β1极少表达或无表达, 随着缺氧时间的延长与缺氧程度的加重, 肝细胞转化生长因子β1表达逐步增加. 提示TGF-β1与缺氧条件下肝细胞的病理生理过程, TGF-β1有可能对缺氧导致肝细胞损伤的再生与修复起重要作用. 本研究结果与近年来国内外关于TGF-β1对非缺氧条件所致肝细胞损伤具有再生与修复作用的报道相一致[17-19]. 关于TGF-β1是如何调控凋亡基因以减轻或逆转肝细胞的凋亡使损伤的肝细胞得到再生与修复等问题有待做更深入的研究.
临床上缺氧可以引起多组织器官的损伤和不同系统的疾病, 而且缺氧对机体的损伤机制和防护措施的研究在航空航天医学领域亦具有重要意义和实用价值. 近年的研究表明, 转化生长因子β1在脑、心、骨骼、周围神经等器官组织的缺血缺氧损伤和修复中起重要作用, 但关于缺氧条件下肝组织中该因子表达的变化研究较少.
迄今的许多研究表明, TGF-β1在肝硬化与肝癌中与肝损伤有关国外研究较多的当属TGF-β1对细胞外基质的合成及降解的影响. 肝脏受损后刺激单核巨噬细胞因子, 在经内皮细胞活化后, 以旁分泌和自分泌方式作用于贮脂细胞增殖与肌成增殖, 说明TGF-β1与肝纤维化的发生密切相关. 另有研究表明, 由于能够促进细胞外基质合成, TGF-β1在创伤修复中起重要作用.
探讨缺氧对TGF-β1在肝细胞表达的影响, TGF-β1参与大鼠缺氧条件下肝脏细胞的生理与病理过程, 其表达增加可促进细胞外基质的合成, 有利于肝细胞的再生与修复. 本研究结果有可能开辟缺氧状态下保护与治疗肝脏细胞损失的科学理论依据.
本研究内容重要也比较新颖, 缺氧对机体的损伤机制和防护措施的研究在临床医学上与航空航天医学领域亦具有重要意义, 具有科学性和创新性.
电编: 张敏 编辑:潘伯荣
| 1. | Benveniste EN, Kwon J, Chung WJ, Sampson J, Pandya K, Tang LP. Differential modulation of astrocyte cytokine gene expression by TGF-beta. J Immunol. 1994;153:5210-5221. [PubMed] |
| 5. | Lefer AM. Mechanisms of the protective effects of transforming growth factor-beta in reperfusion injury. Biochem Pharmacol. 1991;42:1323-1327. [PubMed] [DOI] |
| 6. | Arteaga CL, Carty-Dugger T, Moses HL, Hurd SD, Pietenpol JA. Transforming growth factor beta 1 can induce estrogen-independent tumorigenicity of human breast cancer cells in athymic mice. Cell Growth Differ. 1993;4:193-201. [PubMed] |
| 7. | Warn RM, Warn A, Planques V, Robert-Nicoud M. Cytokinesis in the early Drosophila embryo. Ann N Y Acad Sci. 1990;582:222-232. [PubMed] [DOI] |
| 8. | Barnard JA, Lyons RM, Moses HL. The cell biology of transforming growth factor beta. Biochim Biophys Acta. 1990;1032:79-87. [PubMed] |
| 10. | Davis BH, Chen A. Transforming growth factor beta and liver regeneration: the stage may be set, but what's the script? Hepatology. 1996;23:1703-1705. [PubMed] [DOI] |
| 11. | Gressner AM, Bachem MG. Molecular mechanisms of liver fibrogenesis-a homage to the role of activat-ed fat-storing cells. Digestion. 1995;56:335-346. [PubMed] [DOI] |
| 13. | 黄 玉波, 魏 红山, 董 庆鸣, 刘 志英, 郭 晶晶, 成 军, 毛 羽. 转化生长因子βl启动子区C-509T位点基因多态性与肝纤维化关系. 世界华人消化杂志. 2006;14:1093-1096. [DOI] |
| 15. | Roth S, Michel K, Gressner AM. (Latent) transform-ing growth factor beta in liver parenchymal cells, its injury-dependent release, and paracrine effects on rat hepatic stellate cells. Hepatology. 1998;27:1003-1012. [PubMed] [DOI] |
| 16. | Weiner JA, Chen A, Davis BH. E-box-binding repressor is down-regulated in hepatic stellate cells during up-regulation of mannose 6-phosphate/insulin-like growth factor-II receptor expression in early hepatic fibrogenesis. J Biol Chem. 1998;273:15913-15919. [PubMed] [DOI] |
| 17. | Wolf G, Ziyadeh FN, Stahl RA. Angiotensin II stimulates expression of transforming growth factor beta receptor type II in cultured mouse proximal tubular cells. J Mol Med. 1999;77:556-564. [PubMed] [DOI] |
| 18. | 许 青, 李 石. 转化生长因子β与肝纤维化. 国外医学·消化系统病分册. 1998;18:158-160. |