修回日期: 2006-09-08
接受日期: 2006-09-21
在线出版日期: 2006-11-28
目的: 探讨髓源性树突状细胞(DC)过继转移诱导1型糖尿病(IDDM)小鼠免疫耐受的作用及其机制.
方法: 体外培养BALB/c小鼠骨髓来源DC, 测定纯度, 经ip小鼠体内. 随后, 采用少量多次链脲佐菌素(STZ)ip的方法建立IDDM小鼠模型. 每周测定血糖, 第4周时处死动物, 分离脾脏淋巴细胞并进行体外培养, MTT法测定小鼠脾淋巴细胞增殖反应, 采用流式细胞术检测CD4+CD25+调节性T细胞. ELISA法测定血清IL-2, IL-4含量.
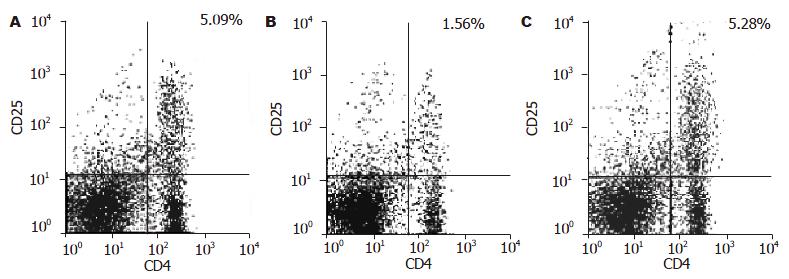
结果: 过继转移表达CD11c+的DC 4 wk后, 小鼠的血糖可明显降低, 与模型对照组有极显著差异(8.32±1.05 mmol/L vs18.36±1.55 mmol/L, P<0.01). 与模型对照相比, 过继转移DC可使小鼠脾淋巴细胞增殖能力降低(0.264±0.019 vs0.489±0.012, P<0.05), 流式细胞术测定结果显示CD4+CD25+T细胞亚群比例上升到5.28%, 而模型对照组仅1.56%. DC过继可有效抑制IL-2分泌(121±19 ng/L vs 195±32 ng/L, P<0.05), 而提高IL-4含量(187±36 ng/L vs 76±30 ng/L, P<0.01).
结论: 过继转移髓源性DC可以诱导免疫耐受防止IDDM的发生, 其机制与促进体内CD4+CD25+T细胞亚群产生, 重建Th1/Th2细胞因子平衡相关.
引文著录: 张程亮, 向明, 邹晓蕾, 彭佳蓓. 髓源性树突状细胞过继转移诱导1型糖尿病小鼠免疫耐受及其机制. 世界华人消化杂志 2006; 14(33): 3175-3179
Revised: September 8, 2006
Accepted: September 21, 2006
Published online: November 28, 2006
AIM: To investigate immune tolerance induced by adoptive transfer of bone marrow-derived dendritic cells (DCs) in mice with type 1 diabetes, and to explore its underlying mechanism.
METHODS: Bone marrow cells from BALB/c mice were used to generate DCs by in vitro co-culturing with cytokines. After identifying the purity of DCs, We injected the cells into BALB/c mice intraperitoneally. The mouse model of type 1 diabetes was established by injecting low dose of streptozotocin (STZ) for 5 consecutive days. The blood glucose was examined once a week. At the end of the 4th week, all the mice were killed and splenic lymphocytes were collected. After in vitro culturing, the proliferation of lymphocytes was detected by MTT assay, and the proportion of CD4+CD25+T cells was analyzed by fluorescence activated cell sorter (FACS). The serum levels of cytokines IL-2 and IL-4 were determined by enzyme-linked immunosorbent assay (ELISA).
RESULTS: The level of blood glucose was decreased significantly after adoptive transfer of DCs in comparison with that in the model controls (8.32 ± 1.05 mmol/L vs 18.36 ± 1.55 mmol/L, P < 0.01). In vitro, the proliferation of splenic lymphocytes was inhibited as compared with that of the model controls (0.264 ± 0.019 vs 0.489 ± 0.012, P < 0.05) while the proportion of CD4+CD25+ T cells was enhanced to 5.28% (1.56% in the model controls). Adoptive transfer of DCs effectively suppressed the secretion of IL-2 (121 ± 19 ng/L vs 195 ± 32 ng/L, P < 0.05) while elevated the content of IL-4 (187 ± 36 ng/L vs 76 ± 30 ng/L, P < 0.01).
CONCLUSION: Adoptive transfer of bone marrow-derived DCs can induce the immune tolerance to type 1 diabetes in mice, and the mechanism may be related with the production of CD4+CD25+ T cells and balance between Th1 and Th2 cytokines.
- Citation: Zhang CL, Xiang M, Zou XL, Peng JB. Immune tolerance and its mechanism induced by adoptive transfer of bone marrow-derived dendritic cells in mice with insulin-dependent diabetes mellitus. Shijie Huaren Xiaohua Zazhi 2006; 14(33): 3175-3179
- URL: https://www.wjgnet.com/1009-3079/full/v14/i33/3175.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i33.3175
树突状细胞(dendritic cells, DCs)是已知机体内最重要的抗原提呈细胞(APC), 在体内可诱导强烈的免疫反应, 同时在自身免疫耐受的维持中也扮有重要角色. 近来的研究显示, 体外培养DCs可作为诱导免疫耐受的工具, 在各种自身免疫性疾病的调节中发挥着重要的作用[1]. 已有报道认为, DCs的过继转移可以减少自身免疫性疾病如实验性自身免疫性脑脊髓炎和胶原诱导的关节炎的发病率[2]. 1型糖尿病(IDDM)是由自身反应性T淋巴细胞介导的器官特异性自身免疫性疾病, 自身免疫耐受的破坏和胰岛β细胞的特异性免疫损伤是其发病的重要环节[3]. 基于DCs的免疫调节特性, Clare-Salzler et al[4]通过分离胰腺淋巴结的DCs过继至未发病的NOD小鼠体内能够延缓糖尿病的发病, 而来自其他淋巴结和脾脏的DCs则无效. 本研究拟通过分离小鼠髓源性DCs, 过继转移至Balb/c小鼠体内观察其诱导免疫耐受的作用.
♂BALB/c小鼠, 平均体质量22 g, 由华中科技大学同济医学院实验动物中心提供. 链脲佐菌素(STZ)、刀豆蛋白ConA购自Sigma公司; Ficoll-Paque细胞分层液购自Amersham公司; MTT购自Amresco公司; RPMI1640培养基购自Gibco公司; FITC标记抗小鼠CD4、PE标记抗小鼠CD25购自eBioscience公司; 小鼠GM-CSF、小鼠IL-2, IL-4酶联免疫检测试剂盒购自R&D system; FITC-标记抗小鼠CD11c购于BD公司. 金鹊牌血糖测定仪(上海新立医疗器械有限公司); MK3酶联免疫检测仪(芬兰Thermo公司); ELX一800型流式细胞仪(美国BD公司).
1.2.1 骨髓来源DCs的体外诱导与纯度鉴定: 无菌条件下取BALB/c小鼠双侧股骨和胫骨, 剪开骨两端, 用注射器抽取PBS缓冲液, 冲洗收集小鼠骨髓细胞混合液. 离心弃上清, 用Ficoll-Paque淋巴细胞分离液 (按与样本体积1:1混合)梯度离心2000 r/min, 15-20 min. 吸取中间白细胞层, PBS液洗2次, 以RPMI1640(含100 mL/L胎牛血清)液制备成细胞悬液,调整细胞浓度为2×1010/L, 置于6 cm培养皿中, 贴壁4 h后去除悬浮细胞, 加入含小鼠GM-CSF(20 μg/L)的完全培养基, 置于37 ℃, 50 mL/L CO2条件下培养, 隔天半量换液, 补加细胞因子. 将培养7 d后收集的小鼠骨髓来源的DCs用PBS洗2遍, 取2×106个细胞悬浮于含50 mL/L胎牛血清的PBS液中, 加入FITC-标记抗小鼠CD11c mAb, 混匀后4 ℃避光放置30 min. 再用PBS洗2遍, 细胞悬浮于0.4 mL PBS中, 用流式细胞仪进行检测.
1.2.2 DCs过继转移及糖尿病发病检测: 24只8 wk龄BALB/c小鼠, 随机分为3组: 空白对照组、模型对照组和DCs过继组, 每组8只. DCs处理组小鼠ip给以上述DCs, 剂量为3×105个/只, 模型组小鼠给以200 μL生理盐水. 按照文献[5]方法, 除空白对照组外, 各组小鼠每日ip 40 mg/kg的链脲佐菌素, 连续5 d, 建立IDDM模型. 各组小鼠每日称质量, 每周测定血糖值, 以血糖值≥16.7 mmol/L诊断为糖尿病. 造模4 wk后, 实验动物摘眼球取血, 分离血清, 采用酶联免疫分析法(ELISA)测定血清中IL-2和IL-4含量, 操作步骤按试剂盒说明进行. 脱颈臼法处死各组小鼠, 无菌取小鼠脾细胞, 制备单个脾细胞悬液. 采用台盼蓝计数后, 将2×106细胞接种于96孔板内, 同时加入总浓度为5 mg/L的ConA, 37 ℃, 50 mL/L CO2孵育72 h后, 每孔加入MTT(5 g/L)溶液20 μL, 继续培养4 h, 加入DMSO 150 μL, 充分振荡后在570 nm的波长下采用酶标仪测定A值. 取上述脾细胞悬液, 调整细胞浓度为1×1010/L, 于200 μL细胞悬液中分别加入FITC标记抗小鼠CD4和PE标记抗小鼠CD25 mAb或相关阴性对照, 4 ℃孵育30 min后, 以PBS离心洗2次, 重新悬于0.4 mL的PBS液后流式细胞仪检测.
统计学处理 所有数据以mean±SD表示, 实验数据以组间t检验处理.
光镜下观察可见, 小鼠骨髓细胞在细胞因子GM-CSF存在的条件下培养从第2天开始可见部分细胞形状不规则且有短的毛刺状突起, 随培养时间的延长, 绝大部分细胞体积增大, 毛刺状突起拉长, 为典型树突状细胞形态特征. 经流式细胞仪测定, 培养7 d的DCs高水平表达相对特异性标志CD11c, 纯度达到86.33%.
BALB/c小鼠经少量多次ip STZ后可建立血糖进行性升高的IDDM模型. 模型建立1 wk后小鼠出现多饮、多尿及体重减轻的典型糖尿病症状. 与正常小鼠小鼠相比, 模型组小鼠血糖值显著升高(P<0.01). DCs过继转移可明显预防糖尿病的发生, 血糖值与模型组相比, 具有极显著性差异(P<0.01, 表1).
小鼠脾淋巴细胞在体外经ConA刺激后增殖, 采用MTT法在570 nm的波长下测定A值, 空白对照组为0.315±0.028. 与模型对照组(0.489±0.012)相比, DCs处理组脾淋巴细胞增殖能力显著降低(0.264±0.019), 差异有显著性(P<0.05).
经流式细胞仪测定, 模型对照组小鼠脾脏CD4+CD25+ T细胞比例仅1.56%, 明显低于正常对照组小鼠的5.09%. 而经DCs处理组CD4+CD25+T细胞比例恢复到5.28%(图1, 其中每图右上象限表示CD4+CD25+ T细胞亚群).
IDDM为器官特异性自身免疫性疾病. 在其发病中有许多免疫细胞参与, 其中自身反应性T淋巴细胞起主要作用. STZ是从无色链霉菌属分离出来的一种广谱抗生素, 具有选择性β细胞毒性. 目前较多采用的是少量多次STZ法, 可诱导类似于人类IDDM的实验动物模型[6-8]. 大量证据表明, 该模型具备T细胞依赖性特征, 自身免疫性细胞因子如IL-2, IFN-γ和TNF等在发病中发挥了重要作用, 从而导致胰岛炎和β细胞的进行性破坏, 引起血糖升高. 目前, 这一模型已被广泛应用于自身免疫性糖尿病的研究. 由于自身免疫反应的增强是IDDM发病中的主要因素, 因此, 重建机体对自身抗原的免疫耐受是1型糖尿病免疫治疗的关键. DCs是机体免疫系统最重要的抗原提呈细胞, 在机体的自身免疫调节中也发挥着相当重要的作用. 最近还发现, DC能调节和诱导调节性T细胞的发育, 从而影响中枢性和外周性免疫耐受, 因此成为近几年免疫学领域研究的热点之一[9-10]. 已有报道认为, DCs的过继转移可以减少自身免疫性疾病如实验性自身免疫性脑脊髓炎和胶原诱导的关节炎的发病率[11]. Yarilinet al[12]的研究也发现, 体外经过处理的DCs过继转移可以有效缓解实验性自身免疫性重症肌无力的症状. 因此, 通过深入研究DCs在自身免疫病中的作用可望使该类疾病的预防和治疗有新的突破. 基于此, 我们体外培养高纯度的髓源性DCs, 过继转移至IDDM小鼠模型内, 观察其对糖尿病小鼠发病的作用, 通过测定调节性T细胞亚群比例和体内细胞因子分泌水平, 探讨其诱导免疫耐受的机制.
按DCs的来源可将其分为髓系来源DCs及淋巴系来源DCs. GM-CSF是髓系DCs前体的分化发育中最根本的细胞因子. 利用GM-CSF, 可在体外从骨髓前体细胞中扩增大量DCs[13]. 由于该方法相对外周血中分离DCs, 具有操作简便, 分离得到细胞数量大等优点, 现已被广泛用于对DCs的各种研究. 本研究通过体外培养髓源性DCs, 采用CD11c作为小鼠DC的相对特异性标志[14], 纯度可达到85%以上. 实验中观察到在髓源性DCs过继转移后, 小鼠并未发生明显的糖尿病, 血糖值显著低于模型对照组(P<0.01), 提示通过体外过继髓源性DCs可以有效防止IDDM的发生. CD4+CD25+T细胞在维持自身免疫耐受中起重要作用[15]. 其功能是通过抑制自身反应性T细胞活化, 从而抑制自身免疫性疾病的发生, 因此属于调节性T细胞, 他所参与的免疫调节是个体维持免疫自稳的重要调节机制之一. 已证实的多种预防和治疗IDDM的途径, 其保护机制与体内不同类型的调节性T细胞相关联[16]. 本研究发现, 糖尿病模型小鼠脾脏CD4+CD25+T细胞仅1.43%, 而正常小鼠为5.09%, 因此调节性T细胞数量的减少可能是IDDM发病中的一个重要机制. 当过继转移髓源性DCs给IDDM小鼠后, 小鼠脾脏CD4+CD25+T细胞可增加到5.28%, 提示DCs过继转移可通过促进体内CD4+CD25+T细胞的产生达到诱导小鼠免疫耐受的目的. IDDM患者外周血单个核细胞及NOD小鼠的脾淋巴细胞, 其增殖率明显高于正常人和正常小鼠[17]. 在STZ所致糖尿病小鼠模型中也观察到相同的结果(P>0.05). 在DCs过继转移诱导耐受的小鼠中, CD4+CD25+调节性T细胞亚群比例的增加, 这类调节性T细胞可以"主动"的方式对自身反应性T细胞进行活化抑制, 因此脾淋巴细胞增殖能力明显下降. 在对血清细胞因子的测定实验中发现, DCs过继可有效降低Th1型细胞因子IL-2的含量, 促进Th2型细胞因子IL-4的分泌. 这一免疫反应的偏离可有效预防小鼠糖尿病的发生. CD4+CD25+T细胞可高表达IL-10和TGF-β等抑制性细胞因子, 诱导CD4+T细胞由Th1型转向Th2型, 从而保护胰岛免受自身反应性免疫攻击. 所以免疫耐受小鼠的这一免疫偏离状态可能与CD4+CD25+T细胞比例的增加密切相关.
总之, 体外培养髓源性DCs过继转移可诱导IDDM模型小鼠免疫耐受的产生, 其机制与促进体内CD4+CD25+调节性T细胞的产生, 纠正体内Th1/Th2型细胞因子失衡状态, 从而防止IDDM的发生有关. 基于DCs过继诱导免疫耐受的策略, 可能成为预防IDDM的一条新思路.
1型糖尿病是器官特异性自身免疫病, 自身耐受的破坏是发病的重要环节. 因此, 重建机体免疫耐受是防治1型糖尿病的关键. 树突状细胞在自身免疫耐受的诱导中扮有重要角色, 近年来利用该细胞的过继转移在防治自身免疫性脑脊髓炎和关节炎中取得了一定成果, 而对于树突状细胞对1型糖尿病的作用有待深入研究.
利用树突状细胞建立免疫耐受而防治自身免疫性疾患是当前的研究热点. 树突状细胞在体内多个组织均有分布, 各种来源的树突状细胞在诱导耐受中所发挥的作用有所不同. 树突状细胞免疫生物学与自身免疫性疾病模型的关系及在防治自身免疫病中的作用正处于广泛而深入的研究之中.
本研究从小鼠骨髓细胞前体诱导树突状细胞, 将其过继转移至STZ诱导的IDDM模型体内, 成功建立了免疫耐受. 目前, 在国内尚无相关报道.
本研究利用髓源性树突状细胞建立免疫耐受防治1型糖尿病, 为树突状细胞在自身免疫性疾患尤其是1型糖尿病中的应用提供了理论基础, 对于1型糖尿病免疫平衡的重建有一定价值.
1 树突状细胞: 已知机体内最重要的专职抗原提呈细胞(APC), 在体内数量较少, 在体内可诱导强烈的免疫反应, 同时在自身免疫耐受的维持中也发挥重要作用.
2 免疫耐受: 指在一定条件下, 机体免疫系统接触某种抗原后所产生的对该抗原的特异性弱应答或无应答状态.
电编: 李琪 编辑:张焕兰
| 1. | Zhu M, Wei MF, Liu F, Shi HF, Wang G. Interleukin-10 modified dendritic cells induce allo-hyporesponsiveness and prolong small intestine allograft survival. World J Gastroenterol. 2003;9:2509-2512. [PubMed] |
| 2. | Huang YM, Yang JS, Xu LY, Link H, Xiao BG. Autoantigen-pulsed dendritic cells induce tolerance to experimental allergic encephalomyelitis (EAE) in Lewis rats. Clin Exp Immunol. 2000;122:437-444. [PubMed] [DOI] |
| 3. | Trucco M. Regeneration of the pancreatic beta cell. J Clin Invest. 2005;115:5-12. [PubMed] [DOI] |
| 4. | Clare-Salzler MJ, Brooks J, Chai A, Van Herle K, Anderson C. Prevention of diabetes in nonobese diabetic mice by dendritic cell transfer. J Clin Invest. 1992;90:741-748. [PubMed] [DOI] |
| 5. | Holstad M, Sandler S. A transcriptional inhibitor of TNF-alpha prevents diabetes induced by multiple low-dose streptozotocin injections in mice. J Autoimmun. 2001;16:441-447. [PubMed] [DOI] |
| 6. | Yang Z, Chen M, Fialkow LB, Ellett JD, Wu R, Nadler JL. The novel anti-inflammatory compound, lisofylline, prevents diabetes in multiple low-dose streptozotocin-treated mice. Pancreas. 2003;26:e99-e104. [PubMed] [DOI] |
| 7. | Mensah-Brown EP, Stosic Grujicic S, Maksimovic D, Jasima A, Shahin A, Lukic ML. Downregulation of apoptosis in the target tissue prevents low-dose streptozotocin-induced autoimmune diabetes. Mol Immunol. 2002;38:941-946. [PubMed] [DOI] |
| 9. | Wakkach A, Fournier N, Brun V, Breittmayer JP, Cottrez F, Groux H. Characterization of dendritic cells that induce tolerance and T regulatory 1 cell differentiation in vivo. Immunity. 2003;18:605-617. [PubMed] [DOI] |
| 10. | Lutz MB, Schuler G. Immature, semi-mature and fully mature dendritic cells: which signals induce tolerance or immunity? Trends Immunol. 2002;23:445-449. [PubMed] [DOI] |
| 11. | Xiao BG, Huang YM, Yang JS, Xu LY, Link H. Bone marrow-derived dendritic cells from experimental allergic encephalomyelitis induce immune tolerance to EAE in Lewis rats. Clin Exp Immunol. 2001;125:300-309. [PubMed] [DOI] |
| 12. | Yarilin D, Duan R, Huang YM, Xiao BG. Dendritic cells exposed in vitro to TGF-beta1 ameliorate experimental autoimmune myasthenia gravis. Clin Exp Immunol. 2002;127:214-219. [PubMed] [DOI] |
| 13. | Cayeux S, Richter G, Becker C, Pezzutto A, Dorken B, Blankenstein T. Direct and indirect T cell priming by dendritic cell vaccines. Eur J Immunol. 1999;29:225-234. [PubMed] [DOI] |
| 14. | Basak SK, Harui A, Stolina M, Sharma S, Mitani K, Dubinett SM, Roth MD. Increased dendritic cell number and function following continuous in vivo infusion of granulocyte macrophage-colony-stimulating factor and interleukin-4. Blood. 2002;99:2869-2879. [PubMed] [DOI] |
| 15. | Kondo Y, Kobayashi K, Ueno Y, Shiina M, Niitsuma H, Kanno N, Kobayashi T, Shimosegawa T. Mechanism of T cell hyporesponsiveness to HBcAg is associated with regulatory T cells in chronic hepatitis B. World J Gastroenterol. 2006;12:4310-4317. [PubMed] [DOI] |
| 16. | Shevach EM. Regulatory T cells in autoimmmunity. Annu Rev Immunol. 2000;18:423-449. [PubMed] [DOI] |
| 17. | Xue M, Thompson PJ, Clifton-Bligh R, Fulcher G, Gallery ED, Jackson C. Leukocyte matrix metalloproteinase-9 is elevated and contributes to lymphocyte activation in type I diabetes. Int J Biochem Cell Biol. 2005;37:2406-2416. [PubMed] [DOI] |