修回日期: 2006-08-04
接受日期: 2006-08-22
在线出版日期: 2006-11-18
近年, 代谢综合征(metabolic syndrome, MS)及其高发病率严重威胁着人类的健康和生命. 代谢综合征病因学的核心是胰岛素抵抗(insulin resistance, IR), 然而, 其相关机制并不是十分清楚, 研究显示血浆中某些炎性因子(如: C反应蛋白、白细胞介素-6、肿瘤坏死因子-α)浓度的升高与IR的发生密切相关, 表明炎性因子在IR过程中具有重要作用. 本文将就这些炎性因子影响胰岛素敏感性的机制加以介绍.
引文著录: 张洁, 王方, 许海燕, 孟雁. 炎性因子与胰岛素抵抗. 世界华人消化杂志 2006; 14(32): 3121-3125
Revised: August 4, 2006
Accepted: August 22, 2006
Published online: November 18, 2006
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2006; 14(32): 3121-3125
- URL: https://www.wjgnet.com/1009-3079/full/v14/i32/3121.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i32.3121
胰岛素抵抗(insulin resistance, IR)是指机体对胰岛素不敏感, 表现为外周组织尤其是肌肉、脂肪组织对葡萄糖利用降低. IR早期, 胰岛β细胞尚能代偿性增加胰岛素分泌以弥补其效应不足, 但久而久之, 胰岛β细胞功能逐步衰退, 导致糖耐量异常和糖尿病发生. 炎症反应是指具有血管系统的活体组织对损伤因子所产生的防御反应. 炎症反应时, 机体分泌大量炎性因子如肿瘤坏死因子-α(tumor necrosis factor alpha, TNF-α)、白细胞介素-6(interleukin-6, IL-6)和C反应蛋白(C-reactive-protein, CRP)来实现对自身的保护. 目前的研究显示, 代谢综合征(metabolic syndrome, MS)人群血浆中炎性因子水平明显升高. 例如, 在高血压、高血脂、动脉粥样硬化、2型糖尿病(type 2 diabetes mellitus)及肥胖患者的血浆中, TNF-α和IL-6水平明显升高[1], 在肥胖模型动物的血浆中TNF-α表达水平也明显升高[2], 这些结果提示炎性因子参与了IR.
目前, 炎症反应与IR发生、发展的关系并不十分清楚, 一般认为: 炎性因子介导细胞内炎症反应的信号传导, 导致胰岛素敏感细胞(如肝细胞、肌肉细胞和脂肪细胞)内的胰岛素受体底物-1(insulin receptor substrates-1, IRS-1)丝氨酸磷酸化, 抑制其酪氨酸磷酸化, 使胰岛素信号传导受阻, 从而诱发IR; 此外, 炎性因子进入脂肪组织, 引起脂质代谢异常(如TNF-α的脂解作用), 从而使外周游离脂肪酸增加导致IR, 而肥胖患者的脂肪组织也可以增加炎性因子的释放, 从而使其他重要代谢性组织(如肝组织和肌肉)的功能受损[3].
TNF-α主要由脂肪组织, 包括脂肪细胞和脂肪基质细胞在内的多种细胞产生[4]. TNF-α引起IR的作用机制目前研究得较为清楚, 大致分为以下几点: (1)抑制胰岛素信号传导: TNF-α可诱导IRS-1丝氨酸磷酸化[5], 降低IRS-1酪氨酸激酶活性, 使IRS-1的表达下调[5-6]; 抑制IRS-1与胰岛素受体结合; 降低葡萄糖转运体4(glucose transporter 4, GLUT4)的含量[5], 从而抑制脂肪细胞摄取葡萄糖, 产生IR. (2)促进脂解作用, 使外周游离脂肪酸增加, 从而抑制肌细胞糖代谢, 促进肝内糖原合成, 间接诱导IR [7]. 在小鼠体内, TNF-α诱导脂解的最主要的机制是其降低抑制性G蛋白(Gi)的水平[8]. (3)作用于其他细胞因子, 如刺激IL-6的生成[9], 抑制脂联素、瘦素[10]和过氧化物增殖因子受体-γ(PPAR-γ)的产生[11], 引起IR. (4)刺激单核细胞趋化蛋白-1(monocyte chemotactic protein-1, MCP-1)的产生, 从而趋化巨噬细胞浸润脂肪组织, 导致炎性因子大量分泌, 引起IR[4]. 将小鼠TNF-α基因敲除或给小鼠注入TNF-α阻断性抗体, 可观察到小鼠体内胰岛素敏感性升高. 然而, 糖尿病患者给予TNF-α抗体注射后, 胰岛素敏感性并没有明显改善[12], 临床角度对此现象的解释为: 人类脂肪细胞不分泌TNF-α进入血液循环[4,13].
TNF-α诱导IRS-1丝氨酸磷酸化, 受另外一个炎性中间物IKK-β(Ikappa B kinase-β)的调控[2,14]. 研究显示, IKK-β纯合基因小鼠经高脂饮食饲喂或脂质注射后, 再给予大剂量的水杨酸盐(糖尿病治疗性药物), 肥胖小鼠体内IKK-β活性被抑制, IR得到改善; 2型糖尿病患者给予大剂量水杨酸盐治疗2 wk后, 患者体内血糖快速降低, 机体对葡萄糖的摄取量显著增多[15].
JNK(c-Jun N-terminal kinases)是另外一个参与诱导IRS-1丝氨酸磷酸化的丝氨酸激酶[2,16], 由炎性因子(如TNF-α)激活, 主要作用是诱导胰岛β细胞凋亡和对胰岛素信号传导的负向调节[17]. 肥胖小鼠或肥胖人群脂肪组织中JNK活性增加[18]; 饮食诱导不能引起JNK基因缺失的小鼠肥胖和IR; 遗传性肥胖小鼠JNK基因突变后变得消瘦, 血浆中葡萄糖和胰岛素的含量降低[17]; 给予糖尿病小鼠和饮食诱导的IR小鼠一种细胞通透性JNK抑制肽, 其糖耐量和IR可得到明显改善[18]. 目前, JNK引发IR的机制还并不十分清楚, 用腺病毒诱导JNK在肝细胞内过量表达或抑制, 证实JNK的活性与IRS-1丝氨酸磷酸化有关[19], 另有实验证实肥胖导致内质网应激是诱导JNK活化、炎症反应和IR起始的基础[20]. 这些研究使JNK有希望成为一种联系炎症和IR的有效的药物靶点[17].
IL-6由脂肪细胞、脂肪基质细胞和胰岛β细胞产生[21], 其中脂肪细胞是外周IL-6的主要来源, 全身30%的IL-6来源于脂肪组织[22], 高血糖可促进胰岛β细胞分泌IL-6. 在炎症反应早期, 少量IL-6促进胰岛素产生, 导致高胰岛素血症; 在炎症反应晚期, IL-6抑制胰岛素产生, 从而促进糖尿病的发生和发展[23]. IL-6通过以下机制诱导IR: (1)IL-6诱导IRS-1丝氨酸磷酸化, 抑制其酪氨酸磷酸化[22,24], 使胰岛素信号传导受阻, 导致IR. (2)IL-6抑制脂联素表达(脂联素能提高胰岛素敏感性), 降低胰岛素敏感性, 导致IR[4]. (3) IL-6受体与瘦素受体有共同的细胞信号传导通路, IL-6和瘦素具有竞争性抑制作用, IL-6增多可导致瘦素抵抗, 导致IR[4]. (4)IL-6促进脂解作用使外周游离脂肪酸增加, 从而抑制肌细胞糖代谢, 促进肝内糖原合成, 间接诱导IR. (5)最近发现, 在3T3-L1脂肪细胞、小鼠肝细胞和人HepG2细胞中, IL-6抑制GLUT4和磷脂酰肌醇-3激酶(phosphatidylinositol-3 kinase, PI-3K)的活性, 进而抑制胰岛素信号传导, 导致IR[23].
IL-6水平的升高是2型糖尿病发病的独立危险因素[25]. 注射IL-6可诱发患者全身性脂解并抑制糖代谢[26-27]. 然而, IL-6基因敲除小鼠可产生肥胖和IR的表型[28], 这两种相反结果的发生机制有待进一步研究和探讨.
CRP是由肝脏产生、分泌的重要防御分子, 是全身炎症反应的敏感性标志物, 其表达受某些炎性因子调控, 如IL-6和TNF-α作为极强的促炎因子, 可刺激肝脏合成CRP. CRP主要通过以下机制参与IR的发生发展: (1)CRP介导促炎因子IL-1, IL-6的产生, 从而引起IR; (2)CRP促进TNF-α释放, 从而抑制胰岛素信号传导, 导致IR. CRP水平的升高与体重指数(body mass index, BMI)增加、血浆脂质含量升高、血浆葡萄糖含量升高、高胰岛素血症和IR密切相关, 并与临床2型糖尿病高风险患病有关[25,29-30].
IR患者血浆中CRP水平明显升高, 随着胰岛素敏感性的改善, 血浆CRP水平降低. CRP作为非特异性炎症反应标记物, 其水平可预测心血管事件发生的危险性[25]. 一项对美国健康中年女性进行为期4年的跟踪调查显示, CRP水平升高使2型糖尿病的发病风险增加了4倍[4,30].
MCP-1是介导巨噬细胞激活和趋化的重要介质, 可诱导巨噬细胞由外周血液循环进入脂肪组织并使其激活. 巨噬细胞一旦被激活, 可分泌多种炎性因子, 如IL-6, TNF-α等, 这些炎性因子均可抑制脂肪细胞的胰岛素信号传导, 还可进一步刺激巨噬细胞分泌大量炎性因子, 最终引起脂肪细胞广泛降解, 释放大量游离脂肪酸, 导致IR. 高脂饮食饲喂的肥胖小鼠白色脂肪组织中MCP-1的表达有2次升高, 一次是喂饲高脂饮食后第3周, 另一次是与IR同时出现, 表明MCP-1通过引起小鼠白色脂肪组织中巨噬细胞的浸润诱发IR[4].
NF-κB普遍存在于细胞质, 与抑制性蛋白IκB结合处于非活性状态, 他可被IL-6, TNF-α和CRP激活. NF-κB通过介导一氧化氮的合成及促进TNF-α和IL-6的产生来加重炎症反应, 使炎症反应持续扩大, 导致IR[31].
肥胖主要的病理生理改变是脂肪细胞数目增多、脂肪细胞体积增大以及脂肪组织内大量巨噬细胞浸润[34]. 人类和小鼠肥胖个体的脂肪组织处于慢性炎症状态[35-36]. 肥胖可增加脂肪组织中巨噬细胞的浸润和炎性因子基因的大量表达. 反之, 减重后, 皮下脂肪组织炎性因子基因表达恢复正常[35]; 超重和肥胖患者血清中TNF-α、可溶性TNF受体P55(sTNF-RⅠ)和血清可溶性TNF受体P75(sTNF-RⅡ)的含量较健康人高; IL-6与BMI呈正相关, 在肥胖患者的血浆中, IL-6水平升高, 随着体重减轻IL-6水平下降[37]. 另外, 高热量饮食可加重炎症反应, 使血浆胰岛素水平明显升高, 而限制饮食则能减轻炎症反应[36].
肥胖引起IR的机制主要与脂肪细胞来源的炎性因子和炎症信号传导通路的激活有关[4]. 脂肪组织是炎性介质的主要来源, 脂肪细胞数量增多和脂肪细胞体积增大, 可刺激脂肪组织分泌CRP, TNF-α和IL-6等炎性因子, 浸润的巨噬细胞作为炎性细胞分泌大量的炎性因子参与IR[34]. 另外, 脂肪细胞与巨噬细胞表达炎性因子的基因有许多相似之处, 实验证实脂肪细胞和前脂肪细胞可转化为巨噬细胞[35,38]. 这些结果显示, 肥胖在IR发生、发展中具有重要的作用.
除上述炎性因子以外, 发现炎症反应同时还释放炎性抑制因子, 可抑制IR. 目前发现的炎性抑制因子主要有: 可溶性肿瘤坏死因子受体(sTNFR)、IL-1受体拮抗物(IL-1ra)、IL-10、IL-4、IL -11、IL -13、转化生长因子-β(TGF-β)和克隆刺激因子(CSF)等. 这些炎性抑制因子参与调节炎性因子的释放并调节促炎因子与抗炎因子的平衡, 对炎症反应的程度起决定作用.
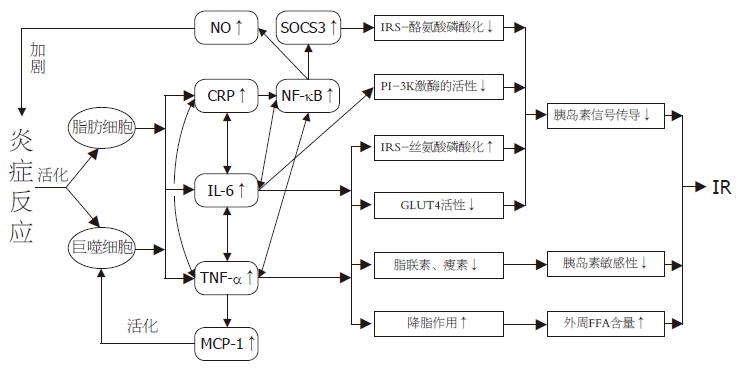
总之, IR伴随着血浆中多种炎性标志物和促炎因子含量的升高, 如TNF-α, IL-6, CRP, NF-κB和MCP-1等, 而这些炎性因子又分别以不同的途径单独或协同作用诱导IR. 图1为炎症诱导IR分子机制. 炎症反应活化脂肪细胞和巨噬细胞, 从而激活炎性因子CRP, TNF-α和IL-6; CRP, TNF-α和IL-6又有相互协同的作用; 三者可分别激活NF-κB, 促使NO合成加剧炎症反应; TNF-α刺激MCP-1产生, 从而激活和趋化巨噬细胞; 最终, 炎性因子使胰岛素信号传导受阻和胰岛素敏感性降低, 并通过脂解作用使外周游离脂肪酸升高等途径导致IR的发生. 因此, 在分子和基因水平上研究炎症引起IR的机制, 有助于我们深入了解IR的发生过程和病理生理学基础, 并为临床上预防、诊断和治疗与IR相关的疾病提供有效的方法和手段.
代谢综合症病因学的核心是胰岛素抵抗, 目前对此领域的相关研究进行的较为深入, 然而, 其相关机制并不是十分清楚.
与同类文章相比, 本文更为全面的总结和概括了胰岛素抵抗的炎性机制, 具有较好的参考意义.
在分子和基因水平上研究炎症引起胰岛素抵抗的机制, 有助于我们深入了解胰岛素抵抗的发生过程和病理生理学基础, 并为临床上预防、诊断和治疗与胰岛素抵抗相关的疾病提供有效的方法和手段.
胰岛素抵抗(IR): 指机体对胰岛素不敏感, 表现为外周组织尤其是肌肉、脂肪组织对葡萄糖利用降低.
文章综述了炎症诱发胰岛素抵的作用机制, 详细描述了炎性因子在胰岛素抵抗发生、发展过程中的作用机理, 对胰岛素抵抗相关研究具有一定的指导意义.
编辑: 张焕兰 电编:张焕兰
| 2. | Savage DB, Petersen KF, Shulman GI. Mechanisms of insulin resistance in humans and possible links with inflammation. Hypertension. 2005;45:828-833. [PubMed] |
| 3. | Hotamisligil GS. Inflammatory pathways and insulin action. Int J Obes Relat Metab Disord. 2003;27 Suppl 3:S53-S55. [PubMed] |
| 4. | Arner P. Insulin resistance in type 2 diabetes -- role of the adipokines. Curr Mol Med. 2005;5:333-339. [PubMed] |
| 5. | Stephens JM, Lee J, Pilch PF. Tumor necrosis factor-alpha-induced insulin resistance in 3T3-L1 adipocytes is accompanied by a loss of insulin receptor substrate-1 and GLUT4 expression without a loss of insulin receptor-mediated signal transduction. J Biol Chem. 1997;272:971-976. [PubMed] |
| 6. | Hotamisligil GS, Peraldi P, Budavari A, Ellis R, White MF, Spiegelman BM. IRS-1-mediated inhibition of insulin receptor tyrosine kinase activity in TNF-alpha- and obesity-induced insulin resistance. Science. 1996;271:665-668. [PubMed] |
| 7. | Arner P. The adipocyte in insulin resistance: key molecules and the impact of the thiazolidinediones. Trends Endocrinol Metab. 2003;14:137-145. [PubMed] |
| 8. | Gasic S, Tian B, Green A. Tumor necrosis factor alpha stimulates lipolysis in adipocytes by decreasing Gi protein concentrations. J Biol Chem. 1999;274:6770-6775. [PubMed] |
| 9. | Fasshauer M, Klein J, Lossner U, Paschke R. Interleukin (IL)-6 mRNA expression is stimulated by insulin, isoproterenol, tumour necrosis factor alpha, growth hormone, and IL-6 in 3T3-L1 adipocytes. Horm Metab Res. 2003;35:147-152. [PubMed] |
| 10. | Kappes A, Loffler G. Influences of ionomycin, dibutyryl-cycloAMP and tumour necrosis factor-alpha on intracellular amount and secretion of apM1 in differentiating primary human preadipocytes. Horm Metab Res. 2000;32:548-554. [PubMed] |
| 11. | Ruan H, Lodish HF. Insulin resistance in adipose tissue: direct and indirect effects of tumor necrosis factor-alpha. Cytokine Growth Factor Rev. 2003;14:447-455. [PubMed] |
| 12. | Ofei F, Hurel S, Newkirk J, Sopwith M, Taylor R. Effects of an engineered human anti-TNF-alpha antibody (CDP571) on insulin sensitivity and glycemic control in patients with NIDDM. Diabetes. 1996;45:881-885. [PubMed] |
| 13. | Mohamed-Ali V, Goodrick S, Rawesh A, Katz DR, Miles JM, Yudkin JS, Klein S, Coppack SW. Subcutaneous adipose tissue releases interleukin-6, but not tumor necrosis factor-alpha, in vivo. J Clin Endocrinol Metab. 1997;82:4196-4200. [PubMed] |
| 14. | Uysal KT, Wiesbrock SM, Marino MW, Hotamisligil GS. Protection from obesity-induced insulin resistance in mice lacking TNF-alpha function. Nature. 1997;389:610-614. [PubMed] |
| 15. | Hundal RS, Petersen KF, Mayerson AB, Randhawa PS, Inzucchi S, Shoelson SE, Shulman GI. Mechanism by which high-dose aspirin improves glucose metabolism in type 2 diabetes. J Clin Invest. 2002;109:1321-1326. [PubMed] |
| 16. | Hirosumi J, Tuncman G, Chang L, Gorgun CZ, Uysal KT, Maeda K, Karin M, Hotamisligil GS. A central role for JNK in obesity and insulin resistance. Nature. 2002;420:333-336. [PubMed] |
| 17. | Liu G, Rondinone CM. JNK: bridging the insulin signaling and inflammatory pathway. Curr Opin Investig Drugs. 2005;6:979-987. [PubMed] |
| 18. | Kaneto H, Nakatani Y, Miyatsuka T, Kawamori D, Matsuoka TA, Matsuhisa M, Kajimoto Y, Ichijo H, Yamasaki Y, Hori M. Possible novel therapy for diabetes with cell-permeable JNK-inhibitory peptide. Nat Med. 2004;10:1128-1132. [PubMed] |
| 19. | Nakatani Y, Kaneto H, Kawamori D, Hatazaki M, Miyatsuka T, Matsuoka TA, Kajimoto Y, Matsuhisa M, Yamasaki Y, Hori M. Modulation of the JNK pathway in liver affects insulin resistance status. J Biol Chem. 2004;279:45803-45809. [PubMed] |
| 20. | Hotamisligil GS. Role of endoplasmic reticulum stress and c-Jun NH2-terminal kinase pathways in inflammation and origin of obesity and diabetes. Diabetes. 2005;54 Suppl 2:S73-S78. [PubMed] |
| 21. | Fried SK, Bunkin DA, Greenberg AS. Omental and subcutaneous adipose tissues of obese subjects release interleukin-6: depot difference and regulation by glucocorticoid. J Clin Endocrinol Metab. 1998;83:847-850. [PubMed] |
| 22. | Path G, Bornstein SR, Gurniak M, Chrousos GP, Scherbaum WA, Hauner H. Human breast adipocytes express interleukin-6 (IL-6) and its receptor system: increased IL-6 production by beta-adrenergic activation and effects of IL-6 on adipocyte function. J Clin Endocrinol Metab. 2001;86:2281-2288. [PubMed] |
| 23. | Rotter V, Nagaev I, Smith U. Interleukin-6 (IL-6) induces insulin resistance in 3T3-L1 adipocytes and is, like IL-8 and tumor necrosis factor-alpha, overexpressed in human fat cells from insulin-resistant subjects. J Biol Chem. 2003;278:45777-45784. [PubMed] |
| 24. | Senn JJ, Klover PJ, Nowak IA, Mooney RA. Interleukin-6 induces cellular insulin resistance in hepatocytes. Diabetes. 2002;51:3391-3399. [PubMed] |
| 25. | Pradhan AD, Manson JE, Rifai N, Buring JE, Ridker PM. C-reactive protein, interleukin 6, and risk of developing type 2 diabetes mellitus. JAMA. 2001;286:327-334. [PubMed] |
| 26. | Petersen EW, Carey AL, Sacchetti M, Steinberg GR, Macaulay SL, Febbraio MA, Pedersen BK. Acute IL-6 treatment increases fatty acid turnover in elderly humans in vivo and in tissue culture in vitro. Am J Physiol Endocrinol Metab. 2005;288:E155-E162. [PubMed] |
| 27. | Tsigos C, Papanicolaou DA, Kyrou I, Defensor R, Mitsiadis CS, Chrousos GP. Dose-dependent effects of recombinant human interleukin-6 on glucose regulation. J Clin Endocrinol Metab. 1997;82:4167-4170. [PubMed] |
| 28. | Wallenius V, Wallenius K, Ahren B, Rudling M, Carlsten H, Dickson SL, Ohlsson C, Jansson JO. Interleukin-6-deficient mice develop mature-onset obesity. Nat Med. 2002;8:75-79. [PubMed] |
| 29. | Festa A, D'Agostino R Jr, Howard G, Mykkanen L, Tracy RP, Haffner SM. Chronic subclinical inflammation as part of the insulin resistance syndrome: the Insulin Resistance Atherosclerosis Study (IRAS). Circulation. 2000;102:42-47. [PubMed] |
| 30. | Pradhan AD, Ridker PM. Do atherosclerosis and type 2 diabetes share a common inflammatory basis? Eur Heart J. 2002;23:831-834. [PubMed] |
| 31. | Dandona P, Aljada A, Bandyopadhyay A. Inflammation: the link between insulin resistance, obesity and diabetes. Trends Immunol. 2004;25:4-7. [PubMed] |
| 32. | Ueki K, Kondo T, Kahn CR. Suppressor of cytokine signaling 1 (SOCS-1) and SOCS-3 cause insulin resistance through inhibition of tyrosine phosphorylation of insulin receptor substrate proteins by discrete mechanisms. Mol Cell Biol. 2004;24:5434-5446. [PubMed] |
| 33. | Shi H, Tzameli I, Bjorbaek C, Flier JS. Suppressor of cytokine signaling 3 is a physiological regulator of adipocyte insulin signaling. J Biol Chem. 2004;279:34733-34740. [PubMed] |
| 34. | Wellen KE, Hotamisligil GS. Obesity-induced inflammatory changes in adipose tissue. J Clin Invest. 2003;112:1785-1788. [PubMed] |
| 35. | Weisberg SP, McCann D, Desai M, Rosenbaum M, Leibel RL, Ferrante AW Jr. Obesity is associated with macrophage accumulation in adipose tissue. J Clin Invest. 2003;112:1796-1808. [PubMed] |
| 36. | Clement K, Viguerie N, Poitou C, Carette C, Pelloux V, Curat CA, Sicard A, Rome S, Benis A, Zucker JD. Weight loss regulates inflammation-related genes in white adipose tissue of obese subjects. FASEB J. 2004;18:1657-1669. [PubMed] |
| 37. | Bruun JM, Verdich C, Toubro S, Astrup A, Richelsen B. Association between measures of insulin sensitivity and circulating levels of interleukin-8, interleukin-6 and tumor necrosis factor-alpha. Effect of weight loss in obese men. Eur J Endocrinol. 2003;148:535-542. [PubMed] |
| 38. | Xu H, Barnes GT, Yang Q, Tan G, Yang D, Chou CJ, Sole J, Nichols A, Ross JS, Tartaglia LA. Chronic inflammation in fat plays a crucial role in the development of obesity-related insulin resistance. J Clin Invest. 2003;112:1821-1830. [PubMed] |