修回日期: 2006-08-22
接受日期: 2006-09-01
在线出版日期: 2006-11-18
目的: 探讨肠道感染对IBS患者结肠黏膜SP, IL-2, IFN-g表达的影响.
方法: 77例IBS患者(PI-IBS组26例, 非PI-IBS组51例)及30例对照者, 结肠镜下活检降结肠和直肠黏膜标本, 采用免疫组化检测其肠黏膜SP与IL-2, IFN-g的表达情况.
结果: PI-IBS患者结肠黏膜SP的表达高于非PI-IBS患者(t = 2.321, 2.452, 2.414, 2.520, P<0.05)和对照组(t = 3.623, 3.722, 3.454, 3.561, P<0.01); PI-IBS患者结肠黏膜IFN-g和IL-2阳性率表达高于非PI-IBS患者(χ2 = 10.010, 9.892, 9.984, 10.152, P<0.05)和对照组(χ2 = 13.781, 13.890, 14.012, 13.931, P<0.01); IFN-g和IL-2阳性表达的PI-IBS患者结肠黏膜SP表达高于非PI-IBS患者(t = 2.182, 2.230, 2.194, 2.174, P<0.05)和对照组(t = 2.202, 2.220, 2.301, 2.252, P<0.05). 非PI-IBS患者结肠黏膜IFN-g和IL-2阳性SP的表达者与对照组比较无明显差异.
结论: 感染可能通过肠黏膜神经-免疫/炎症系统的改变参与了IBS的发病.
引文著录: 鞠辉, 张小芳, 刘希双, 魏良洲. 感染后与非感染后IBS患者结肠黏膜SP与IL-2、IFN-γ表达的相关性. 世界华人消化杂志 2006; 14(32): 3116-3120
Revised: August 22, 2006
Accepted: September 1, 2006
Published online: November 18, 2006
AIM: To investigate relationship between substance P (SP) activity and expression of interleukin-2 (IL-2) and interferon-g (IFN-γ) in colonic mucosa from patients with post-infectious irritable bowel syndrome (PI-IBS).
METHODS: Mucosal biopsy samples were obtained by colonoscopy from the descending colon and rectum of 77 patients (n = 21 and 52, for PI-IBS and non- PI-IBS, respectively) and 30 controls. The expression of SP, IL-2, and IFN-γ were determined by immunohistochemistry.
RESULTS: The expressions of SP was significantly higher in the descending colon and rectum mucosa from PI-IBS patients than that from non-PI-IBS patients (t = 2.321, 2.452, 2.414, 2.520, P < 0.05) and controls (t = 3.623, 3.722, 3.454, 3.561, P < 0.01). The positive rates of IL-2 and IFN-g were also markedly higher in PI-IBS patients than those in the controls (χ2 = 13.781, 13.890, 14.012, 13.931, P < 0.01) and non-PI-IBS patients (χ2 = 10.010, 9.892, 9.984, 10.152, P < 0.05). The expression of SP in PI-IBS patients with positive IL-2 and IFN-g was significantly increased as compared with the controls (t = 2.202, 2.220, 2.301, 2.252, P < 0.05) and non-PI-IBS patients (t = 2.182, 2.230, 2.194, 2.174, P < 0.05). There were no significant differences between the controls and non-PI-IBS patients.
CONCLUSION: Gastrointestinal infection may take part in the pathogenesis of IBS through neuroimmune mechanism.
- Citation: Ju H, Zhang XF, Liu XS, Wei LZ. Correlations of substance P with interleukin-2 and interferon-γ expression in colonic mucosa of patients with post- and non-post-infectious irritable bowel syndrome. Shijie Huaren Xiaohua Zazhi 2006; 14(32): 3116-3120
- URL: https://www.wjgnet.com/1009-3079/full/v14/i32/3116.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i32.3116
肠道急性感染后, 肠功能紊乱的发生率增高, 并伴随肠黏膜某些免疫细胞(如肥大细胞)的增多以及一些炎性介质表达的增高, 感染可能是肠易激综合征(irritable bowel syndrome, IBS)的致病因素之一[1-2]. 临床研究发现约1/3 IBS患者在其患病前曾有急性胃肠道感染史; 部分被肠道病毒、细菌或寄生虫感染的患者, 在病原体已清除及黏膜炎症消退后, 可发生IBS样的症状, 称之为感染后肠易激综合征(post-infective irritable bowel syndrome, PI-IBS)[3-4]. P物质(substance P, SP)为肠道黏膜外周末梢神经, 可能诱导腹泻和腹痛的发生[5-6]; 还可以通过与其受体结合可调节炎性细胞因子的释放和合成, 以促进Th1细胞因子表达上调为主[7-8]. IL-2与IFN-γ是主要的Th1细胞因子, 在Th1型反应中起重要作用[9], 可能促进肠蠕动增加, 出现IBS样症状[10]. 本研究采用免疫组化检测IBS患者肠黏膜SP, IL-2和IFN-γ的表达, 分析感染在IBS发病机制中对SP与Th1细胞因子表达的影响.
2004-09/2005-07青岛大学医学院附属医院消化内科门诊IBS患者77例, 男29例, 女48例, 平均年龄40.6±11.5岁, 均符合IBS罗马Ⅱ诊断标准[11]. PI-IBS者26例, 男9例, 女17例, 平均年龄39.9±10.6岁; 非PI-IBS者51例, 男20例, 女31例, 平均年龄41.9±12.0岁, 男12例, 女20例. PI-IBS纳入标准: (1)罗马Ⅱ诊断标准; (2)出现IBS症状前至少1 d有胃肠道急性感染病史, 且治疗未超过5 d而治愈, 没有复发者. 排除标准: (1)有肠道器质性疾病及手术史者; (2)有全身其他系统器质性疾病者; (3)孕妇和哺乳期妇女. 设对照组30例, 男性12例, 女性18例, 平均年龄38.45±10.90岁, 纳入标准: 为结肠息肉电切除术后复查无异常发现者(术后至少半年)或因大便带少量鲜血行结肠镜检查诊断为痔疮者, 无其他消化道症状与体征, 无免疫疾病、感染病史, 无近期服药史. 兔抗人IL-2抗体、兔抗人IFN-γ抗体及SABC试剂盒均购自武汉博士德生物工程公司, 抗人P物质多克隆抗体(ZA-0235北京中杉金桥生物技术有限公司提供).
分别取降结肠、直肠黏膜各2块, 40 g/L甲醛固定, 石蜡包埋, 所有蜡块均行4 μm连续切片, 每例每部位各取一张切片HE染色, 进行常规病理组织学诊断. 切片常规脱蜡, 梯度乙醇水洗, 氧水室温孵育10 min, 放入pH = 7的枸橼酸钾缓冲液中5 min, 后进行微波修复10 min, PBS缓冲液冲洗15 min, 去除PBS, 滴加兔抗人P物质多克隆抗体(兔抗人IL-2抗体、兔抗人IFN-γ抗体), PBS缓冲液冲洗15 min, 滴加通用型IgG抗体(Fab段)-HRP多聚体, 37 ℃孵育20 min, PBS缓冲液冲洗5 min×3次, 去掉PBS, 滴加新鲜配置的DAB显色剂. 采用双盲法判断结果, 每张切片选择有代表性的区域, 并避开切片周边区域. 对IFN-γ, IL-2染色的判断, 根据阳性细胞百分数和染色强度进行分级[12], 阳性细胞0%-5%, 计0分; 6%-25%, 计1分; 26%-50%, 计2分; 51%-75%, 计3分; >75%, 计4分. 同时根据胞质着色程度计分:未染色0分; 淡黄色1分; 棕黄色2分; 棕褐色3分. 两组计分相加, 0-1分为阴性; 2-3分为弱阳性; 4-5分为阳性; 6-7分为强阳性. 对SP行定量分析用VIDAS图像分析系统, 检测其吸光度A值.
统计学处理 采用SPSS 10.0统计软件包进行处理, 应用方差分析和t检验.
IBS患者77例与对照者在内镜下结肠黏膜均未见明显充血、水肿、渗出等炎症改变. IBS患者降结肠、直肠黏膜均经HE染色, 显微镜下观察见黏膜上皮完整, 黏膜下及固有腺之间可见少量淋巴细胞及浆细胞浸润, 个别可见少量中性粒细胞浸润, 各组间及与对照组相比, 差异无显著性.
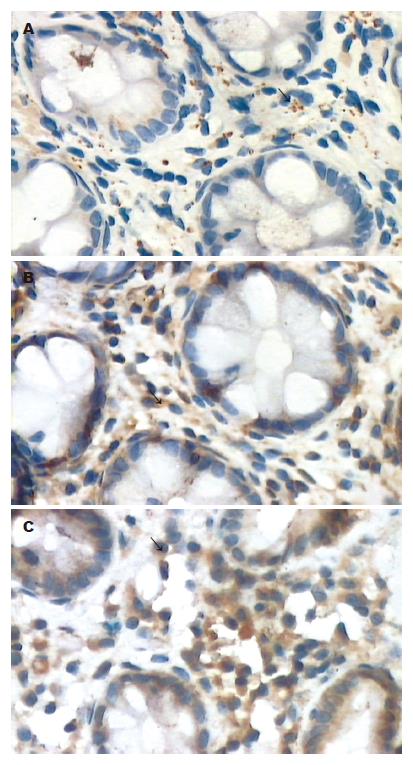
IFN-γ, IL-2的表达在降结肠、直肠黏膜固有膜, 呈现棕黄色, 分布于腺体周围(图1B-C). PI-IBS患者降结肠、直肠的IFN-γ, IL-2阳性表达高于对照组(χ2 = 13.781, 13.890, 14.012, 13.931, P<0.01)、非PI-IBS组(χ2 = 10.010, 9.892, 9.984, 10.152, P<0.05); 非PI-IBS患者降结肠、直肠的IFN-γ, IL-2的阳性表达与对照组比较(χ2 = 2.280, 2.322, 2.190, 2.352, P>0.05), 差异无统计学意义(表1).
SP分布于腺体周围的固有层中, 呈散在点状或簇状分布(图1A). PI-IBS患者降结肠、直肠黏膜SP表达高于对照组(t = 3.623, 3.722, 3.454, 3.561, P<0.01)、非PI-IBS组(t = 2.321, 2.452, 2.414, 2.520, P<0.05); 非PI-IBS患者降结肠、直肠黏膜SP表达高于对照组(t = 2.152, 2.161, 2.157, 2.189, P<0.05, 表2). 降结肠、直肠黏膜IFN-γ, IL-2阳性表达的PI-IBS患者, SP阳性表达高于非PI-IBS组(t = 2.182, 2.230, 2.194, 2.174, P<0.05)和对照组(t = 2.202, 2.220, 2.301, 2.252, P<0.05). 降结肠、直肠黏膜IFN-γ, IL-2阳性表达的非PI-IBS患者与对照组比较, SP表达增加, 但是无显著性差异(表3).
IBS的病因和发病机制迄今还不完全清楚. 目前认为其病因与精神心理因素、胃肠动力异常、内脏感觉过敏、脑-肠轴的改变和炎症免疫等有关. 神经-炎症/免疫学说是新近提出的观点之一. SP是在脑和肠道中均存在的肽, 在肠道内主要存在于肠神经系统的内源性神经元. 我们的实验表明PI-IBS、非PI-IBS患者结肠黏膜SP均值和面积表达高于对照组, PI-IBS患者结肠黏膜SP比非PI-IBS患者表达增多, 与李兆申et al[13]的研究结果相似. SP是一种主要的促炎症性感觉性神经肽, 腹泻型IBS患者血浆中SP水平升高, SP可能以循环激素的方式作用于乙状结肠平滑肌, 使运动增强而致腹泻[14]. 肠道发生感染后, 炎症可致使SP表达增加[15]. SP表达增加后通过与非胆碱能的传递促进肠道的蠕动; 通过特异性受体活化内皮细胞钙离子依赖性NO合酶, 促进NO合成, 增加血管通透性; 刺激黏膜下分泌运动神经以增加黏膜离子的转运[5], 从而发生腹泻. SP表达的增加还可以通过刺激胆碱能神经和依赖NO的抑制性神经系统, 引起肠道压力的升高[6], 诱发痛觉过敏的发生. 王巍峰et al[16]报道SP在中枢及肠道可能参与C-IBS的病理生理过程, 而且SP能神经通路可能是参与肠道感觉或运动功能调节的神经传导通路之一. 我们的实验发现, PI-IBS患者降结肠、直肠黏膜的IL-2, IFN-γ表达比对照组增加, 与李延青 et al[12]的研究结果相似. 通过检测IBS患者外周血T淋巴细胞亚群水平的变化, 发现IBS患者存在T淋巴细胞功能减弱和调节紊乱, 细胞免疫异常可能参与IBS的发病[17]. IBS患者存在Th1/Th2细胞因子的漂移[12], 而且IBS发生与炎症有密切联系[18]. PI-IBS患者肠黏膜IFN-γ, IL-2表达增加, 二者可以促进血管通透性增加; 促使组织胺、花生四烯酸代谢产物(PGD2, LTC4, LTD4, TXE4)、血小板活化因子(PAF)表达增多, 使平滑肌收缩增强, 肠道蠕动增加[10], 导致腹泻; 还可以介导局限于黏膜的轻微炎症反应, 干扰胃肠反射, 活化内脏感觉系统, 出现腹痛和直肠敏感性增加.
PI-IBS和非PI-IBS患者降结肠、直肠黏膜IFN-γ和IL-2阳性表达的SP的表达增加, PI-IBS增加更著. PI-IBS患者肠黏膜IFN-γ, IL-2阳性表达的SP表达高于对照组和非PI-IBS组, 而非PI-IBS患者肠黏膜IFN-γ, IL-2阳性表达的SP表达与对照组比较有增加趋势, 无统计学差异. PI-IBS患者肠黏膜IFN-γ, IL-2的表达与SP表达有关, 这可能是黏膜免疫系统和传入神经末梢之间交互作用. 感染可能促使SP表达增加, SP与炎症细胞表面的SP受体结合, 促进炎症因子的释放. SP与Th1细胞膜表面的SP受体(主要是neurokinin-1, NK-1)结合, 促使Th1细胞释放IFN-γ, IL-2, IL-12等因子, 诱发Th1反应, 激活免疫细胞如T细胞、NK细胞等, 促进炎症因子的释放如IL-1β, TNF-α, 前列腺素E2等, 破坏肠黏膜上皮屏障功能. Th1反应增强还可能导致机体打破对肠道常住细菌的耐受状态, 使抗原微生物免疫和异物排斥反应增强. 感染的持续时间与IBS的发生风险有关, 感染持续2 wk或以上者发生IBS的OR值明显高于1 wk者, 且回肠末端和直肠乙状结肠的IL-1βmRNA表达也明显增加[2].
在培养的细胞系中, 加入SP就可以使IL-2 mRNA的表达增加, 若加入SP拮抗剂后, 则抑制其表达[7], 研究已证实了SP具有上调某些细胞因子表达的作用[8]. 我们认为感染可引起的肠内免疫细胞数量或活性增加, 通过神经免疫机制, 产生持续的异常的黏膜免疫, 引发大量细胞因子的释放, 造成不同功能的细胞因子失去平衡, 从而产生相应的病理生理改变. SP可能只是调节细胞因子表达或释放的介质之一. 大量炎症因子释放作用于肠道神经元和平滑肌细胞, 导致肠黏膜化学感受器和机械感受器对各种刺激敏感性增加.
曾患痢疾/肠炎者1-2年内发展为IBS者占痢疾患者的10.2%, 较同期未患肠道感染对照组IBS的发病率(0.8%)明显为高[19]. 肠道感染对肠黏膜屏障、传入神经及免疫功能的影响, 最终导致肠道分泌功能、运动功能及内脏感知的改变. 急性胃肠炎后持续存在的低度炎症可破坏肠黏膜上皮屏障功能, 增加其通透性, 引起水钠吸收障碍而产生腹泻; 同时也引起抗原的过度暴露以及刷状缘的缺失, 从而激活肠黏膜免疫系统, 引起包括肥大细胞、淋巴细胞、内分泌细胞在内的各种炎症及免疫细胞增加, 释放多种细胞因子, 使炎症介质表达增加[20]. 局限于黏膜的轻微炎症反应即可干扰胃肠反射, 活化内脏感觉系统. 炎症还可引起包括前列腺素、缓激肽、神经生长因子、腺苷增加, 张晓敏et al[21]报道D-IBS患者存在5-HT基因多态性, 这些介质或直接作用于初级传入纤维或间接经由肥大细胞, 启动活化和致敏机制的级联效应, 使附近的伤害性感受器(外周传入纤维末梢)产生继发性的过敏[12]. Wang et al[1]通过对295例细菌性痢疾患者进行的队列研究发现, SP、神经特异性烯醇酶(NSE)和5羟色胺(5-HT)促进了PI-IBS患者肠黏膜IL-1α, IL-1β的表达, 提出细菌性痢疾是PI-IBS的一个病因, 而且免疫和神经机制对PI-IBS的发生起重要作用. Collins et al[22]认为, 该研究首次在国际上报道了肠志贺菌感染与IBS的相关性, 为说明神经-免疫联接机制在PI-IBS发病机制中的作用, 提供了强有力的证据. 感染可能促进肠黏膜SP表达的增加, 而SP表达增加后, 又促使IFN-γ, IL-2的表达上调, 通过神经-炎症/免疫的途径诱导IBS的发生. 不过不同病原的胃肠道感染(细菌感染或病毒感染)、感染的持续时间等对IBS肠黏膜神经递质与炎症介质表达的影响, 以及炎症在PI-IBS患者感觉动力障碍及症状发生中的作用有待于进一步研究.
神经-炎症/免疫学说是新近提出的IBS发生机制之一, 在肠黏膜内神经和免疫机制之间可能存在某种沟通的渠道或联接机制. 本研究旨在分析感染后IBS患者外周末梢神经与Th1细胞因子IL-2, IFN-γ表达的关系, 为今后从神经-炎症/免疫方面分析研究IBS的发生机制提供理论依据.
现在国内外研究IBS发生机制主要集中于炎症因子与肠黏膜神经之间的关系, 炎症因子主要是Th1细胞因子IL-2, IFN-γ, IL-12等, 肠黏膜神经主要包括P物质、血管活性肠肽、神经特异性烯醇酶等.
目前未有感染后IBS患者肠黏膜SP与IL-2, IFN-γ相关性研究的报道. 本研究发现感染可能促进肠黏膜SP表达的增加, 而SP表达增加后, 又促使IFN-γ, IL-2的表达上调, 通过神经-炎症/免疫的途径诱导IBS的发生.
本研究采用免疫组化检测IBS患者肠黏膜SP, IL-2和IFN-γ的表达, 分析感染在IBS发病机制中对SP与Th1细胞因子表达的影响, 为今后研究神经-炎症/免疫因素在IBS发生机制中的作用提供一定的实验基础.
PI-IBS是目前研究的热点, 但PI-IBS的诊断仍不明确, 本文采用免疫组化检测其肠黏膜SP与IL-2, IFN-γ的表达情况. 探讨PI-IBS的发病机制, 具有一定的临床意义.
编辑: 潘伯荣 电编:张敏
| 1. | Wang LH, Fang XC, Pan GZ. Bacillary dysentery as a causative factor of irritable bowel syndrome and its pathogenesis. Gut. 2004;53:1096-1101. [PubMed] |
| 4. | Neal KR, Barker L, Spiller RC. Prognosis in post-infective irritable bowel syndrome: a six year follow up study. Gut. 2002;51:410-413. [PubMed] |
| 6. | Scheurer U, Wenger F, Caliezi A, Drack E, Varga L, Halter F. Different motor actions of dynorphins and nonpeptide kappa opioid receptor agonists in the isolated rat colon. J Pharmacol Exp Ther. 1990;252:1324-1330. [PubMed] |
| 7. | Kang H, Byun DG, Kim JW. Effects of substance P and vasoactive intestinal peptide on interferon-gamma and interleukin-4 production in severe atopic dermatitis. Ann Allergy Asthma Immunol. 2000;85:227-232. [PubMed] |
| 8. | Hommes DW, van Deventer SJ. Anti- and proinfla-mmatory cytokines in the pathogenesis of tissue damage in Crohn's disease. Curr Opin Clin Nutr Metab Care. 2000;3:191-195. [PubMed] |
| 10. | Qian BF, El-Salhy M, Melgar S, Hammarstrom ML, Danielsson A. Neuroendocrine changes in colon of mice with a disrupted IL-2 gene. Clin Exp Immunol. 2000;120:424-433. [PubMed] |
| 11. | Thompson WG, Longstreth GF, Drossman DA, Heaton KW, Irvine EJ, Muller-Lissner SA. Functional bowel disorders and functional abdominal pain. Gut. 1999;45 Suppl 2:II43-47. [PubMed] |
| 15. | Koon HW, Zhao D, Zhan Y, Simeonidis S, Moyer MP, Pothoulakis C. Substance P-stimulated interleukin-8 expression in human colonic epithelial cells involves protein kinase Cdelta activation. J Pharmacol Exp Ther. 2005;314:1393-1400. [PubMed] |
| 18. | Barbara G, De Giorgio R, Stanghellini V, Cremon C, Corinaldesi R. A role for inflammation in irritable bowel syndrome? Gut. 2002;51 Suppl 1:i41-44. [PubMed] |