修回日期: 2006-09-20
接受日期: 2006-09-28
在线出版日期: 2006-10-28
目的: 探讨慢性萎缩性胃炎(CAG)黏膜上皮中P53及C-erbB-2的表达及意义.
方法: 用免疫组化技术(SP法)检测正常胃黏膜56例、慢性萎缩性胃炎429例(腺体囊性扩张61例, 大肠型化生73例, 轻、中、重度不典型增生各120、91和84例)和早期胃癌57例中P53和C-erbB-2的表达, 分析P53和C-erbB-2表达及其与CAG胃黏膜病变类型的关系.
结果: 正常胃黏膜, 囊性扩张腺体, 轻、中度不典型增生, 大肠型化生, 重度不典型增生, 早期胃癌P53和C-erbB-2表达的阳性率呈上升趋势. 前三组间表达率差异无统计学意义(P>0.05); 正常胃黏膜与中度不典型增生、大肠型化生、重度不典型增生及胃癌组P53和C-erbB-2的表达差异有统计学意义(P<0.01). Spearman等级相关分析显示P53和C-erbB-2表达呈正相关(r = 0.867,P<0.05). 年龄<40岁和≥40岁组间、性别组间P53表达阳性率差异有统计学意义(χ2 = 12.393, P<0.01; χ2 = 8.799, P<0.01). C-erbB-2的表达在上述年龄组间差异有统计学意义(χ2 = 7.706, P<0.01), 而在性别组间无统计学意义(P>0.05).
结论: 检测慢性萎缩性胃炎中P53和C-erbB-2的表达, 有助于监测CAG癌前病变的进展及胃癌的早期发现.
引文著录: 赵松, 付英梅, 赵柏, 刘连新. 慢性萎缩性胃炎黏膜上皮中P53和C-erbB-2表达的临床意义. 世界华人消化杂志 2006; 14(30): 2943-2947
Revised: September 20, 2006
Accepted: September 28, 2006
Published online: October 28, 2006
AIM: To investigate the expression of P53 and C-erbB-2 proteins in chronic atrophic gastritis (CAG) and their correlation with clinicopathological parameters in CAG.
METHODS: SP immunohistochemistry was used to detect the expression of P53 and C-erbB-2 proteins in normal gastric mucosa (n = 56), chronic atrophic gastritis with cystic dysplasia (n = 61), intestinal metaplasia (n = 73), atypical hyperplasia (n= 295) and early gastric carcinoma (n = 57). The relationship between the expression of P53 and C-erbB-2 and the clinicopathological characteristics were analyzed.
RESULTS: The positive rates of P53 and C-erbB-2 protein expression were increased with the malignant degrees of gastric tissues. There were significant differences between normal gastric mucosa, moderate atypical hyperplasia, intestinal metaplasia, severe atypical hyperplasia and gastric carcinoma (P < 0.01). The expression of P53 was notably correlated with the age and gender of patients (χ2 = 12.393, P < 0.01; χ2 = 8.799, P < 0.01), while C-erbB-2 expression was just correlated with the age of patients (χ2 = 7.706, P < 0.01). Besides, the expression of P53 was positively correlated with that of C-erbB-2 (r = 0.867, P < 0.05).
CONCLUSION: P53 and C-erbB-2 expression have significant correlations with the malignancy progression in CAG, and they can help to make early diagnosis for gastric cancer.
- Citation: Zhao S, Fu YM, Zhao B, Liu LX. Expression of P53 and C-erbB-2 and their significances in chronic atrophic gastritis. Shijie Huaren Xiaohua Zazhi 2006; 14(30): 2943-2947
- URL: https://www.wjgnet.com/1009-3079/full/v14/i30/2943.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i30.2943
慢性萎缩性胃炎(chronic atrophic gastrititis, CAG)与胃癌的发生关系密切, 很可能是癌前过程的重要环节之一[1-5]. 由于CAG在病理组织学上包括多种病变, 因此CAG类型与癌变关系的研究是新近胃癌癌前病变中的重要课题[2,6-8]. 胃癌的发生和发展与人体基因组的变化有密切关系, 涉及多个基因突变的过程及多种分子遗传学改变[9-10]. 我们利用免疫组织化学方法, 检测P53及C-erbB-2在CAG中的表达, 进一步探讨其与胃癌发生的关系及临床意义.
1995-01/2003-01尸检、手术及胃镜活检标本存档蜡块CAG共672例, 其中伴轻度不典型增生120例, 中度不典型增生91例, 重度不典型增生84例, 大肠型化生73例(经奥新兰染色证实), 腺体囊性扩张61例, 共计429例(占63.8%). 男302例, 女127例, <40岁108例, ≥40岁321例. 正常胃黏膜56例和早期胃癌(肠型)57例. 所有蜡块均为40 g/L甲醛固定, 常规石蜡包埋, 4 mm厚切片, 分别进行HE和免疫组化染色. 试剂购自福州迈新生物技术开发公司, 鼠抗人P53 mAb (Pab1801)由美国Santa Cruz公司生产, 鼠抗人C-erbB-2为德国Maxim Biotech公司产品.
免疫组化采用SP法, P53, C-erbB-2蛋白测定按照试剂盒说明进行. 采用微波抗原修复, 设阳性和阴性对照. P53阳性表达为细胞核出现棕色颗粒, C-erbB-2阳性表达为细胞膜、胞质中出现棕色颗粒. 结果判定根据Volm et al[11]报道的标准进行, 即每张切片在高倍镜(×400)下计数10个视野, 依着色细胞占视野细胞总数的百分比计分: 阳性细胞<10%为1分, 11%-50%为2分, 51%-75%为3分, >75%为4分. 染色强度计分: 0分, 阴性, 无染色; 1分, 弱阳性, 浅黄色; 2分, 中等, 棕黄色; 3分, 强阳性, 棕褐色. 阳性细胞百分比计分及染色强度计分之和>2者为免疫组化阳性.
统计学处理 采用SPSS 10.0统计软件, χ2检验及求Spearman相关系数.
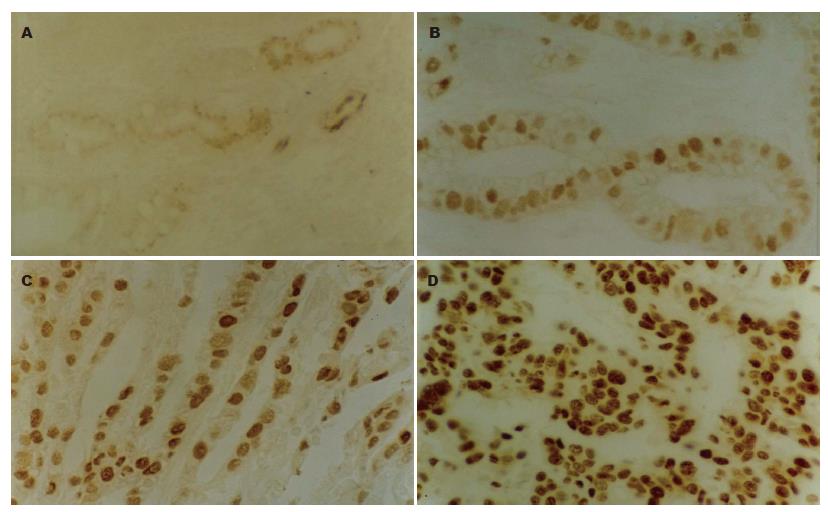
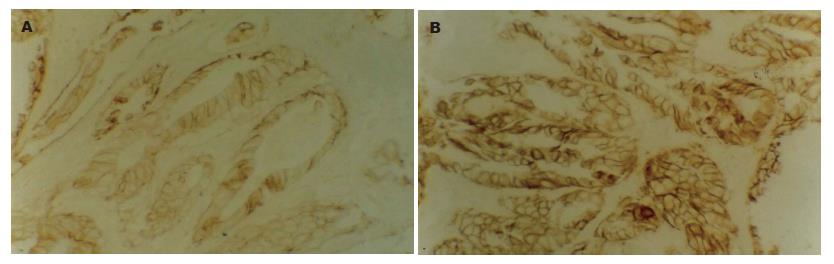
P53表达为腺上皮细胞胞核内出现棕黄(褐)色颗粒, 正常胃黏膜组织中仅见极少数细胞呈微弱阳性表达. CAG中, 轻度不典型增生腺上皮细胞、囊性扩张腺体呈弱阳性表达, 大肠型化生及中度不典型增生腺上皮细胞呈阳性表达(图1A-B). 重度不典型增生及胃癌中表达明显增强(图1C-D). 大肠型化生、中度和重度不典型增生组P53表达阳性率均高于正常胃黏膜组, 差异有统计学意义(χ2 = 11.468, 7.256, 31.994, P<0.01, 表1). 轻度不典型增生和囊性扩张腺体组P53表达阳性率与正常胃黏膜组相比, 差异无统计学意义(χ2 = 0.042, 2.062, P>0.05). 从正常胃黏膜、囊性扩张腺体、轻、中度不典型增生、大肠型化生、重度不典型增生至胃癌, P53的表达率呈上升趋势, 重度不典型增生组接近胃癌组, 差异无统计学意义(χ2 = 0.334, P>0.05). C-erbB-2阳性表达为腺上皮细胞膜及胞质中出现棕黄(褐)色颗粒. 重度不典型增生及胃癌组强阳性表达(图2A-B). 正常胃黏膜上皮细胞见极少数散在的微弱表达(1.7%), 囊性增生腺体及轻度不典型增生腺体为弱阳性表达, 与正常胃黏膜相比差异无统计学意义(χ2 = 0.023, 0.002, P>0.05). C-erbB-2在中度不典型增生、大肠型化生、重度不典型增生及胃癌组中的表达率依次上升, 各组与正常胃黏膜组间差异有统计学意义(χ2 = 8.458, 9.329, 21.813, 34.910, 均P<0.05, 表1).
Spearman等级相关分析显示, 二者表达呈正相关(r = 0.867, P = 0.0 006). P53在年龄<40岁和≥40岁组中的表达率分别为11.1%和27.7%, C-erbB-2在年龄<40岁和≥40岁组中的表达率分别为8.3%和19.9%, 二者在年龄组间的表达差异有统计学意义(χ2 = 12.393, 7.706, P<0.01). P53在性别组间的表达差异也具有统计学意义(χ2 = 8.799, P<0.01), C-erbB-2在性别组间的表达差异无统计学意义(χ2 = 1.684, P>0.05).
胃癌的发生、发展中, 既有抑癌基因的突变, 又有原癌基因的激活[9,12]. 研究表明P53基因是胃癌中最常突变的抑癌基因[10-14], 而c-erbB-2是胃癌中常见的原癌基因变化[15-16]. 本研究利用免疫组化方法检测CAG中P53及C-erbB-2的表达情况, 探讨CAG与胃癌发生的关系. 野生型p53作为一种抑癌基因, 通过调控细胞生长和促进凋亡发挥作用[14,17]. 突变后的P53基因不仅失去了上述作用, 反具有促进细胞恶性转化的功能[18-20]. 野生型P53基因产物半衰期短(<30 min), 用免疫组化方法难以检测, 而突变型P53基因产物的稳定性高, 用免疫组化方法检测出的P53蛋白, 皆为突变型基因产物[14], 因此, 可作为一种辅助诊断胃癌的标志物[21-22]. 我们发现, 从正常胃黏膜、囊性扩张腺体、轻、中度不典型增生、大肠型化生、重度不典型增生至胃癌, P53表达率呈依次上升趋势, 其中重度不典型增生组与胃癌组该基因表达率差异无统计学意义(P>0.05), 而与正常胃黏膜组间差异显著(P<0.001), 说明p53基因的突变在CAG胃黏膜上述病变中广泛存在, 重度不典型增生中其表达已接近于胃癌, 提示P53基因的突变在胃癌癌前病变的后期明显上升. 因此, 检测P53的表达有助于对胃黏膜癌前病变进展的监测.
原癌基因c-erbB-2是细胞基因组的正常成分, 其表达产物在细胞增殖及分化调控中起重要作用. 该基因被激活后, 表现为基因的扩增和产物的高表达, 具有致癌变活性[23-24]. Werner et al[16]发现, 在胃癌及其组织周围的肠化、异型增生胃黏膜中有C-erbB-2表达的明显增加. 本研究发现, 除在正常胃黏膜中该基因的表达率极低(1.7%)外, 囊性扩张和轻度不典型增生腺上皮细胞中也有弱阳性, 大肠型化生和中度不典型增生组阳性表达率增加, 重度不典型增生组和胃癌组均为强阳性表达, 这一发现证明c-erbB-2也参与CAG癌前病变的发生. 本组观察结果表明, 在CAG上述病变中, 既有P53基因的广泛突变, 又有c-erbB-2的广泛激活, 二者表达呈正相关, 提示二者在CAG癌前病变中具有重要作用.
此外, P53和C-erbB-2在<40和≥40中的人群间表达差异显著, 提示年长者更易发生P53和C-erbB-2的改变. 本文中P53在男性的表达率高于女性, 差异具有统计学意义(P<0.01), 分析其原因可能为男性嗜烟酒比例高于女性, 这一发现与吸烟是胃癌发生的危险因素的研究结果一致[25]. 吸烟对P53作用的具体机制尚需进一步研究. 近年来纤维胃镜的广泛应用为CAG病变跟踪观察提供了有利条件[26-27], 根据本文的发现, 对慢性萎缩性胃炎, 应用纤维胃镜活检的免疫病理学观察, 检测P53和C-erbB-2的表达情况, 有助于对胃黏膜病变倾向作出判断, 在胃癌尚未达到病因学一级防治的今天, 对胃癌的早期预防和治疗具有重要临床意义.
慢性萎缩性胃炎(CAG)是胃癌癌前过程的重要环节之一, 但CAG在病理组织学上包括多种病变, 本文研究P53和C-erbB-2在CAG不同病理类型中的表达情况, 分析其与胃癌发生的关系, 有助于监测CAG癌前病变的进展及胃癌的早期发现 .
胃癌的发生、发展涉及多种基因的改变, P53和C-erbB-2是胃癌中常见的基因变化, 其表达与胃癌临床病例类型和恶性程度相关. CAG病理类型与癌变关系的研究是新近胃癌癌前病变中的重要课题, 而与胃癌发生有关的基因在癌前病变中的表达情况也是研究热点.
本文通过检测正常胃黏膜、CAG伴腺体囊性扩张, CAG伴肠上皮化生、CAG伴轻、中、重度不典型增生及胃癌组织中P53和C-erbB-2表达, 分析两者在CAG不同阶段至胃癌的表达情况, 分别探讨这两种基因表达的检测结果与胃癌临床病理参数及预后的关系.
通过CAG胃镜活检的免疫病理学观察, 检测P53和C-erbB-2的表达情况, 有助于对胃黏膜病变倾向作出判断.
通过检测P53和C-erbB-2的表达情况, 将有助于对胃黏膜病变倾向作出判断, 对胃癌的早期预防和治疗具有一定临床意义. 本文选题为临床所需, 实用性较强.
电编: 李琪 编辑:潘伯荣
| 1. | Tan YK, Fielding JW. Early diagnosis of early gastric cancer. Eur J Gastroenterol Hepatol. 2006;18:821-829. [PubMed] [DOI] |
| 2. | Kapadia CR. Gastric atrophy, metaplasia, and dysplasia: a clinical perspective. J Clin Gastroenterol. 2003;36:S29-S36; discussion S61-S62. [PubMed] |
| 3. | Ali M, Khan AA, Tiwari SK, Ahmed N, Rao LV, Habibullah CM. Association between cag-pathogenicity island in Helicobacter pylori isolates from peptic ulcer, gastric carcinoma, and non-ulcer dyspepsia subjects with histological changes. World J Gastroenterol. 2005;11:6815-6822. [PubMed] [DOI] |
| 4. | Malfertheiner P, Sipponen P, Naumann M, Moayyedi P, Megraud F, Xiao SD, Sugano K, Nyren O. Helicobacter pylori eradication has the potential to prevent gastric cancer: a state-of-the-art critique. Am J Gastroenterol. 2005;100:2100-2115. [PubMed] [DOI] |
| 5. | Wong BC, Lam SK, Wong WM, Chen JS, Zheng TT, Feng RE, Lai KC, Hu WH, Yuen ST, Leung SY. Helicobacter pylori eradication to prevent gastric cancer in a high-risk region of China: a randomized controlled trial. JAMA. 2004;291:187-194. [PubMed] [DOI] |
| 6. | Leung WK, Ng EK, Chan WY, Auyeung AC, Chan KF, Lam CC, Chan FK, Lau JY, Sung JJ. Risk factors associated with the development of intestinal metaplasia in first-degree relatives of gastric cancer patients. Cancer Epidemiol Biomarkers Prev. 2005;14:2982-2986. [PubMed] [DOI] |
| 7. | Zhang C, Yamada N, Wu YL, Wen M, Matsuhisa T, Matsukura N. Helicobacter pylori infection, glandular atrophy and intestinal metaplasia in superficial gastritis, gastric erosion, erosive gastritis, gastric ulcer and early gastric cancer. World J Gastroenterol. 2005;11:791-796. [PubMed] [DOI] |
| 8. | Leung WK, Lin SR, Ching JY, To KF, Ng EK, Chan FK, Lau JY, Sung JJ. Factors predicting progression of gastric intestinal metaplasia: results of a randomised trial on Helicobacter pylori eradication. Gut. 2004;53:1244-1249. [PubMed] [DOI] |
| 9. | Tamura G. Alterations of tumor suppressor and tumor-related genes in the development and progression of gastric cancer. World J Gastroenterol. 2006;12:192-198. [PubMed] [DOI] |
| 11. | Volm M, Koomagi R, Mattern J, Efferth T. Expression profile of genes in non-small cell lung carcinomas from long-term surviving patients. Clin Cancer Res. 2002;8:1843-1848. [PubMed] |
| 12. | Hofler H, Becker KF. Molecular mechanisms of carcinogenesis in gastric cancer. Recent Results Cancer Res. 2003;162:65-72. [PubMed] [DOI] |
| 13. | Fricke E, Keller G, Becker I, Rosivatz E, Schott C, Plaschke S, Rudelius M, Hermannstadter C, Busch R, Hofler H. Relationship between E-cadherin gene mutation and p53 gene mutation, p53 accumulation, Bcl-2 expression and Ki-67 staining in diffuse-type gastric carcinoma. Int J Cancer. 2003;104:60-65. [PubMed] [DOI] |
| 14. | Xi YG, Ding KY, Su XL, Chen DF, You WC, Shen Y, Ke Y. p53 polymorphism and p21WAF1/CIP1 haplotype in the intestinal gastric cancer and the precancerous lesions. Carcinogenesis. 2004;25:2201-2206. [PubMed] [DOI] |
| 15. | Agnantis NJ, Goussia AC, Stefanou D. Tumor markers. An update approach for their prognostic significance. Part I. In Vivo. 2003;17:609-618. [PubMed] |
| 16. | Werner M, Becker KF, Keller G, Hofler H. Gastric adenocarcinoma: pathomorphology and molecular pathology. J Cancer Res Clin Oncol. 2001;127:207-216. [PubMed] [DOI] |
| 17. | Semenza GL. VHL and p53: tumor suppressors team up to prevent cancer. Mol Cell. 2006;22:437-439. [PubMed] [DOI] |
| 18. | Laurent-Puig P, Zucman-Rossi J. Genetics of hepatocellular tumors. Oncogene. 2006;25:3778-3786. [PubMed] [DOI] |
| 19. | Gobbo Cesar AC, de Freitas Calmon M, Cury PM, Caetano A, Borim AA, Silva AE. Genetic alterations in benign lesions: chronic gastritis and gastric ulcer. World J Gastroenterol. 2006;12:625-629. [PubMed] [DOI] |
| 20. | Watanabe T, Katayama Y, Yoshino A, Komine C, Yokoyama T. Deregulation of the TP53/p14ARF tumor suppressor pathway in low-grade diffuse astrocytomas and its influence on clinical course. Clin Cancer Res. 2003;9:4884-4890. [PubMed] |
| 21. | Cho-Chung YS. Autoantibody biomarkers in the detection of cancer. Biochim Biophys Acta. 2006;1762:587-591. [PubMed] |
| 22. | Nesterova M, Johnson N, Cheadle C, Cho-Chung YS. Autoantibody biomarker opens a new gateway for cancer diagnosis. Biochim Biophys Acta. 2006;1762:398-403. [PubMed] |
| 23. | Meert AP, Martin B, Paesmans M, Berghmans T, Mascaux C, Verdebout JM, Delmotte P, Lafitte JJ, Sculier JP. The role of HER-2/neu expression on the survival of patients with lung cancer: a systematic review of the literature. Br J Cancer. 2003;89:959-965. [PubMed] [DOI] |
| 24. | Rogers SJ, Harrington KJ, Rhys-Evans P, O-Charoenrat P, Eccles SA. Biological significance of c-erbB family oncogenes in head and neck cancer. Cancer Metastasis Rev. 2005;24:47-69. [PubMed] [DOI] |
| 25. | Layke JC, Lopez PP. Gastric cancer: diagnosis and treatment options. Am Fam Physician. 2004;69:1133-1140. [PubMed] |
| 26. | Yang JM, Chen L, Fan YL, Li XH, Yu X, Fang DC. Endoscopic patterns of gastric mucosa and its clinicopathological significance. World J Gastroenterol. 2003;9:2552-2556. [PubMed] |