修回日期: 2006-09-01
接受日期: 2006-09-28
在线出版日期: 2006-10-18
目的: 探讨肝癌细胞系放射诱导的细胞周期和细胞凋亡的变化特点.
方法: 研究细胞系为肝癌细胞系HepG2和SMMC-7721, 对照细胞系为正常肝细胞系HL-7702、肺小细胞癌HCI-H460和肺腺癌A549. 常规培养48 h后接受4Gy射线照射, 收获受照前(0 h)和受照后6, 12, 24, 36和48 h的细胞, 采用流式细胞术(FCM)检测各细胞系细胞周期和细胞凋亡.
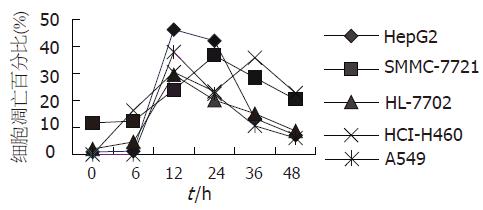
结果: 4Gy X线照射后, HepG2在照射后12 h出现细胞凋亡高峰, 射线诱导的细胞凋亡比率为45.16% (t = 8.864, P<0.0025), 而SMMC-7721在24 h达高峰, 诱导的细胞凋亡比率为24.94%, HepG2较SMMC-7721射线诱导的细胞凋亡高峰出现早、比率高; HepG2和SMMC-7721与HCI-H460和A549变化较一致, 凋亡变化的走势和峰值均与S期的相反, 两株肝癌细胞可能均发生了射线诱导的有丝分裂前S期细胞凋亡. HepG2在照射后12 h有明显的G2/M期阻滞, 可能有射线诱导的G2/M期细胞损伤, 发生了延迟的间期死亡.
结论: 两株肝癌细胞可能均发生了射线诱导的有丝分裂前S期细胞凋亡, HepG2可能伴有射线诱导的G2/M期细胞损伤, 发生了延迟的间期死亡.
引文著录: 董广璐, 邢丽娜, 刘晓滨, 刘伟, 金茜, 张淑云. 肝癌细胞系放射诱导的细胞凋亡和细胞周期的变化. 世界华人消化杂志 2006; 14(29): 2834-2837
Revised: September 1, 2006
Accepted: September 28, 2006
Published online: October 18, 2006
AIM: To analyze the properties of radiation-induced apoptosis and cell cycle changes in liver cancer cell lines.
METHODS: Liver cancer cell lines HepG2 and SMMC-7721 were included in this study, and normal liver cell line HL-7702, pulmonary small cell carcinoma cell line HCI-H460 and lung adenocarcinoma cell line A549 were used as controls. After routine culture for 48 h, all the cells were irradiated under 4Gy X-radiation. The cell cycle and apoptosis were detected by flow cytometry (FCM) before and 6, 12, 24, 36, 48 h after irradiation.
RESULTS: After irradiation, cell apoptosis started from the 6th h and reached to the peak at 12 h in HepG2 cells (ΔApoHepG2= 45.16%, t = 8.864, P < 0.0025), while at 24 h in SMMC-7721 cells (ΔApo7721 = 24.94%). In comparison with SMMC-7721 cells, HepG2 cells had an earlier and higher apoptosis peak. The cell cycle and apoptosis were generally in the same situation in HCI-H460 and A549 cells as those in SMMC-7721 and HepG2 cells. The pre-S-phase cell apoptosis was found in both kinds of liver cancer cells. Significant blockage of G2/M phase occurred 12 h after irradiation.
CONCLUSION: After 4Gy X-radiation, premitotic apoptosis occurs both in HepG2 and SMMC-7721 cells. Furthermore, X-radiation may induce G2/M-phase cell injuries and deaths in HepG2 cells.
- Citation: Dong GL, Xing LN, Liu XB, Liu W, Jin Q, Zhang SY. Properties of radiation-induced apoptosis and cell cycle changes in liver cancer cell lines. Shijie Huaren Xiaohua Zazhi 2006; 14(29): 2834-2837
- URL: https://www.wjgnet.com/1009-3079/full/v14/i29/2834.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i29.2834
射线诱导的肿瘤细胞凋亡是放射治疗的主要机制之一, 与肿瘤组织细胞放射敏感性或放射抗性有关[1-2]. 在临床放射治疗中, 不同组织器官或不同组织来源的肿瘤具有不同的放射敏感性, 如肺小细胞癌较肺腺癌或宫颈癌放射敏感性高. 对体外细胞系的研究也表明, 同种组织不同个体或不同组织来源的细胞系放射敏感性不同[3]. 这可能与射线诱导的依赖细胞周期的细胞凋亡特点不同有关[4-5]. 为了更好的利用细胞系开展放射治疗的相关研究, 我们对我院科研实验中心正在使用的肝癌细胞系放射诱导的细胞周期和细胞凋亡的特点进行了研究.
肝癌细胞系HepG2和SMMC-7721, 正常肝细胞系HL-7702, 肺小细胞癌细胞系HCI-H460和肺腺癌细胞系A549均购于中国医学科学院上海肿瘤研究所. 直线加速器为XHA600C(山东新华医疗器械厂). 流式细胞仪为FAC sort(美国BD公司). 流式细胞术(FCM)检测所用试剂为Becton Dickinson公司的试剂盒(Cycle TestTM Plus DNA Reagent Kit).
以肝癌细胞系HepG2和SMMC-7721为研究细胞系, 以正常肝细胞系HL-7702为同种组织对照细胞系, 以放射敏感的肺小细胞癌细胞系HCI-H460和相对放射抗拒的肺腺癌细胞系A549为不同肿瘤组织对照细胞系; 用含100 mL/L小牛血清的DMEM常规培养细胞, 5×105个/孔接种6孔板, 培养48 h. 用4Gy X线照射(剂量率: 250 cGy/min)后, 继续培养受照细胞. 按试剂盒要求收获照射前0 h和照射后6, 12, 24, 36和48 h的细胞, 并用FCM进行细胞周期和细胞凋亡检测.
统计学处理 率的比较采用t检验, P<0.05有统计学意义.
4Gy X线照射后6 h HepG2和SMMC-7721与HL-7702和A549较一致均未诱导明显的细胞凋亡, 照射后12 h均诱导了明显的细胞凋亡, 诱导的细胞凋亡率 分别为45.16%, 12.25%, 27.45%和37.93%, 而且HepG2和HL-7702, A549一样达到高峰, 诱导了显著的细胞凋亡(t = 8.864, P<0.0025). 而SMMC-7721在24 h达高峰, 诱导的细胞凋亡率为24.94%, 接近HL-7702在12 h时诱导的细胞凋亡水平. 没有细胞系与HCI-H460一致, 在射线照射后6 h即诱导了明显的细胞凋亡, 在12 h达高峰, 而且在36 h出现第二个细胞凋亡峰, 两峰分别为30.41%和35.79%. 两株肝癌细胞在放射前后也呈现不同的细胞凋亡特点, HepG2在照射前细胞凋亡水平较低, 在照射后12 h诱导了较高的细胞凋亡比率, 而SMMC-7721在照射前细胞凋亡水平较高, 在照射后24 h才诱导了较高的细胞凋亡比率, 低于HepG2(24.94% vs 45.16%).
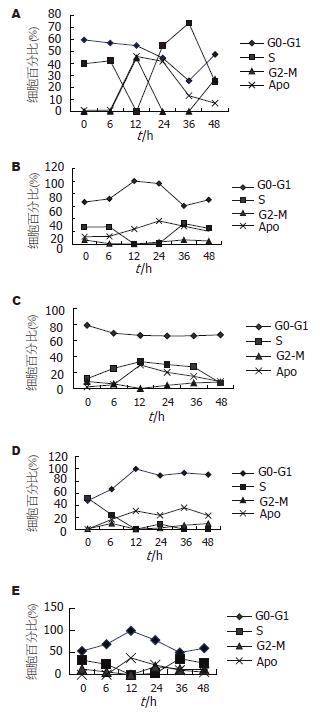
在G0/G1期, HepG2和HL-7702较一致, 呈现先降后升或平的走势; SMMC-7721和HCI-H460、A549较一致, 呈现先升后降的走势. 各株细胞在多个时间点均呈现较高的比例(>40%), 只是HepG2在24 h和36 h呈明显降低. 在G2/M期, HepG2、SMMC-7721和HL-7702以及HCI-H460和A549在多个时间点均呈现较低的比例(<20%), 只是HepG2在12 h和48 h呈明显增高. 在细胞周期的S期, HepG2和SMMC-7721与HCI-H460和A549走势较一致, 均先降后升, 且均在12 h降为最低, 而HL-7702则成相反走势先升后降.
HepG2和SMMC-7721与HCI-H460和A549相似, 在照射后细胞的凋亡峰值均与S期的最低值相对, 射线诱导的细胞凋亡变化和S期成相反走势, 射线诱导的细胞凋亡可能主要发生在有丝分裂前S期(图2A-B, D-E). 没有细胞株与HCI-H460相似, 在射线照射后6 h即诱导了明显的细胞凋亡, 在12 h达高峰, 在36 h出现第二个细胞凋亡峰, 可能也发生了快速间期细胞凋亡和细胞周期延迟异常的有丝分裂期凋亡, 该细胞系在照射后48 h未有明显的细胞周期的恢复(图2D). HepG2在照射后12 h, 出现G2/M期高峰, 可能有G2/M期阻滞. HepG2和SMMC-7721与HL-7702和A549相似, 在照射后24-48 h均有细胞周期的恢复(图2A-C, E).
近年来, 对放射诱导的细胞凋亡与细胞周期的关系及其分子机制均有了较深入的认识[5-11]. 依据不同的实验技术分析可得出不同模式的细胞凋亡. 用染料排除实验(dye exclusion test)可分析间期细胞死亡(interphase death), 用集落生成实验(clonogenic assay)可分析细胞增殖性死亡(reproductive death), 能切实反映细胞的放射敏感性. 而FCM能够很好地分析细胞凋亡与细胞周期变化的关系[5,12-13], 已得出几种模式: (1)快速间期死亡(rapid interphase death), 发生在射线照射后5-6 h以内, 主要是由DNA双链断裂识别系统启动S期细胞死亡; 延迟的间期死亡(delayed interphase death), 发生在G2期阻滞后, 主要依赖G2期细胞的损伤; 有丝分裂或延迟的有丝分裂死亡(mitotic/delayed mitotic death), 发生在一次或几次有丝分裂后, 主要由于致命的染色体异常所致. (2)快速间期凋亡(rapid interphase apoptosis), 同快速间期死亡; 延迟异常的有丝分裂凋亡(delayed aberrant mitotic apoptosis), 有一个长时间的细胞周期延迟, 细胞死亡发生在照射后36-60 h; 有丝分裂后间期凋亡(postmitotic interphase apoptosis), 主要发生在一次或几次有丝分裂后S期细胞. (3)有丝分裂前凋亡(premitotic apoptosis)和有丝分裂后凋亡(postmitotic apoptosis). 我们通过对肝癌细胞HepG2和SMMC-7721在4Gy X线照射后细胞凋亡和细胞周期进行检测, 并与同种组织的正常肝细胞系HL-7702, 不同肿瘤组织细胞系HCI-H460和A549的检测结果比较分析表明, HepG2与HL-7702, A549和HCI-H460较一致, 在射线照射后6-12 h诱导了明显的细胞凋亡, 且达高峰; 而SMMC-7721略有不同, 在射线照射后6-24 h诱导了明显的细胞凋亡, 且达高峰; HepG2和SMMC-7721以及HL-7702和A549均未出现HCI-H460射线诱导的细胞凋亡特点, 即在射线照射后6 h即诱导了明显的细胞凋亡, 在12 h达高峰, 而且在36 h出现第二个细胞凋亡峰. HCI-H460是小细胞肺癌细胞株, 对射线敏感, 本实验中该细胞系呈现的射线诱导的细胞凋亡特点与其放射敏感性较一致, 而A549是肺腺癌细胞株, 对射线有一定的抗拒性, 两株肝癌细胞和正常肝细胞与其呈现了较相似的射线诱导的细胞凋亡特点. 两株肝癌细胞在放射前后也呈现不同的细胞凋亡特点, HepG2较SMMC-7721射线诱导的细胞凋亡峰出现早、比率高.
将细胞凋亡变化和细胞周期变化综合分析发现, HepG2和SMMC-7721与HCI-H460和A549变化模式较一致, 凋亡变化的走势和峰值均与S期的相反, 可能发生了有丝分裂前S期细胞凋亡. HCI-H460在照射后6 h内即发生明显细胞凋亡, 可能发生了快速间期凋亡; 该细胞又在36 h出现第二个细胞凋亡峰, 可能发生了细胞周期延迟异常的有丝分裂凋亡, 使该细胞在48 h时也未有明显的细胞周期的恢复. HepG2和SMMC-7721, 以及A549和HL-7702不同于HCI-H460, 均未出现快速间期凋亡和细胞周期延迟异常的有丝分裂凋亡, 使这些细胞在48 h时已有明显的细胞周期的恢复. HepG2在照射后12 h有明显的G2/M期阻滞, 也使该细胞在该时间点被诱导了较高水平的细胞凋亡, 但在48 h则表现为最低水平的凋亡, 这与Liu et al[14]的报道较一致.
在我们的研究中同种组织不同性质或来源的细胞呈现了不同的细胞周期和细胞凋亡特点, 进一步证实射线诱导的细胞凋亡和细胞周期变化有组织细胞依赖性, 可能有不同的分子机制的参与[15-17], 有待进一步研究. 另外提示, 在以细胞凋亡为指标的放射生物学研究中, 一定要考虑特定组织细胞放射诱导的细胞凋亡和细胞周期的特点, 选择合适的研究剂量和检测时间点.
射线照射不仅使受照组织细胞坏死, 更可诱导组织细胞凋亡, 是肿瘤放射治疗的主要机制. 射线诱导细胞凋亡的发生与射线剂量、细胞周期和组织源性等有关. 大剂量(20Gy)射线可使受照细胞在4-6 h内发生快速细胞凋亡, 主要发生在细胞周期S相的细胞, 伴有caspase-3的快速激活. 低剂量(5Gy)射线照射使受照细胞在24 h后发生延迟细胞凋亡, 主要发生在细胞周期G1相的细胞, 且在24 h内不伴有caspase-3的激活. 但EL-4细胞即使在20Gy射线照射下也只发生延迟细胞凋亡. 这种差异的确切机制尚不清楚, 可能与细胞凋亡信号传导系统和DNA损伤修复系统功能有关, 决定了组织细胞的放射敏感性.
不同的射线剂量和照射后时间诱导的基因转录谱和蛋白表达谱差异的研究是目前研究的热点, 有助于阐明放射诱导的细胞凋亡的机制.
本文同时对比研究了肝癌细胞HepG2和SMMC-7721, 同种组织的正常肝细胞系HL-7702, 不同肿瘤组织细胞系HCI-H460和A549在4Gy X射线照射后细胞凋亡和细胞周期变化特点, 为以细胞凋亡为指标的放射生物学研究者选择合适的研究剂量和检测时间点提供了实验依据.
在以细胞凋亡为指标的放射生物学研究中, 一定要考虑特定组织细胞放射诱导的细胞凋亡和细胞周期的特点, 选择合适的研究剂量和检测时间点.
本文以探讨了肝癌细胞系放射诱导的细胞周期和细胞凋亡的变化特点. 课题设计合理, 实验流程清晰, 结论及分析论点明确. 其实验结果对临床工作有一定的指导意义.
电编: 李琪 编辑:张焕兰
| 3. | Otomo T, Hishii M, Arai H, Sato K, Sasai K. Microarray analysis of temporal gene responses to ionizing radiation in two glioblastoma cell lines: up-regulation of DNA repair genes. J Radiat Res (Tokyo). 2004;45:53-60. [PubMed] [DOI] |
| 4. | Pawlik TM, Keyomarsi K. Role of cell cycle in mediating sensitivity to radiotherapy. Int J Radiat Oncol Biol Phys. 2004;59:928-942. [PubMed] [DOI] |
| 5. | Shinomiya N. New concepts in radiation-induced apoptosis: 'premitotic apoptosis' and 'postmitotic apoptosis'. J Cell Mol Med. 2001;5:240-253. [PubMed] [DOI] |
| 6. | Ding LH, Shingyoji M, Chen F, Hwang JJ, Burma S, Lee C, Cheng JF, Chen DJ. Gene expression profiles of normal human fibroblasts after exposure to ionizing radiation: a comparative study of low and high doses. Radiat Res. 2005;164:17-26. [PubMed] [DOI] |
| 7. | Nome RV, Bratland A, Harman G, Fodstad O, Andersson Y, Ree AH. Cell cycle checkpoint signaling involved in histone deacetylase inhibition and radiation-induced cell death. Mol Cancer Ther. 2005;4:1231-1238. [PubMed] [DOI] |
| 8. | Ross GM. Induction of cell death by radiotherapy. Endocr Relat Cancer. 1999;6:41-44. [PubMed] [DOI] |
| 9. | Blakely EA. Radiation-induced changes in a cell's program for life. Acta Oncol. 1998;37:127-128. [PubMed] [DOI] |
| 10. | Nakajima T. Signaling cascades in radiation-induced apoptosis: Roles of protein kinase C in the apoptosis regulation. Med Sci Monit. 2006;12:RA220-RA224. [PubMed] |
| 11. | Lee YJ, Soh JW, Dean NM, Cho CK, Kim TH, Lee SJ, Lee YS. Protein kinase Cdelta overexpression enhances radiation sensitivity via extracellular regulated protein kinase 1/2 activation, abolishing the radiation-induced G(2)-M arrest. Cell Growth Differ. 2002;13:237-246. [PubMed] |
| 12. | Huang X, Halicka HD, Traganos F, Tanaka T, Kurose A, Darzynkiewicz Z. Cytometric assessment of DNA damage in relation to cell cycle phase and apoptosis. Cell Prolif. 2005;38:223-243. [PubMed] [DOI] |
| 13. | Darzynkiewicz Z, Huang X, Okafuji M. Detection of DNA strand breaks by flow and laser scanning cytometry in studies of apoptosis and cell proliferation (DNA replication). Methods Mol Biol. 2006;314:81-93. [PubMed] [DOI] |
| 14. | Liu ZZ, Huang WY, Li XS, Lin JS, Cai XK, Lian KH, Zhou HJ. Prediction value of radiosensitivity of hepatocarcinoma cells for apoptosis and micronucleus assay. World J Gastroenterol. 2005;11:7036-7039. [PubMed] [DOI] |
| 15. | Fabbro M, Savage K, Hobson K, Deans AJ, Powell SN, McArthur GA, Khanna KK. BRCA1-BARD1 complexes are required for p53Ser-15 phosphorylation and a G1/S arrest following ionizing radiation-induced DNA damage. J Biol Chem. 2004;279:31251-31258. [PubMed] [DOI] |
| 16. | Essmann F, Engels IH, Totzke G, Schulze-Osthoff K, Janicke RU. Apoptosis resistance of MCF-7 breast carcinoma cells to ionizing radiation is independent of p53 and cell cycle control but caused by the lack of caspase-3 and a caffeine-inhibitable event. Cancer Res. 2004;64:7065-7072. [PubMed] [DOI] |
| 17. | Raffoul JJ, Wang Y, Kucuk O, Forman JD, Sarkar FH, Hillman GG. Genistein inhibits radiation-induced activation of NF-kappaB in prostate cancer cells promoting apoptosis and G2/M cell cycle arrest. BMC Cancer. 2006;6:107. [PubMed] [DOI] |